جدول المحتويات
- مقدمة في تحضير عينة التفلور الراديوي بالأشعة السينية
- حجم الجسيمات: أساس التحضير الناجح للحبيبات
- التلوث: المخرب الصامت في تحليل التفلور الراديوي الطيفي XRF
- اختيار المواد الرابطة: مفتاح الكريات المتجانسة
- سُمك الحبيبات: ضمان عمق كافٍ لأخذ العينات
- تطبيق الضغط: موازنة الضغط والتجانس
- نسبة التخفيف: الضبط الدقيق للحصول على نتائج دقيقة
- التلوث المتبادل بين العينات: منع التداخل
- أفضل الممارسات للحد من الأخطاء في إعداد حبيبات التفلور الراديوي بالأشعة السينية
- الخاتمة: تحقيق الدقة في تحليل التفلور الراديوي بالأشعة السينية
مقدمة في تحضير عينة التفلور الراديوي بالأشعة السينية
في مجال تحليل التفلور بالأشعة السينية (XRF)، تُعد دقة تحضير العينات أمرًا بالغ الأهمية للحصول على نتائج دقيقة وموثوقة. ويؤدي كبس الكريات دورًا حاسمًا في هذه العملية، مما يضمن تجانس العينات وجاهزيتها للتحليل. ومع ذلك، يمكن أن تؤدي المشكلات الشائعة مثل حجم الجسيمات غير المناسب، والتلوث، والاختيار غير الصحيح للمادة الرابطة وعدم كفاية تطبيق الضغط إلى أخطاء كبيرة. تتناول هذه المقالة المزالق الأكثر شيوعًا في إعداد عينات PELLET PRESS XRF SAMPLE PREPARATION وتقدم حلولًا عملية للتغلب عليها، مما يرشدك في النهاية نحو تحقيق أعلى مستوى من الدقة في تحليل التفلور الراديوي الطيفي.
حجم الجسيمات: أساس التحضير الناجح للحبيبات
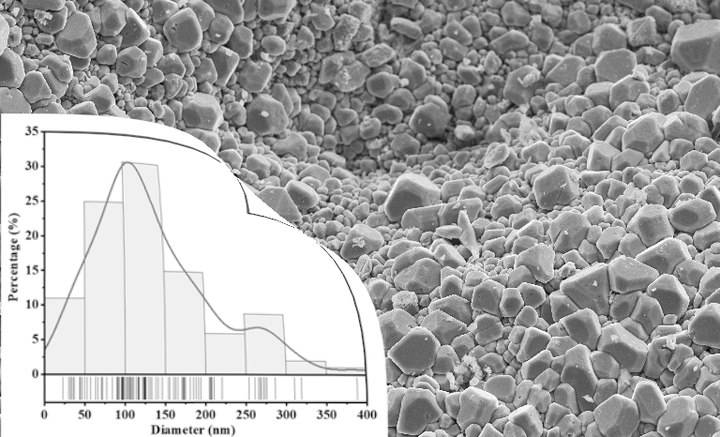
يعد حجم الجسيمات عاملًا حاسمًا في تحضير الكريات المضغوطة، مما يؤثر بشكل كبير على دقة النتائج التحليلية وموثوقيتها. يعد تحقيق حجم الجسيمات المثالي، الذي عادةً ما يكون أقل من 50 ميكرومتر، أمرًا ضروريًا لعدة أسباب. أولاً، تضمن أحجام الجسيمات الأصغر حجمًا تجانسًا أفضل داخل العينة. عندما تكون الجسيمات كبيرة جدًا أو متفاوتة في الحجم، يمكن أن يؤدي ذلك إلى تناقضات في توزيع العناصر داخل الحبيبات مما قد يؤدي إلى بيانات تحليلية منحرفة.
أهمية الحجم الموحد للجسيمات
يعد حجم الجسيمات المنتظم أمرًا بالغ الأهمية لعدة أسباب. تسمح الجسيمات الأصغر حجمًا بضغط وترابط أكثر كفاءة عند ضغط الحبيبات. يضمن هذا التوحيد انضغاط العينة بالتساوي، مما يؤدي إلى نتيجة تحليلية أكثر اتساقًا وموثوقية. في المقابل، يمكن أن تؤدي أحجام الجسيمات الأكبر أو المتغيرة إلى عدم التجانس داخل الكريات، حيث قد تحتوي مناطق مختلفة من الكريات على تركيزات مختلفة من العناصر. يمكن أن يؤدي عدم التجانس هذا إلى قراءات خاطئة، حيث قد لا تقوم المعدات التحليلية بأخذ عينات من الحبيبات بأكملها بشكل موحد.
تحقيق الحجم المثالي للجسيمات
لتحقيق حجم الجسيمات المثالي الذي يقل عن 50 ميكرومتر، يمكن استخدام تقنيات مختبرية مختلفة. تشمل الطرق الشائعة استخدام الكسارات والمطاحن والمطاحن لتقليل حجم جسيمات العينة قبل الضغط. ويعتبر من المقبول عادةً أن يكون قطر الجسيمات 40 ميكرومتر أو أقل. تضمن هذه التقنيات أن تكون العينة مطحونة بشكل دقيق، مما يسمح بتوحيد واتساق أفضل في الحبيبات النهائية.
تأثير حجم الجسيمات على النتائج التحليلية
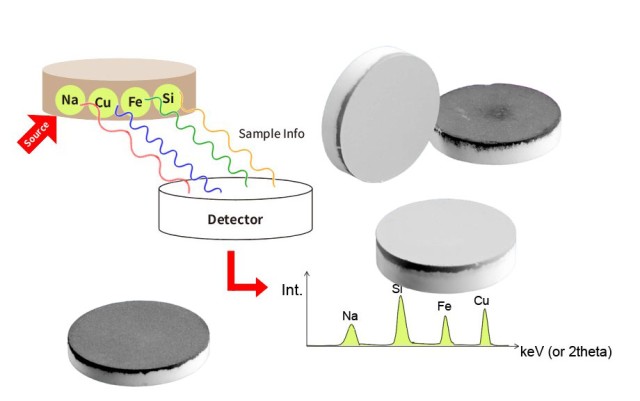
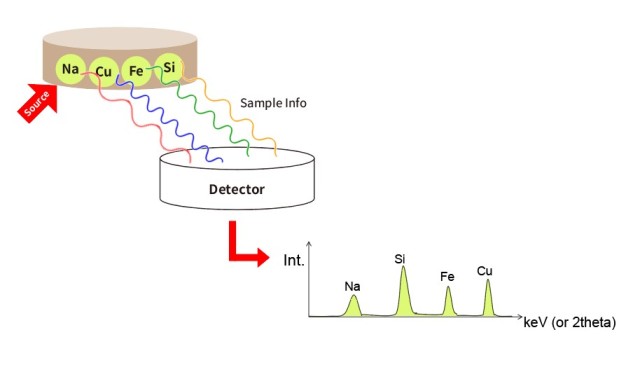
لا يمكن المبالغة في تأثير حجم الجسيمات على النتائج التحليلية. تعد أحجام الجسيمات الأصغر حجمًا أمرًا بالغ الأهمية لإنتاج كريات توفر أفضل النتائج التحليلية. على سبيل المثال، في تحليل التألق بالأشعة السينية (XRF)، يعتمد عمق أخذ العينات أو عمق الهروب الحرج للعناصر داخل العينة على الطاقة. فالعناصر ذات الطول الموجي الأطول مثل الصوديوم (Na) لها عمق هروب أصغر من العناصر ذات الطول الموجي الأقصر مثل الحديد (Fe). وهذا يعني أن تحليل Na لا يأخذ عينات سوى أول 10 ميكرومتر أو نحو ذلك من العينة. لذلك، فإن أي عدم تجانس داخل هذا العمق الضحل يمكن أن يؤثر بشكل كبير على دقة التحليل.
في المقابل، يمكن أن تؤدي أحجام الجسيمات الأكبر أو المتغيرة إلى عدم تجانس العينة. يمكن أن تؤدي هذه التباينات إلى توزيع غير متجانس للعناصر داخل الكريات، مما يؤدي إلى بيانات تحليلية غير موثوقة. على سبيل المثال، إذا كانت الحبيبات تحتوي على مناطق ذات أحجام جسيمات متفاوتة، فقد لا تأخذ المعدات التحليلية عينات من هذه المناطق بشكل موحد، مما يؤدي إلى اختلافات في تركيزات العناصر المقيسة.
أفضل الممارسات للتحكم في حجم الجسيمات
لضمان الحصول على أفضل النتائج التحليلية الممكنة، من الضروري اتباع أفضل الممارسات للتحكم في حجم الجسيمات. ويشمل ذلك استخدام تقنيات الطحن والطحن المناسبة لتحقيق حجم جسيمات موحد أقل من 50 ميكرومتر. يعد الاهتمام بالتفاصيل والاتساق في عملية التحضير أمرًا بالغ الأهمية أيضًا. من خلال ضمان طحن العينة إلى حجم الجسيمات المثالي، يمكن للمحللين تقليل مخاطر عدم التجانس وتحقيق نتائج تحليلية أكثر دقة وموثوقية.
باختصار، حجم الجسيمات هو أساس التحضير الناجح للحبيبات. يعد تحقيق حجم جسيمات موحد أقل من 50 ميكرومتر والحفاظ عليه أمرًا بالغ الأهمية لضمان تجانس العينة، مما يؤدي بدوره إلى نتائج تحليلية أكثر دقة وموثوقية. باتباع أفضل الممارسات وإيلاء اهتمام وثيق لعملية التحضير، يمكن للمحللين تحسين جودة بياناتهم التحليلية بشكل كبير.
التلوث: المخرب الصامت في تحليل التفلور الراديوي الطيفي XRF
يعد التلوث أحد أهم التحديات في تحليل التفلور بالأشعة السينية (XRF)، خاصةً أثناء عملية تحضير العينة. وتعد مرحلة الطحن نقطة حرجة حيث يمكن أن يحدث التلوث بسهولة، مما يؤدي إلى نتائج غير دقيقة ومضللة. يعد فهم مصادر التلوث، وتنفيذ طرق الوقاية الفعالة، والتعرف على عواقب التلوث أمرًا ضروريًا للحفاظ على سلامة تحليل التفلور الراديوي الطيفي بالأشعة السينية.
مصادر التلوث
يمكن أن ينشأ التلوث في تحليل التفلور الراديوي الطيفي بالأشعة السينية من مصادر مختلفة، ولكن عملية الطحن معرضة بشكل خاص. فأثناء الطحن، يمكن إدخال مكونات خارجية من أداة تحضير العينة عن غير قصد في العينة. ويمكن أن يحدث هذا إذا لم يتم تنظيف أدوات الطحن أو الحاويات بشكل صحيح بين العينات، مما يؤدي إلى تلوث تبادلي. على سبيل المثال، يمكن أن تبقى البقايا من العينات السابقة على أدوات الطحن وتنتقل إلى العينة الجديدة، مما يؤدي إلى تغيير تركيبها العنصري.
مصدر آخر شائع للتلوث هو استخدام مواد غير مناسبة لتحضير العينات. على سبيل المثال، إذا كانت أدوات الطحن مصنوعة من مواد يمكن أن تتساقط منها جسيمات أو إذا كانت الحاويات غير خاملة، يمكن أن تدخل هذه المواد عناصر غير مرغوب فيها إلى العينة. وبالإضافة إلى ذلك، يمكن أن تساهم العوامل البيئية مثل الغبار والرطوبة والأبخرة الكيميائية في المختبر في التلوث.
طرق منع التلوث
يتطلب منع التلوث في تحليل التفلور الراديوي بالأشعة السينية اهتمامًا دقيقًا بالتفاصيل وتنفيذ بروتوكولات صارمة. تتمثل إحدى أكثر الطرق فعالية في ضمان تنظيف جميع أدوات الطحن والحاويات وتعقيمها تمامًا قبل كل استخدام. ويمكن تحقيق ذلك باستخدام مذيبات أو مواد تنظيف متخصصة متوافقة مع المواد التي يتم تحليلها.
هناك استراتيجية أخرى تتمثل في استخدام مواد خاملة لأدوات الطحن والحاويات. فالمواد مثل زجاج البورسليكات أو الألومينا عالية النقاء أقل عرضة لإدخال الملوثات في العينة. بالإضافة إلى ذلك، من المهم العمل في بيئة نظيفة، ويفضل أن يكون ذلك في منطقة مخصصة لتحضير العينات خالية من الغبار والملوثات المحتملة الأخرى.
بالنسبة لعينات المسحوق، من الضروري تحضير الكوفيتات والأغشية بعناية. هناك العديد من أنواع الأغشية المتاحة لأغراض التفلور الراديوي السيني XRF، ومن الضروري اختيار النوع الأنسب لمهمة وجهاز معين. يمكن أن يساعد التشاور مع المورد في ضمان أن الرقاقة المختارة مناسبة للعينة ولن تدخل ملوثات.

عواقب التلوث على نتائج الترددات الراديوية السينية
يمكن أن يكون للتلوث عواقب وخيمة على نتائج التفلور الراديوي السيني (XRF)، مما يؤدي إلى بيانات غير دقيقة وغير موثوقة. إذا كانت العينة ملوثة أثناء عملية الطحن، فإن التركيب العنصري الذي يقيسه جهاز التفلور الراديوي الطيفي بالأشعة السينية سيكون غير صحيح. يمكن أن يؤدي ذلك إلى نتائج إيجابية أو سلبية خاطئة، وسوء تفسير البيانات، وفي نهاية المطاف، استنتاجات غير صحيحة.
على سبيل المثال، إذا كانت العينة المراد تحليلها بحثًا عن محتوى الرصاص ملوثة بالكالسيوم من عينة سابقة، فقد تُظهر نتائج التفلور الراديوي الطيفي بالأشعة السينية تركيزًا عاليًا مصطنعًا للرصاص. وقد يؤدي ذلك إلى تشخيص خاطئ للتلوث بالرصاص، مع ما يترتب على ذلك من آثار محتملة على الامتثال التنظيمي والصحة العامة.
علاوةً على ذلك، يمكن أن يؤثر التلوث أيضًا على دقة قياسات التفلور الراديوي الطيفي بالأشعة السينية وقابليتها للتكرار. إذا حدث تلوث أثناء إعداد عينات متعددة، فقد يزداد التباين في النتائج، مما يجعل من الصعب مقارنة البيانات عبر عينات مختلفة. وهذا يمكن أن يقوض موثوقية التحليل ويضر بصحة أي استنتاجات مستخلصة من البيانات.
الخلاصة
يعد التلوث مخربًا صامتًا في تحليل التفلور الراديوي السيني (XRF)، خاصةً أثناء عملية الطحن. يعد فهم مصادر التلوث، وتنفيذ طرق الوقاية الفعالة، والتعرف على عواقب التلوث أمرًا بالغ الأهمية للحفاظ على دقة وموثوقية نتائج التفلور الراديوي الطيفي بالأشعة السينية. من خلال العناية الدقيقة في تحضير العينات، واستخدام المواد المناسبة، والعمل في بيئة نظيفة، يمكن للباحثين تقليل مخاطر التلوث وضمان سلامة تحليل التفلور الراديوي الطيفي بالأشعة السينية.
اختيار المادة الرابطة: مفتاح الكريات المتجانسة
يعد اختيار المادة الرابطة المناسبة جانبًا حاسمًا في تحضير الكريات، حيث إنها تؤثر بشكل مباشر على تجانس الكريات النهائية وثباتها. تعمل المجلدات بمثابة "الغراء" الذي يحافظ على تماسك جزيئات العينة معًا، مما يضمن بقاء الكريات سليمة أثناء التحليل وعدم تلويث المطياف بالمسحوق السائب. والمواد الرابطة الأكثر شيوعًا المستخدمة في تحضير الحبيبات هي خلائط السليلوز/الشمع، والتي تُعرف بقدرتها على التجانس مع العينة وربط الجسيمات معًا بفعالية أثناء عملية الضغط.
دور المواد الرابطة في تحضير الكريات
تلعب المواد الرابطة دورًا حاسمًا في عملية التكوير من خلال تسهيل تكوين كريات متماسكة من عينة المسحوق. فبدون مادة رابطة لن تلتصق جزيئات العينة ببعضها البعض، مما يؤدي إلى تكوين كريات غير متماسكة وغير مستقرة يمكن أن تتفكك بسهولة أو تلوث المطياف. تعمل المادة الرابطة كوسيط يسمح للجسيمات بالالتصاق ببعضها البعض، مما يشكل كريات صلبة وموحدة يمكن تحليلها دون تداخل من الجسيمات السائبة.
الأنواع الشائعة من المواد الرابطة
مخاليط السليلوز/الشمع
خلائط السليلوز/الشمع هي أكثر المواد الرابطة استخدامًا في تحضير الكريات نظرًا لفعاليتها وسهولة استخدامها. تُضاف هذه المواد الرابطة عادةً بنسب تتراوح بين 20-30% إلى العينة، اعتمادًا على المتطلبات المحددة للتحليل. يوفر مكون السليلوز السلامة الهيكلية للكريات بينما يضمن الشمع التصاق الجسيمات ببعضها البعض. يسمح هذا المزيج بتكوين كريات متجانسة قوية ومستقرة على حد سواء.

مواد رابطة أكريليك
في بعض الحالات، يمكن استخدام مواد رابطة الأكريليك كبديل لمخاليط السليلوز/الشمع. ومع ذلك، يمكن أن تكون مجلدات الأكريليك أكثر صعوبة في التجانس مع العينة، وغالبًا ما تتطلب خلطًا يدويًا بدلًا من إضافتها تلقائيًا أثناء الطحن. يمكن أن يؤدي ذلك إلى عدم الاتساق في الكريات النهائية، حيث قد لا تتوزع المادة الرابطة بالتساوي في جميع أنحاء العينة.
الكريات المخلوطة مسبقًا
للراحة، تتوفر بعض المواد الرابطة على شكل كريات مخلوطة مسبقًا يمكن إضافتها تلقائيًا إلى المطحنة أثناء الطحن. تضمن هذه الكريات المخلوطة مسبقًا توزيع المادة الرابطة بالتساوي في جميع أنحاء العينة، مما يؤدي إلى نتائج أكثر اتساقًا وموثوقية. ومع ذلك، يجب النظر بعناية في اختيار الكريات المخلوطة مسبقًا لضمان توافقها مع العينة المحددة التي يتم تحليلها.
اختيار المادة الرابطة الأكثر ملاءمة
يعتمد اختيار المادة الرابطة الأكثر ملاءمة لعينة معينة على عدة عوامل، بما في ذلك نوع العينة، وقوة الحبيبات المطلوبة، والمتطلبات المحددة للتحليل. فيما يلي بعض الاعتبارات الرئيسية التي يجب وضعها في الاعتبار عند اختيار المادة الرابطة:
نوع العينة
قد تتطلب العينات المختلفة أنواعًا مختلفة من المواد الرابطة. على سبيل المثال، قد تستفيد العينات التي يصعب طحنها أو التي تحتوي على مراحل يصعب طحنها من مادة رابطة يمكنها أن تتجانس بشكل أفضل مع العينة وتمسك الجسيمات معًا. في مثل هذه الحالات، قد يكون خليط السليلوز/الشمع أكثر فعالية من مادة رابطة من الأكريليك.
قوة الكريات
تعتبر قوة الحبيبات النهائية من الاعتبارات المهمة الأخرى. فالكريات الأقوى تكون أقل عرضة للتفكك أثناء المناولة أو التحليل، مما يقلل من خطر التلوث ويحسن دقة النتائج. تُفضل خلائط السليولوز/الشمع بشكل عام لقدرتها على تكوين كريات قوية وثابتة.
متطلبات التحليل
قد تؤثر أيضًا المتطلبات المحددة للتحليل، مثل نوع المطياف المستخدم أو حساسية القياس، على اختيار المادة الرابطة. على سبيل المثال، قد تنتج بعض المجلدات كريات أكثر اتساقًا تكون أكثر ملاءمة للتحليل عالي الدقة، في حين أن البعض الآخر قد يكون أكثر فعالية في منع التلوث.
أفضل الممارسات لاختيار المادة الرابطة
لضمان الحصول على أفضل النتائج الممكنة، من المهم اتباع أفضل الممارسات عند اختيار واستخدام المادة الرابطة. فيما يلي بعض النصائح لمساعدتك في الحصول على أقصى استفادة ممكنة من الموثق:
اختبر عدة مجلدات
إذا كان ذلك ممكنًا، اختبر عدة مجلدات مع عينتك لتحديد أي منها ينتج النتائج الأكثر اتساقًا وموثوقية. يمكن أن يساعدك ذلك في تحديد المادة الرابطة المثلى لتطبيقك المحدد.
انتبه إلى النسب
تُعد نسبة المادة الرابطة إلى العينة أمرًا بالغ الأهمية للحصول على كريات متجانسة. يمكن أن تؤدي إضافة الكثير من المادة الرابطة إلى كريات صلبة وهشة للغاية، في حين أن إضافة القليل منها يمكن أن يؤدي إلى كريات ضعيفة وغير مستقرة. وعادةً ما يوصى بنسبة 20-30% من المادة الرابطة إلى العينة، ولكن قد يختلف ذلك اعتمادًا على المادة الرابطة والعينة المحددة.
ضمان التوزيع المتساوي
بغض النظر عن نوع المادة الرابطة المستخدمة، من المهم التأكد من توزيع المادة الرابطة بالتساوي في جميع أنحاء العينة. يمكن تحقيق ذلك عن طريق خلط المادة الرابطة بعناية مع العينة أو باستخدام كريات مخلوطة مسبقًا. يمكن أن يؤدي التوزيع غير المتساوي للمادة الرابطة إلى عدم اتساق في الحبيبات النهائية، مما يؤثر على دقة التحليل.
مراقبة حجم الجسيمات
يمكن أن يؤثر حجم جسيمات العينة أيضًا على فعالية المادة الرابطة. يمكن أن تؤدي أحجام الجسيمات الأكبر حجمًا إلى كريات أقل تجانسًا، حيث قد لا تتمكن المادة الرابطة من الاحتفاظ بجميع الجسيمات معًا بشكل فعال. يمكن أن يساعد طحن العينة إلى حجم جسيمات متناسق في تحسين أداء المادة الرابطة وإنتاج كريات أكثر تجانسًا.
الخلاصة
يعد اختيار المادة الرابطة عاملًا حاسمًا في إعداد كريات متجانسة ومستقرة للتحليل. من خلال اختيار المادة الرابطة الأكثر ملاءمة لعينتك واتباع أفضل الممارسات لاستخدامها، يمكنك ضمان اتساق الكريات وموثوقيتها وخلوها من التلوث. وسواء اخترت خليطًا من السليلوز/الشمع، أو مادة رابطة من الأكريليك، أو كريات مخلوطة مسبقًا، فإن الدراسة الدقيقة للعوامل التي تمت مناقشتها أعلاه ستساعدك على تحقيق أفضل النتائج الممكنة في تحليلك.
سُمك الحبيبات: ضمان عمق كافٍ لأخذ العينات
في تحليل التفلور بالأشعة السينية (XRF)، يعتبر سمك الحبيبات المضغوطة عاملاً حاسماً يؤثر بشكل مباشر على دقة وموثوقية النتائج التحليلية. يجب أن تكون الحبيبات سميكة بما فيه الكفاية لضمان تسرب الأشعة السينية المنتجة في العينة دون إعادة امتصاصها، مما يسمح بقياس دقيق للعناصر الموجودة. يتناول هذا القسم أهمية سُمك الكريات، وكيفية حساب السُمك المطلوب، والأخطاء الشائعة التي يمكن أن تؤدي إلى نتائج غير دقيقة.

أهمية سُمك الكريات
إن الشاغل الأساسي عند إعداد الكريات المضغوطة لتحليل التفلور الراديوي السيني هو التأكد من أن الكريات "سمكها غير محدود" بالنسبة لحزمة الأشعة السينية لجميع العناصر التي يتم قياسها. وهذا يعني أن سمك الكريات يجب أن يتجاوز عمق الهروب لأعلى عنصر طاقة في العينة. إذا كانت الحبيبات رقيقة جدًا، فقد يُعاد امتصاص الأشعة السينية الناتجة في العينة قبل أن تصل إلى الكاشف، مما يؤدي إلى التقليل من تركيز العنصر.
ويعتمد عمق الهروب للعنصر على مستوى طاقته، حيث يكون للعناصر ذات الطاقة الأعلى عادةً أعماق هروب أعمق. على سبيل المثال، العناصر ذات الأعداد الذرية الأعلى (مثل الحديد والنحاس) سيكون لها أعماق هروب أعمق مقارنةً بالعناصر ذات الطاقة الأقل (مثل الصوديوم والمغنيسيوم). ولذلك، يجب أن تكون الحبيبات سميكة بما يكفي لاستيعاب أعمق عمق هروب للعناصر ذات الأهمية.
حساب سماكة الحبيبات المطلوبة
لتحديد سُمك الحبيبات المطلوب، من الضروري مراعاة عمق الهروب لأعلى عنصر طاقة في العينة. يمكن حساب عمق الهروب باستخدام معاملات امتصاص الكتلة للعناصر الموجودة في العينة. معامل امتصاص الكتلة هو مقياس لمدى قدرة المادة على امتصاص الأشعة السينية ويعتمد على العدد الذري للعنصر وطاقة الأشعة السينية.
وللأغراض العملية، فإن الحبيبات المصنوعة من 8-10 جرامات من العينة لحبيبات قطرها 32 مم أو 13-15 جرامًا من العينة لحبيبات قطرها 40 مم كافية عمومًا للعناصر التي يمكن قياسها حتى بواسطة أقوى أجهزة فلورية الأشعة السينية المشتتة الطول الموجي (WDXRF) المتاحة حاليًا. تضمن هذه الأوزان أن تكون الحبيبات سميكة بما فيه الكفاية لمنع إعادة امتصاص الأشعة السينية وتوفير نتائج تحليلية دقيقة.
الأخطاء الشائعة في سماكة الحبيبات
أحد الأخطاء الأكثر شيوعًا في إعداد الكريات المضغوطة هو التقليل من تقدير السماكة المطلوبة. يمكن أن يحدث هذا إذا لم تكن الحبيبات سميكة بما يكفي لاستيعاب أعمق عمق هروب العناصر التي يتم قياسها. ونتيجة لذلك، قد يتم إعادة امتصاص الأشعة السينية الناتجة في العينة، مما يؤدي إلى قياسات غير دقيقة.
ومن الأخطاء الشائعة الأخرى الفشل في حساب متوسط الكتلة الذرية للعينة. تتناسب قدرة العينة على الامتصاص تناسبًا طرديًا مع متوسط كتلتها الذرية، مما يعني أن العناصر الأثقل تمتص أشعة سينية أكثر من العناصر الأخف وزنًا. لذلك، من الضروري مراعاة متوسط التركيب العنصري للعينة عند تحديد سُمك الحبيبات المطلوب.
اعتبارات التلوث
بالإضافة إلى سُمك الكريات، يعد التلوث عاملاً آخر بالغ الأهمية يمكن أن يؤثر على جودة تحليل التفلور الراديوي السيني. يمكن أن يحدث التلوث أثناء عملية طحن العينة وقد ينشأ من جهاز تحضير العينة أو التلوث المتبادل بين العينة والعينة. ولتقليل التلوث إلى الحد الأدنى، من الضروري استخدام معدات نظيفة والتأكد من إجراء عملية تحضير العينة في بيئة خاضعة للرقابة.
أفضل الممارسات لتحضير الحبيبات
لضمان دقة وموثوقية تحليل التفلور الراديوي بالأشعة السينية، من الضروري اتباع أفضل الممارسات لتحضير الحبيبات. ويشمل ذلك استخدام الكمية المناسبة من العينة لتحقيق سمك الحبيبات المطلوب، واختيار المادة الرابطة المناسبة، وتطبيق ضغط ثابت أثناء عملية الكبس. يعد الاهتمام بالتفاصيل والاتساق في عملية التحضير أمرًا أساسيًا لتقليل الأخطاء والحصول على نتائج تحليلية عالية الجودة.
باختصار، تعد سماكة الحبيبات المضغوطة عاملًا حاسمًا في تحليل التفلور الراديوي الطيفي بالأشعة السينية الذي يؤثر بشكل مباشر على دقة وموثوقية النتائج التحليلية. من خلال التأكد من أن الحبيبات سميكة بما يكفي لاستيعاب أعمق عمق هروب العناصر التي يتم قياسها، وباتباع أفضل الممارسات لإعداد الكريات، يمكن للمحللين الحصول على قياسات دقيقة ودقيقة للعناصر الموجودة في العينة.
تطبيق الضغط: تحقيق التوازن بين الضغط والتجانس
يعد تحقيق الضغط الأمثل أثناء كبس الكريات أمرًا بالغ الأهمية لإنشاء كريات عالية الجودة خالية من الفراغات وتظهر خصائص متسقة. وتتضمن العملية تطبيق المقدار المناسب من الضغط لضغط العينة وإعادة بلورة المادة الرابطة لضمان أن يكون المنتج النهائي كثيفًا ومتجانسًا. يتعمق هذا القسم في الجوانب الحرجة لتطبيق الضغط، بما في ذلك تأثيرات الضغط الزائد والضغط الناقص، وتقنيات تحقيق الضغط الأمثل للعينات الخاصة بك.
أهمية تطبيق الضغط المناسب
إن الهدف الأساسي من ضغط الكريات هو التخلص من الفراغات داخل الكريات، والتي يمكن أن تؤثر بشكل كبير على كثافة العناصر الأخف في العينة. يجب أن تكون الحبيبات المضغوطة جيدًا كثيفة بما يكفي لمنع أي فراغات داخلية، مما يضمن توزيعًا موحدًا للعينة والمادة الرابطة. لتحقيق ذلك، من الضروري استخدام ضغط كافٍ لضغط العينة بالكامل وإعادة بلورة المادة الرابطة.
التجريب ونطاق الضغط الأمثل
يتضمن العثور على الضغط الأمثل لعينتك المحددة إجراء التجارب. ابدأ بتطبيق ضغط متزايد على عيناتك ولاحظ كثافة العناصر الأخف وزنًا. تصل معظم العينات إلى أقصى كثافة لها عند ضغط يتراوح بين 25-35 طن متري (T) لمدة 1-2 دقيقة. يعد هذا النطاق نقطة بداية جيدة، ولكن قد تتطلب العينات الفردية تعديلات بناءً على خصائصها المحددة.

تجنب الضغط الزائد والضغط الناقص
يمكن أن يؤدي الإفراط في الضغط إلى العديد من المشاكل، بما في ذلك تجاوز قوة الكسر في الكبسولة، مما يؤدي إلى حدوث تشققات أو "تغطيات" حيث ينفصل الجزء العلوي من الحبيبات عن الباقي. لا تؤدي القوى العالية جدًا بالضرورة إلى إنتاج كريات أفضل ويمكن أن تسبب ضررًا أكثر من نفعها. ومن ناحية أخرى، يمكن أن يؤدي الضغط المنخفض إلى ترك فراغات داخل الكريات، مما يؤدي إلى نتائج غير متناسقة وانخفاض كثافة العناصر الأخف وزنًا.
تقنيات تطبيق الضغط الأمثل
-
تحرير الضغط البطيء: بعد تطبيق الضغط اللازم، حرره ببطء لمنع تشقق سطح الكريات. يمكن أن يتسبب التحرير السريع للضغط في حدوث كسور إجهادية، مما يضر بسلامة الكريات.
-
محاذاة القالب والتحميل: تأكد من محاذاة المكبس والقالب بشكل صحيح لتطبيق ضغط موحد. يمكن أن يؤدي الإفراط في ملء غلاف القالب بالمسحوق إلى ضغط غير متساوٍ ويجب تجنبه. قم بتحميل القالب بما لا يزيد عن 50% من قوة الخضوع للفولاذ لمنع تجاوز قدرته.
-
أبعاد الحبيبات: الحفاظ على نسبة متوازنة بين ارتفاع الكريات وقطرها. الكريات التي تكون أطول بكثير من قطرها يمكن أن تتعرض لضغوط أكبر بالقرب من المكبس العلوي، مما يؤدي إلى التشقق. في حالة الضغط على كريات أطول، ضع في اعتبارك استخدام قوى أقل، وتشحيم القالب، واستخدام حلقة دائرية بين اللوحة الأساسية والكم لتوزيع الضغوط بشكل متساوٍ.
-
التوزيع المتساوي للمسحوق: عند نقل مزيج العينة إلى تجويف القالب، تأكد من توزيعه بالتساوي. يمكن أن يؤدي التوزيع غير المتساوي إلى ضغط غير متساوٍ وفراغات داخل الكريات.
الخطوات العملية لتطبيق الضغط
- إصلاح مكبس الكريات: قم بتثبيت القالب في تجويف المكبس وتأكد من محاذاة القالب بشكل صحيح.
- نقل العينة: استخدم ملعقة معدنية لنشر مزيج العينة المطحونة بالتساوي في تجويف القالب.
- توزيع الجسيمات: أدخل مكبس البراغي وقم بتدويره لتوزيع الجسيمات بالتساوي.
- تأمين مجموعة القالب: نقل مجموعة القالب إلى مكبس الكريات الهيدروليكي وتأمينها بإحكام عن طريق تدوير العجلة.
- تطبيق الضغط: أغلق صمام المكبس الهيدروليكي واسحب المستوى لتطبيق الضغط حتى يصبح المقبض محكمًا.
- تحرير الضغط: لتحرير القالب، قم أولاً بتخفيف الضغط، ثم حرّك العجلة العلوية للمكبس، وأخيرًا أخرج القالب.
من خلال موازنة الضغط والتجانس بعناية، يمكنك تحقيق كريات عالية الجودة تلبي متطلباتك التجريبية. يضمن التطبيق السليم للضغط، إلى جانب الاهتمام بالتفاصيل في كل خطوة من خطوات العملية، أن تكون الكريات الخاصة بك كثيفة وخالية من الفراغات ومتسقة في الخصائص.
نسبة التخفيف: الضبط الدقيق لنتائج دقيقة
تؤدي نسبة التخفيف دورًا حاسمًا في تحليل التألق بالأشعة السينية (XRF)، مما يؤثر على دقة النتائج وموثوقيتها. يعد التحديد الصحيح لنسبة التخفيف المناسبة وتطبيقها أمرًا ضروريًا للتخفيف من المشكلات الشائعة المتعلقة بتحضير العينة وتأثيرات المصفوفة، مما يضمن تمثيل التركيب العنصري للعينة بدقة.

تأثير نسبة التخفيف على تحليل الترددات الراديوية السينية
في تحليل التفلور الراديوي السيني (XRF)، تؤثر نسبة التخفيف تأثيرًا مباشرًا على شدة خطوط الأشعة السينية المنبعثة من العينة. يمكن لنسبة التخفيف المختارة جيدًا أن توازن تأثيرات المصفوفة، مثل الامتصاص والتعزيز، والتي يمكن أن تشوه الشدة المقيسة. ويحدث الامتصاص عندما تمتص العناصر الموجودة في العينة الأشعة السينية المنبعثة من عناصر أخرى، مما يقلل من شدة الأشعة السينية التي تصل إلى الكاشف. ومن ناحية أخرى، يحدث التعزيز عندما يؤدي وجود عناصر عالية الطاقة في العينة إلى إثارة ذرات العنصر الذي يتم تحليله، مما يزيد من شدة خطوط الأشعة السينية.
ومن خلال اختيار نسبة التخفيف بعناية، يمكن تقليل تأثيرات المصفوفة هذه إلى الحد الأدنى، مما يؤدي إلى نتائج أكثر دقة وقابلة للتكرار. تضمن نسبة التخفيف المناسبة ألا تكون العينة شديدة التركيز، مما قد يؤدي إلى امتصاص زائد، ولا مخففة أكثر من اللازم، مما قد يؤدي إلى ضعف شدة الإشارة التي يصعب قياسها بدقة.
تحديد نسبة التخفيف المناسبة
يتضمن تحديد نسبة التخفيف المناسبة مزيجًا من الاعتبارات النظرية والتجارب العملية. الهدف هو تحقيق خليط متجانس حيث يتم توزيع العينة بالتساوي في جميع أنحاء مادة المصفوفة. فيما يلي بعض الخطوات الرئيسية التي يجب اتباعها:
-
فهم تركيبة العينة: ابدأ بالفهم الدقيق للتركيب العنصري لعينتك. يتضمن ذلك معرفة تركيزات العناصر الرئيسية والثانوية والعناصر النزرة الموجودة. هذه المعلومات ضرورية للتنبؤ بتأثيرات المصفوفة المحتملة.
-
تحديد مادة مصفوفة مناسبة: يجب أن تكون مادة المصفوفة خاملة كيميائيًا وذات تركيبة تقلل من تأثيرات الامتصاص والتعزيز. تشمل الاختيارات الشائعة رباعي بورات الليثيوم (LiBO₂) وحمض البوريك (H₃BO₃)، والمعروفان بقدرتهما على تكوين مخاليط مستقرة ومتجانسة مع مجموعة واسعة من أنواع العينات.
-
إجراء التخفيفات الأولية: ابدأ بمجموعة من نسب التخفيف وقياس الشدة الناتجة. استخدم هذه القياسات لتقييم تأثير النسب المختلفة على شدة خطوط الأشعة السينية. ابحث عن نسبة تكون فيها الشدة مستقرة وتقل فيها تأثيرات المصفوفة إلى الحد الأدنى.
-
تحسين التجانس: التأكد من أن العينة مطحونة بدقة إلى حجم حبيبات أقل من 75 ميكرومتر. هذا أمر ضروري لتحقيق خليط متجانس، وهو أمر بالغ الأهمية لإجراء تحليل دقيق بالترددات الراديوية السينية. كلما كانت الحبيبات أدق، كلما كان الخليط أفضل، مما يقلل من احتمالية وجود فراغات وأسطح غير متساوية في الحبيبات النهائية.
-
تقييم الاستقرار وقابلية الاستنساخ: بمجرد تحديد نسبة التخفيف المناسبة، قم بإجراء قياسات متعددة لضمان الثبات والتكرار. يمكن أن تشير التباينات في النتائج إلى وجود مشكلات في عملية تحضير العينة، مثل الخلط غير الكامل أو الاختلافات في حجم الحبيبات.
المشكلات الشائعة المتعلقة بالتخفيف غير السليم
يمكن أن يؤدي التخفيف غير الصحيح إلى العديد من المشكلات الشائعة في تحليل التفلور الراديوي الطيفي XRF:
-
الامتصاص المفرط: يمكن أن يؤدي الإفراط في تركيز العينات إلى امتصاص مفرط، حيث يتم امتصاص الأشعة السينية المنبعثة من العينة بشكل كبير بواسطة عناصر أخرى في العينة. يمكن أن يؤدي ذلك إلى التقليل من تركيزات بعض العناصر.
-
كثافة الإشارة الضعيفة: وعلى العكس من ذلك، يمكن أن تؤدي العينات قليلة التركيز إلى ضعف كثافة الإشارة، مما يجعل من الصعب الحصول على قياسات دقيقة. وهذا الأمر يمثل مشكلة خاصة بالنسبة للعناصر النزرة، والتي قد لا تنتج إشارة قوية بما يكفي لاكتشافها بشكل موثوق.
-
تأثيرات المصفوفة: يمكن أن يؤدي التخفيف غير السليم إلى تفاقم تأثيرات المصفوفة، مثل الامتصاص والتعزيز. يمكن لهذه التأثيرات أن تشوه الشدة المقاسة، مما يؤدي إلى نتائج غير دقيقة.
-
المخاليط غير المتجانسة: إذا لم تكن العينة مطحونة بدقة أو إذا لم يتم تحسين نسبة التخفيف، فقد يكون الخليط الناتج غير متجانس. يمكن أن يؤدي ذلك إلى اختلافات في الشدة المقيسة، حتى داخل العينة نفسها، مما يقلل من موثوقية النتائج.
الخلاصة
يُعد الضبط الدقيق لنسبة التخفيف خطوة حاسمة في تحقيق نتائج تحليل دقيق وموثوق به للتفلور الراديوي الطيفي بالأشعة السينية. من خلال اختيار نسبة التخفيف المناسبة بعناية وضمان وجود خليط متجانس، يمكنك تقليل تأثيرات المصفوفة وغيرها من المشكلات الشائعة المتعلقة بتحضير العينة. لا يحسن هذا النهج دقة قياساتك فحسب، بل يعزز أيضًا إمكانية تكرار نتائجك، مما يسهل مقارنة البيانات عبر العينات والتجارب المختلفة.
التلوث المتبادل بين العينات: منع التداخل
يعد التلوث التبادلي بين العينات مشكلة حرجة في المختبرات التحليلية، مما قد يؤدي إلى نتائج غير دقيقة وضعف سلامة البيانات. يتعمق هذا القسم في طرق تقليل التلوث التبادلي، وأهمية بروتوكولات التنظيف، وأفضل الممارسات لضمان نقاء العينة.
فهم التلوث التبادلي
يحدث التلوث التبادلي عندما تتداخل بقايا إحدى العينات مع تحليل عينة أخرى، مما يؤدي إلى نتائج مشوهة. يمثل هذا الأمر مشكلة خاصة في البيئات التي يتم فيها تحليل مجموعة كبيرة من أنواع العينات، حيث يزداد خطر التلوث مع تنوع العينات. على سبيل المثال، إذا لم يتم تنظيف جهاز تحضير العينات مثل جهاز الطحن بشكل كامل بين الاستخدامات، فقد يؤدي ذلك إلى إدخال عناصر من عينة إلى العينة التالية، مما يؤدي إلى تشويه التحليل.

طرق تقليل التلوث المتبادل
-
استخدام معدات مخصصة: تتمثل إحدى الطرق الفعالة لتقليل التلوث المتبادل في استخدام معدات مخصصة لأنواع محددة من العينات. وهذا يضمن عدم تداخل المخلفات من نوع واحد من العينات مع نوع آخر. على سبيل المثال، يمكن لجهاز السحق المخصص للعينات المعدنية أن يمنع دخول العناصر المعدنية في العينات غير المعدنية.
-
بروتوكولات التنظيف الشامل: من الضروري تنفيذ بروتوكولات تنظيف صارمة. بعد كل استخدام، يجب تنظيف المعدات وفقًا لإجراء موحد. ويشمل ذلك استخدام مذيبات أو مواد تنظيف مناسبة وضمان إزالة جميع المخلفات. على سبيل المثال، يجب تنظيف أوعية الطحن الفولاذية بمذيبات يمكنها إذابة بقايا الحديد والنيكل والكروم.
-
تقنيات تحضير العينات: يمكن أن تؤثر التقنية المستخدمة في تحضير العينات أيضًا على خطر التلوث المتبادل. على سبيل المثال، عند إعداد معايير المعايرة لتحليل الترددات الراديوية السينية، من الضروري مطابقة مصفوفة معايير المعايرة مع مصفوفة العينات. يساعد ذلك في تحسين الدقة وتقليل مخاطر التلوث. بالإضافة إلى ذلك، يمكن أن يوفر استخدام فراغات معايرة عالية الجودة مع شهادة تحليل الثقة في سلامة عملية المعايرة.
-
استخدام حوامل العينات: بالنسبة للعينات الأصغر حجمًا والأقل سمكًا، يمكن أن يؤدي استخدام حامل العينات إلى منع التداخل من الأجسام الموجودة خلف العينة. ويضمن ذلك إجراء تحليل أكثر دقة من خلال الحفاظ على مسافة ثابتة بين العينة ونافذة الكشف في مقياس الطيف.
-
القياسات السطحية المتعددة: عند اختبار عينات معدنية كبيرة، يُنصح بقياس عدة أسطح عدة مرات للحصول على نتائج أكثر دقة. يقلل هذا من احتمالية انحراف البيانات بسبب التلوث الموضعي على سطح واحد.
أهمية بروتوكولات التنظيف
بروتوكولات التنظيف هي العمود الفقري لمنع التلوث المتبادل. فهي تضمن خلو المعدات من المخلفات التي يمكن أن تتداخل مع التحليلات اللاحقة. تُعد الصيانة الدورية والالتزام بإجراءات التشغيل القياسية (SOPs) لبدء التشغيل وإيقاف التشغيل أمرًا بالغ الأهمية. على سبيل المثال، يمكن أن تؤدي الفحوصات المتكررة للأجهزة للتأكد من أنها تعمل كما هو متوقع إلى منع حدوث مشكلات قد تؤدي إلى التلوث.
أفضل الممارسات لتحضير العينة
تشمل الأهداف الأساسية لتحضير العينات ضمان تجانس العينة وإدارة التداخلات المحتملة من الشكل الأصلي للعينة. تعتبر التقنيات التي توفر مزايا من حيث السرعة وعدد العينات التي يمكن تحضيرها في وقت واحد ذات قيمة خاصة في المختبرات عالية الإنتاجية. ومع ذلك، من الضروري الموازنة بين السرعة والحاجة إلى الدقة والنزاهة.
الخاتمة
يعد منع التلوث المتبادل بين العينات أمرًا حيويًا للحفاظ على دقة وموثوقية النتائج التحليلية. من خلال تنفيذ معدات مخصصة وبروتوكولات تنظيف صارمة وأفضل الممارسات في إعداد العينات، يمكن للمختبرات أن تقلل بشكل كبير من مخاطر التلوث. لا يضمن ذلك سلامة التحليلات الفردية فحسب، بل يساهم أيضًا في المصداقية العامة لبيانات المختبر.
أفضل الممارسات للحد من الأخطاء في إعداد حبيبات التفلور الراديوي بالأشعة السينية
عندما يتعلق الأمر بتحليل التفلور بالأشعة السينية (XRF)، تعتمد جودة النتائج بشكل كبير على إعداد العينات. تُعد عملية إنشاء كريات مضغوطة لتحليل التفلور بالأشعة السينية خطوة حاسمة يمكن أن تؤثر بشكل كبير على دقة البيانات وموثوقيتها. ولتقليل الأخطاء وضمان اتساق النتائج، من الضروري اتباع أفضل الممارسات في إعداد كريات التفلور الراديوي الطيفي بالأشعة السينية. يحدد هذا القسم الاستراتيجيات الرئيسية لتطوير الطريقة والاهتمام بالتفاصيل والاتساق لتقليل الأخطاء في إعداد عينة التفلور الراديوي الطيفي بالأشعة السينية.
تطوير الطريقة
تتمثل الخطوة الأولى في تقليل الأخطاء في إعداد كريات التفلور الراديوي الطيفي بالأشعة السينية في تطوير طريقة قوية. ويتضمن ذلك فهم المتطلبات المحددة للعينة التي يتم تحليلها وتكييف عملية التحضير وفقًا لذلك. إن نطاق أنواع العينات المستخدمة في تحليل التفلور الراديوي الطيفي بالأشعة السينية واسع، وقد يكون لكل عينة خصائص فريدة تستلزم إجراء تعديلات في طريقة التحضير. على سبيل المثال، يعد حجم جسيمات العينة واختيار المادة الرابطة ونسبة التخفيف من العوامل الحاسمة التي يجب مراعاتها بعناية.
-
حجم الجسيمات: يمكن أن يؤثر حجم جسيمات العينة بشكل كبير على تجانس الحبيبات وبالتالي على دقة تحليل التفلور الراديوي الطيفي بالأشعة السينية. يوصى عمومًا باستخدام حجم جسيمات أقل من 100 ميكرومتر لضمان توزيع موحد للعينة داخل الحبيبات. يمكن أن تؤدي الجسيمات الأكبر حجمًا إلى عدم التجانس، مما يؤدي إلى قراءات غير متسقة.
-
اختيار المادة الرابطة: تلعب المادة الرابطة المستخدمة في عملية تحضير الكريات دورًا حاسمًا في ضمان سلامة الكريات وثباتها. تشمل المواد الرابطة الشائعة زجاج البورات والسليلوز والشمع. يجب أن يستند اختيار المادة الرابطة على التوافق مع العينة والمتطلبات المحددة لتحليل التفلور الراديوي الطيفي بالأشعة السينية. على سبيل المثال، قد تُدخل بعض المجلدات عناصر يمكن أن تتداخل مع التحليل، لذلك من الضروري اختيار مادة رابطة تقلل من هذه التداخلات.
-
نسبة التخفيف: تشير نسبة التخفيف إلى نسبة العينة إلى المادة الرابطة. تضمن نسبة التخفيف المناسبة توزيع العينة بالتساوي داخل الكريات، مما يقلل من خطر التمثيل الزائد أو الناقص لعناصر معينة. تعتمد نسبة التخفيف المثلى على تركيبة العينة والمتطلبات التحليلية. غالبًا ما يكون من الضروري إجراء سلسلة من الاختبارات لتحديد أفضل نسبة تخفيف لعينة معينة.
الاهتمام بالتفاصيل
يعد الاهتمام بالتفاصيل أمرًا بالغ الأهمية في إعداد كريات التفلور الراديوي الطيفي XRF لتقليل الأخطاء. يمكن أن تؤدي الانحرافات الصغيرة في عملية التحضير إلى اختلافات كبيرة في نتائج التحليل. لذلك، من الضروري الحفاظ على الاتساق في كل خطوة من خطوات عملية التحضير.
-
تطبيق الضغط: يُعد مقدار الضغط المطبق أثناء عملية ضغط الكريات عاملًا حاسمًا يؤثر على كثافة الكريات وتجانسها. يمكن أن يؤدي الضغط غير الكافي إلى كريات رخوة، في حين أن الضغط المفرط يمكن أن يتسبب في ضغط العينة بشكل غير متساوٍ. يجب تحديد الضغط الأمثل استنادًا إلى خصائص العينة والمتطلبات المحددة لتحليل التفلور الراديوي الطيفي بالأشعة السينية. الاتساق في الضغط المطبق ضروري لضمان نتائج قابلة للتكرار.
-
سُمك الحبيبات: يمكن أن تؤثر سماكة الحبيبات النهائية على حساسية ودقة تحليل التفلور الراديوي الطيفي بالأشعة السينية. قد لا توفر الحبيبات الرقيقة للغاية إشارة كافية، في حين أن الحبيبات السميكة للغاية يمكن أن تؤدي إلى تأثيرات امتصاص تشوه النتائج. يتراوح السُمك المثالي عادةً بين 1 و3 ملليمتر، اعتمادًا على تركيبة العينة والمتطلبات التحليلية.
-
التلوث المتبادل بين العينة والعينة: يعد التلوث التبادلي بين العينات مصدرًا شائعًا للخطأ في تحليل الترددات الراديوية السينية. ولتقليل هذا الخطر إلى الحد الأدنى، من الضروري تنظيف جميع المعدات والأسطح تمامًا بين عمليات تحضير العينات. وهذا يشمل مكبس الحبيبات وحاويات العينات وأي أدوات أخرى مستخدمة في العملية. بالإضافة إلى ذلك، فإن استخدام أدوات مخصصة لكل عينة يمكن أن يقلل من خطر التلوث التبادلي.
الاتساق
الاتساق في عملية التحضير هو المفتاح لتقليل الأخطاء في تحليل التفلور الراديوي الطيفي. ويتضمن ذلك وضع إجراءات تشغيل قياسية (SOPs) وإجراء فحوصات منتظمة لمراقبة الجودة (QC) وضمان الجودة (QA).
-
إجراءات التشغيل القياسية (SOPs): يضمن وضع إجراءات التشغيل الموحدة (SOPs) والالتزام بها تنفيذ كل خطوة من خطوات عملية التحضير بشكل متسق. يجب أن تتضمن إجراءات التشغيل الموحدة تعليمات مفصلة لتحضير العينة، بما في ذلك حجم الجسيمات، واختيار المادة الرابطة ونسبة التخفيف، وتطبيق الضغط، وسُمك الحبيبات. يمكن أن يساعد التدريب والتوثيق المنتظم لعملية التحضير على ضمان اتباع جميع الموظفين لإجراءات التشغيل الموحدة باستمرار.
-
مراقبة الجودة (QC) وضمان الجودة (QA): تعد إجراءات مراقبة الجودة وضمان الجودة ضرورية لمراقبة دقة وموثوقية تحليل الترددات الراديوية السينية. ويشمل ذلك استخدام المواد المرجعية المعتمدة (CRMs) والفراغات والنسخ المكررة والمكررات للتحقق من دقة النتائج. يمكن أن تساعد فحوصات مراقبة الجودة المنتظمة في تحديد أي انحرافات عن النتائج المتوقعة والسماح بإجراء تعديلات في الوقت المناسب على عملية التحضير.
-
مطابقة المصفوفة: تتضمن مطابقة المصفوفة إعداد عينات ذات تركيبة مماثلة للعينات المجهولة لتقليل تأثيرات المصفوفة. يمكن أن يساعد ذلك في تقليل الأخطاء الناجمة عن الاختلافات في تركيبة العينة، مثل تأثيرات الامتصاص أو التحسين. وتكتسب مطابقة المصفوفة أهمية خاصة عند تحليل العينات المعقدة ذات التركيبات المختلفة.
الخاتمة
في الختام، يتطلب تقليل الأخطاء في إعداد كريات التفلور الراديوي بالأشعة السينية مزيجًا من تطوير الطريقة والاهتمام بالتفاصيل والاتساق. من خلال النظر بعناية في عوامل مثل حجم الجسيمات، واختيار المادة الرابطة ونسبة التخفيف، وتطبيق الضغط، وسمك الكريات، ومن خلال وضع إجراءات التشغيل الموحدة وإجراء فحوصات منتظمة لمراقبة الجودة وضمان الجودة، يمكن تقليل الأخطاء إلى أدنى حد وضمان نتائج تحليل دقيق وموثوق به للتفلور الراديوي الطيفي بالأشعة السينية. ويكمن مفتاح نجاح تحليل التفلور الراديوي بالأشعة السينية في الإعداد الدقيق للعينات، حيث يمكن أن تؤدي حتى الانحرافات الصغيرة إلى اختلافات كبيرة في النتائج النهائية.
الخلاصة: تحقيق الدقة في تحليل التفلور الراديوي الطيفي بالأشعة السينية
يُعد إتقان إعداد عينات PELLET PRESS XRF SAMPLE PREPARATION أمرًا بالغ الأهمية للحصول على نتائج دقيقة. من خلال معالجة المشكلات الشائعة مثل حجم الجسيمات، والتلوث، واختيار المادة الرابطة وسُمك الحبيبات وتطبيق الضغط ونسبة التخفيف والتلوث التبادلي، يمكنك تعزيز دقة تحليل التفلور الراديوي الطيفي XRF بشكل كبير. إن الالتزام بأفضل الممارسات والحفاظ على الاهتمام الدقيق بالتفاصيل يضمن تحسين كل جانب من جوانب إعداد الكريات، مما يؤدي في النهاية إلى نتائج تحليلية موثوقة ومتسقة. إن استثمار الوقت في إتقان تقنيات التحضير الخاصة بك سيؤتي ثماره في شكل بيانات أكثر دقة وفهم أعمق لعيناتك.
اتصل بنا للحصول على استشارة مجانية
تم الاعتراف بمنتجات وخدمات KINTEK LAB SOLUTION من قبل العملاء في جميع أنحاء العالم. سيسعد موظفونا بمساعدتك في أي استفسار قد يكون لديك. اتصل بنا للحصول على استشارة مجانية وتحدث إلى أحد المتخصصين في المنتج للعثور على الحل الأنسب لاحتياجات التطبيق الخاص بك!