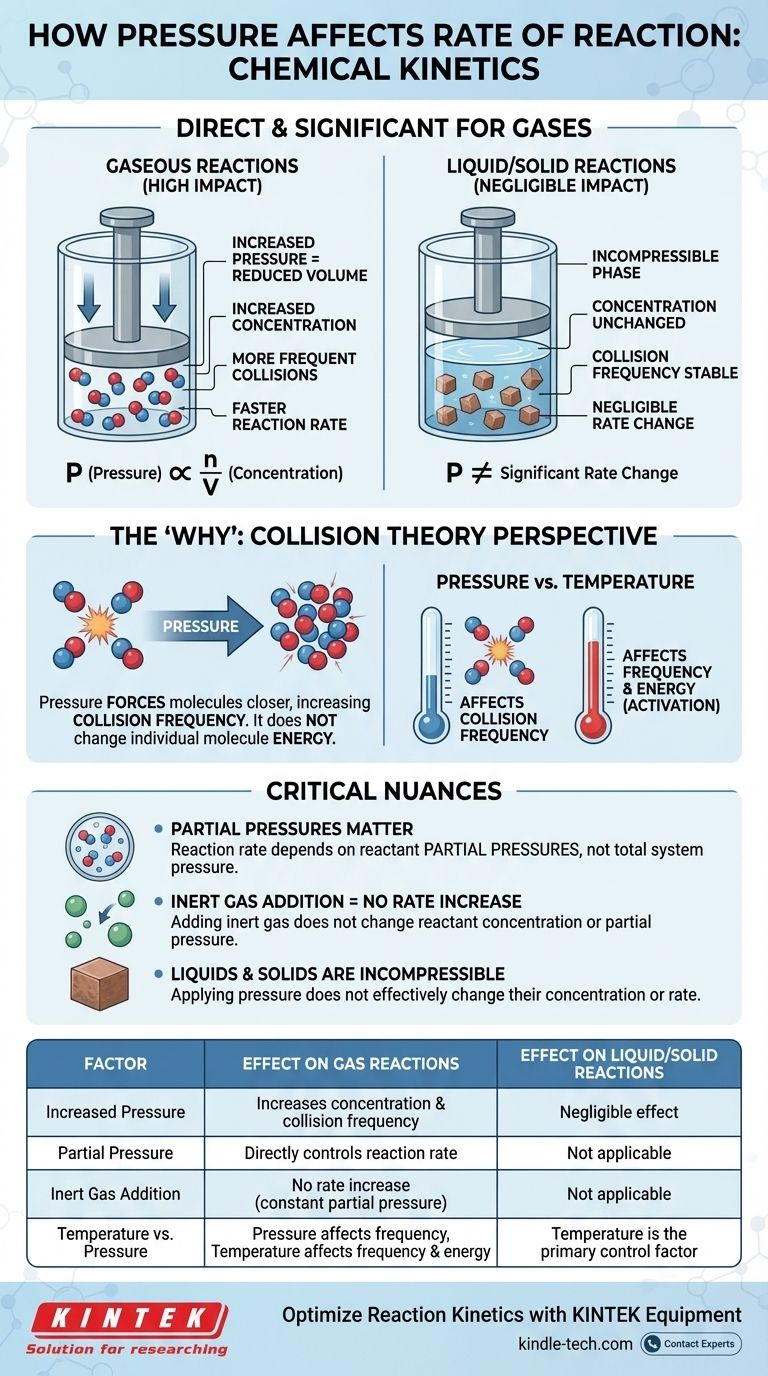
في الحركية الكيميائية، يكون تأثير الضغط على معدل التفاعل مباشرًا ومهمًا، ولكن فقط للتفاعلات التي تشمل الغازات. بالنسبة لتفاعل غازي، يؤدي زيادة الضغط إلى زيادة تركيز الجزيئات المتفاعلة. وهذا يؤدي إلى اصطدامات أكثر تكرارًا بينها، مما يزيد بدوره من المعدل الكلي للتفاعل. أما بالنسبة للتفاعلات التي تحدث بشكل خالص في الأطوار السائلة أو الصلبة، فإن للضغط تأثيرًا ضئيلًا على المعدل.
العلاقة بين الضغط ومعدل التفاعل هي في الأساس قصة عن التركيز. بالنسبة للغازات، فإن زيادة الضغط هي ببساطة وسيلة فيزيائية لدفع المزيد من الجزيئات إلى نفس الحجم، مما يزيد من تكرار الاصطدامات الفعالة وبالتالي تسريع التفاعل.

الرابط الأساسي: الضغط كبديل للتركيز
السبب الجوهري الذي يجعل الضغط يؤثر على التفاعلات الغازية يكمن في علاقته المباشرة بالتركيز. يمكن تفسير هذا المبدأ بشكل أفضل من خلال النظر إلى القوانين الأساسية للكيمياء.
دور قانون الغاز المثالي
يوفر قانون الغاز المثالي، PV = nRT، الرابط الرياضي. إذا أعدنا ترتيبه لحل الضغط (P = (n/V)RT)، يمكننا أن نرى أن الضغط (P) يتناسب طرديًا مع n/V.
يمثل المصطلح n/V عدد المولات (n) لكل وحدة حجم (V)، وهو التعريف الدقيق للتركيز المولي. لذلك، كلما زدت ضغط نظام عند درجة حرارة ثابتة، فإنك تزيد مباشرة من تركيز جزيئات الغاز بداخله.
كيف يتحكم التركيز في معدل التفاعل
تُعرّف سرعة التفاعل بقانون معدله، والذي غالبًا ما يُعبر عنه بالصيغة rate = k[A]^m[B]^n. في هذه المعادلة، يمثل [A] و [B] تراكيز المواد المتفاعلة.
يوضح قانون المعدل أن معدل التفاعل يعتمد بشكل مباشر على تركيز المواد المتفاعلة. ويعني التركيز الأعلى معدلًا أسرع. من خلال ربط هذا بقانون الغاز، تصبح سلسلة الأحداث واضحة: زيادة الضغط تزيد من التركيز، وهذا بدوره يزيد من معدل التفاعل.
"لماذا" وراء التغيير: منظور نظرية الاصطدام
تخبرنا قوانين المعدل ماذا يحدث، لكن نظرية الاصطدام تفسر لماذا يحدث على المستوى الجزيئي. لكي يحدث التفاعل، يجب أن تتصادم جسيمات المواد المتفاعلة بطاقة كافية واتجاه صحيح.
مبدأ تكرار الاصطدام
التفاعل الكيميائي هو نتيجة لعدد لا يحصى من الاصطدامات الجزيئية. وكلما زاد عدد الاصطدامات في الثانية، زادت الفرص لحدوث تفاعل ناجح.
كيف يعزز الضغط الاصطدامات
تؤدي زيادة الضغط على الغاز إلى تقليل الحجم الذي يشغله، مما يجبر الجزيئات على الاقتراب من بعضها البعض. وهذا يزيد بشكل كبير من تكرار اصطدامها - عدد المرات التي تصطدم فيها ببعضها البعض لكل وحدة زمنية.
بينما لا يغير الضغط طاقة الجزيئات الفردية (هذا هو دور درجة الحرارة)، فإنه يضاعف عدد أحداث الاصطدام الكلية. تؤدي هذه الزيادة في التكرار إلى زيادة متناسبة في الاصطدامات الناجحة المسببة للتفاعل.
فهم الفروق الدقيقة والمقايضات
بينما تنطبق القاعدة العامة، يجب على الخبير فهم الظروف المحددة التي تنطبق عليها، والأهم من ذلك، متى لا تنطبق.
الدور الحاسم للضغوط الجزئية
في خليط من الغازات، يعتمد المعدل الكلي للتفاعل على الضغوط الجزئية للمواد المتفاعلة المحددة، وليس على الضغط الكلي للنظام. الضغط الجزئي هو الضغط الذي سيحدثه غاز واحد إذا شغل وحده الحجم الكلي.
هذا يعني أنه يمكنك زيادة الضغط الكلي عن طريق إضافة غاز خامل (مثل الأرجون أو النيتروجين) إلى وعاء التفاعل. ومع ذلك، بما أن هذا لا يغير تركيز أو الضغط الجزئي للمواد المتفاعلة الفعلية، فإنه لن يزيد من معدل التفاعل.
التأثير الضئيل على السوائل والمواد الصلبة
للضغط تأثير ضئيل على معدلات التفاعل في الأطوار المكثفة (السوائل والمواد الصلبة). تعتبر هذه الحالات من المادة بالفعل غير قابلة للانضغاط.
الجزيئات في السوائل والمواد الصلبة معبأة بالفعل بإحكام. لا يؤدي تطبيق الضغط الخارجي إلى تقليل المسافة بينها بشكل كبير أو تغيير تركيزها. لذلك، ليس وسيلة فعالة لتغيير معدلات تفاعلاتها.
الضغط مقابل درجة الحرارة
من الأهمية بمكان التمييز بين تأثيرات الضغط ودرجة الحرارة.
- يؤثر الضغط بشكل أساسي على تكرار الاصطدامات.
- تؤثر درجة الحرارة على كل من تكرار الاصطدامات (تتحرك الجزيئات بشكل أسرع)، والأهم من ذلك، طاقة كل اصطدام.
تؤدي زيادة درجة الحرارة إلى زيادة نسبة الجزيئات التي تمتلك الحد الأدنى من طاقة التنشيط المطلوبة، مما يجعلها عاملًا أقوى بكثير لزيادة معدلات التفاعل من الضغط.
اتخاذ الخيار الصحيح لنظامك
يسمح لك فهم هذا المبدأ بالتحكم في نتائج التفاعل بناءً على أهدافك المحددة. ضع في اعتبارك ما يلي عند تصميم أو تحسين عملية كيميائية.
- إذا كان تركيزك الأساسي هو زيادة سرعة التفاعل الغازي إلى أقصى حد: فإن زيادة ضغط النظام عن طريق تقليل حجمه هي طريقة مباشرة وفعالة لزيادة الإنتاجية.
- إذا كان تركيزك الأساسي هو التحكم في تفاعل في خليط غازي: يجب عليك إدارة الضغوط الجزئية للمواد المتفاعلة، حيث أن مجرد إضافة غاز خامل لرفع الضغط الكلي لن يسرع تفاعلك المستهدف.
- إذا كان تركيزك الأساسي هو تغيير معدل تفاعل في سائل أو صلب: فإن التلاعب بالضغط ليس استراتيجية قابلة للتطبيق؛ يجب عليك التركيز على تغيير درجة الحرارة، أو تركيز الأنواع المذابة، أو استخدام محفز.
من خلال فهم أن الضغط هو بديل للتركيز في الغازات، فإنك تكتسب تحكمًا دقيقًا في حركية نظامك.
جدول الملخص:
| العامل | التأثير على تفاعلات الغاز | التأثير على تفاعلات السائل/الصلب |
|---|---|---|
| زيادة الضغط | يزيد التركيز وتكرار الاصطدام | تأثير ضئيل (غير قابل للانضغاط) |
| الضغط الجزئي | يتحكم مباشرة في معدل التفاعل | غير قابل للتطبيق |
| إضافة غاز خامل | لا زيادة في المعدل (ضغط جزئي ثابت) | غير قابل للتطبيق |
| درجة الحرارة مقابل الضغط | يؤثر الضغط على التكرار؛ تؤثر درجة الحرارة على التكرار والطاقة | درجة الحرارة هي عامل التحكم الأساسي |
هل تحتاج إلى التحكم بدقة في تفاعلاتك الكيميائية؟ تتخصص KINTEK في معدات المختبرات عالية الجودة، بما في ذلك مفاعلات الضغط وأنظمة مناولة الغاز، لمساعدتك على تحسين حركية التفاعل وتحقيق نتائج متفوقة في مختبرك. اتصل بخبرائنا اليوم لمناقشة تطبيقك المحدد واكتشاف الحل المناسب لاحتياجاتك.
دليل مرئي
المنتجات ذات الصلة
- مفاعلات الضغط العالي القابلة للتخصيص للتطبيقات العلمية والصناعية المتقدمة
- مفاعل مفاعل عالي الضغط صغير من الفولاذ المقاوم للصدأ للاستخدام المخبري
- مفاعل مفاعل ضغط عالي من الفولاذ المقاوم للصدأ للمختبر
- مفاعل الأوتوكلاف عالي الضغط للمختبرات للتخليق المائي الحراري
- آلة ضغط العزل البارد الكهربائية المنفصلة للمختبر للضغط العازل البارد
يسأل الناس أيضًا
- كيف تعمل المفاعلات المزودة بخلاطات على تحسين تنقية الجلسرين؟ زيادة انتقال الكتلة إلى أقصى حد باستخدام أنظمة استخلاص المذيبات من KINTEK
- ما هي وظيفة المفاعل الحراري المائي عالي الضغط في تحويل المرجان؟ قم بتحسين تخليق هيدروكسياباتيت اليوم
- ما هي وظائف المفاعل الزجاجي ذو الغلاف في تكرير خبث التيتانيا؟ تحقيق تحكم دقيق في درجة الحرارة
- ما هي المزايا التقنية لاستخدام مفاعل HTC للكتلة الحيوية؟ تحسين معالجة الكتلة الحيوية الرطبة
- ما هو الدور الذي تلعبه قشرة الفولاذ المقاوم للصدأ في مفاعل CSTR الصغير؟ تعزيز الاستقرار والتحكم في الحرارة في تصميم المفاعل
- ما هو الدور الذي تلعبه أنظمة التحريك والتغذية في الترسيب المشترك للمحفزات؟ إتقان الدقة للحصول على محفزات فائقة
- ما هو الدور الذي تلعبه الأكمام الخارجية المصنوعة من الفولاذ المقاوم للصدأ في إنتاج مرحلة ماغنيلي؟ مفتاح التخليق عالي الضغط
- ما هي وظيفة المفاعل عالي الدقة المتحكم في درجة حرارته في تخليق مونومرات البنزوكسازين الحيوية؟



















