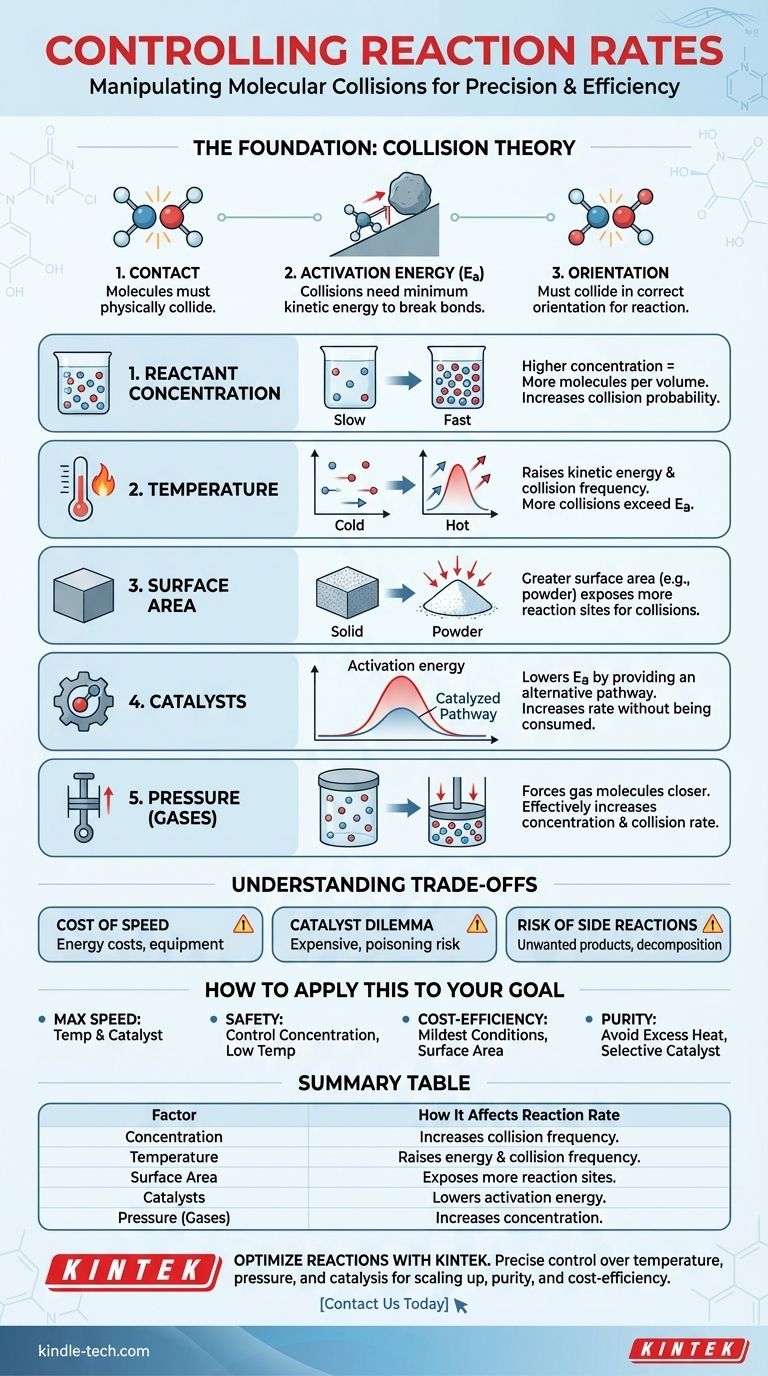
في الأساس، تتحكم خمسة عوامل رئيسية في معدل التفاعل الكيميائي: تركيز المواد المتفاعلة، ودرجة الحرارة، والحالة الفيزيائية ومساحة السطح للمواد المتفاعلة، ووجود محفز، وبالنسبة للغازات، الضغط. يؤثر كل من هذه العوامل على تكرار وطاقة التصادمات الجزيئية، وهو المحرك الأساسي لكل تغيير كيميائي.
يتم تحديد سرعة أي تفاعل كيميائي من خلال عدد مرات تصادم جزيئات المواد المتفاعلة مع التوجيه الصحيح وبطاقة كافية للتغلب على حاجز طاقة التنشيط للتفاعل. كل ما يتحكم في معدلات التفاعل هو ببساطة رافعة للتلاعب بتكرار وفعالية هذه التصادمات.

الأساس: نظرية التصادم
للتحكم في التفاعل، يجب أن تفهم أولاً أن التفاعلات ليست أحداثًا فورية. إنها نتيجة للتفاعلات الفيزيائية بين الجزيئات. ويتم تفسير ذلك من خلال نظرية التصادم.
الحاجة إلى الاتصال
لكي يحدث التفاعل، يجب أن تتصادم جزيئات المواد المتفاعلة مع بعضها البعض فعليًا. إذا كانت في حاويات منفصلة، فلا يمكن أن يحدث تفاعل. يرتبط معدل التفاعل ارتباطًا مباشرًا بمعدل هذه التصادمات.
متطلبات الطاقة (طاقة التنشيط)
التصادم وحده لا يكفي. يجب أن تمتلك الجزيئات المتصادمة كمية دنيا معينة من الطاقة الحركية، تُعرف باسم طاقة التنشيط (Ea). هذه الطاقة مطلوبة لكسر الروابط الكيميائية الموجودة حتى تتشكل روابط جديدة.
فكر في طاقة التنشيط على أنها تل يجب أن تدفع صخرة فوقه. مجرد دفعة خفيفة (تصادم منخفض الطاقة) لن تفعل شيئًا. تحتاج إلى توفير قدر كافٍ من الدفع (طاقة كافية) لوصوله إلى قمة التل، وبعد ذلك يمكنه التدحرج إلى الجانب الآخر وإطلاق الطاقة.
عامل التوجيه
أخيرًا، يجب أن تتصادم الجزيئات في اتجاه محدد يسمح للروابط الصحيحة بالانكسار وتشكيل روابط جديدة. التصادم العشوائي بزاوية خاطئة، حتى لو كان ذا طاقة كافية، لن يؤدي إلى تفاعل.
الرافعات الخمس للتحكم في معدل التفاعل
يمنحك فهم نظرية التصادم خمس رافعات متميزة لسحبها لتسريع التفاعل أو إبطائه. يعمل كل منها عن طريق التأثير على تكرار التصادم، أو طاقة التصادم، أو حاجز طاقة التنشيط نفسه.
1. تركيز المواد المتفاعلة
زيادة تركيز المواد المتفاعلة تعني وجود المزيد من الجزيئات المعبأة في حجم معين. وهذا يزيد بشكل مباشر من احتمالية تصادمها، وبالتالي يزيد من معدل التفاعل.
2. درجة الحرارة
لرفع درجة الحرارة تأثير قوي ومزدوج. أولاً، تزيد من الطاقة الحركية للجزيئات، مما يجعلها تتحرك بشكل أسرع وتتصادم بشكل متكرر. ثانيًا، والأهم من ذلك، أنها تزيد من طاقة هذه التصادمات، مما يعني أن نسبة أعلى منها ستمتلك طاقة كافية للتغلب على حاجز طاقة التنشيط.
3. الحالة الفيزيائية ومساحة السطح
هذا هو الأكثر صلة بالتفاعلات التي تنطوي على مراحل مختلفة، مثل تفاعل مادة صلبة مع سائل (تفاعلات غير متجانسة). للكتلة الصلبة مساحة سطح محدودة يمكن أن تحدث فيها التصادمات. طحن نفس الكتلة إلى مسحوق ناعم يزيد بشكل كبير من مساحة سطحها، مما يكشف عن المزيد من الجزيئات ويخلق المزيد من المواقع لحدوث التفاعلات.
4. المحفزات
المحفز يزيد من معدل التفاعل دون أن يستهلك في العملية. يقوم بذلك عن طريق توفير مسار تفاعل بديل بطاقة تنشيط أقل.
بالعودة إلى مثالنا، المحفز يشبه بناء نفق عبر التل. لم تعد بحاجة إلى دفع الصخرة حتى القمة؛ يمكنك جعلها تصل إلى الجانب الآخر بجهد أقل بكثير. وهذا يسمح لعدد أكبر من الجزيئات بالتفاعل بنجاح، حتى في درجات الحرارة المنخفضة.
5. الضغط (للتفاعلات الغازية)
بالنسبة للتفاعلات التي تنطوي على غازات، فإن زيادة الضغط تجبر جزيئات الغاز على الاقتراب من بعضها البعض. وهذا يعادل فعليًا زيادة تركيزها، مما يؤدي إلى تصادمات أكثر تكرارًا ومعدل تفاعل أسرع.
فهم المفاضلات
إن التلاعب بمعدلات التفاعل ليس بلا عواقب. يجب على المستشار التقني الفعال أن يأخذ في الاعتبار الآثار العملية والاقتصادية لكل خيار.
تكلفة السرعة
تتطلب زيادة درجة الحرارة والضغط طاقة، وهو ما يكلف المال. وقد يتطلب أيضًا مفاعلات متخصصة وعالية الضغط باهظة الثمن في البناء والصيانة، مما يثير اعتبارات السلامة.
معضلة المحفز
يمكن أن تكون المحفزات فعالة للغاية ولكنها غالبًا ما تكون باهظة الثمن (على سبيل المثال، استخدام معادن ثمينة مثل البلاتين أو البلاديوم). ويمكن أيضًا أن تكون محددة جدًا لتفاعل واحد ويمكن أن تصبح غير نشطة بسبب الشوائب، وهي عملية تُعرف باسم "تسمم المحفز".
خطر التفاعلات الجانبية غير المرغوب فيها
دفع التفاعل بقوة كبيرة، خاصة مع الحرارة المفرطة، يمكن أن يؤدي إلى نتائج غير مرغوب فيها. قد تبدأ المواد المتفاعلة أو المنتجات في التحلل، أو يمكن للطاقة المتزايدة أن تمكن التفاعلات الجانبية غير المرغوب فيها، مما يقلل من نقاء وعائد المنتج المطلوب.
كيفية تطبيق هذا على هدفك
تعتمد استراتيجيتك للتحكم في التفاعل كليًا على ما تحاول تحقيقه.
- إذا كان تركيزك الأساسي هو السرعة القصوى: فإن أقوى الروافع هي زيادة درجة الحرارة واستخدام محفز فعال، حيث يزيد كلاهما بشكل كبير من عدد التصادمات الناجحة والنشطة.
- إذا كان تركيزك الأساسي هو السلامة والتحكم: فإن الإدارة الدقيقة لتركيز المواد المتفاعلة (على سبيل المثال، عن طريق إضافة مادة متفاعلة واحدة ببطء إلى أخرى) واستخدام أدنى درجة حرارة فعالة هي أفضل الأساليب.
- إذا كان تركيزك الأساسي هو الكفاءة من حيث التكلفة: قم بالتحسين للحصول على الظروف الأكثر اعتدالًا الممكنة. قد يتضمن ذلك العثور على محفز ميسور التكلفة أو زيادة مساحة السطح لتجنب تكاليف الطاقة المرتفعة للحرارة والضغط الشديدين.
- إذا كان تركيزك الأساسي هو نقاء المنتج: تجنب درجات الحرارة المرتفعة بشكل مفرط التي قد تسبب التحلل أو التفاعلات الجانبية، وتأكد من أن المحفز الخاص بك انتقائي للغاية للتفاعل المطلوب.
في نهاية المطاف، يعد التحكم في التفاعل الكيميائي فن الإدارة الدقيقة للظروف التي تحكم التصادمات الجزيئية.
جدول ملخص:
| العامل | كيف يؤثر على معدل التفاعل |
|---|---|
| التركيز | يزيد التركيز الأعلى من تكرار التصادم بين جزيئات المواد المتفاعلة. |
| درجة الحرارة | ترفع طاقة الجزيئات وتكرار التصادم؛ وتتجاوز تصادمات أكثر حاجز طاقة التنشيط. |
| مساحة السطح | تزيد مساحة السطح الأكبر (على سبيل المثال، المادة الصلبة المسحوقة) من مواقع التفاعل المتاحة للتصادمات. |
| المحفزات | تقلل من طاقة التنشيط عن طريق توفير مسار تفاعل بديل. |
| الضغط (الغازات) | يزيد من تركيز جزيئات الغاز، مما يؤدي إلى تصادمات أكثر تكرارًا. |
قم بتحسين تفاعلاتك الكيميائية بدقة باستخدام معدات KINTEK. سواء كنت تقوم بتوسيع نطاق الإنتاج، أو ضمان نقاء المنتج، أو زيادة الكفاءة من حيث التكلفة، فإن معداتنا وموادنا الاستهلاكية المخبرية مصممة لتمنحك تحكمًا دقيقًا في ظروف التفاعل. دع خبرائنا يساعدونك في اختيار الأدوات المناسبة لإدارة درجة الحرارة والضغط والتحفيز لاحتياجاتك الخاصة. اتصل بنا اليوم لمناقشة كيف يمكننا دعم نجاح مختبرك!
دليل مرئي
المنتجات ذات الصلة
- مفاعل مفاعل عالي الضغط صغير من الفولاذ المقاوم للصدأ للاستخدام المخبري
- مفاعل مفاعل ضغط عالي من الفولاذ المقاوم للصدأ للمختبر
- مفاعلات الضغط العالي القابلة للتخصيص للتطبيقات العلمية والصناعية المتقدمة
- آلة الضغط الهيدروليكي الأوتوماتيكية المسخنة بألواح مسخنة للمختبر الصحافة الساخنة 25 طن 30 طن 50 طن
يسأل الناس أيضًا
- كيف يمكنك زيادة الضغط في المفاعل؟ إتقان طرق التحكم الأمثل في العمليات الكيميائية
- ما هي الظروف التجريبية التي يوفرها مفاعل HTHP لأنابيب الملف؟ تحسين محاكاة تآكل قاع البئر
- ما هي وظيفة وعاء التفاعل عالي الدقة ذي درجة الحرارة الثابتة؟ تحسين جودة جل السيليكا المعتمد على GPTMS
- ما هو الدور الذي تلعبه وحدة التحكم في التدفق الكتلي (MFC) في التقاط الكربون؟ ضمان تحكم دقيق في الغاز لبيانات امتزاز وتحفيز موثوقة
- لماذا يجب أن يستخدم الاختزال الضوئي التحفيزي لثاني أكسيد الكربون مفاعلًا زجاجيًا مغلقًا بالكوارتز؟ ضمان الدقة وكفاءة الضوء العالية
- ما هي وظيفة المفاعل المختبري في البلمرة التكثيفية؟ ضمان الدقة في تصنيع الراتنج المعدل بالكاردانول
- كيف تعالج أنظمة التفاعل ذات درجات الحرارة العالية تعطيل المحفز في عملية الإصلاح الجاف للميثان (DRM)؟ قم بتحسين عملية إصلاح الميثان لديك الآن
- لماذا يعتبر جهاز التحكم في درجة الحرارة عالي الدقة ضروريًا للمفاعلات التي تحول النفايات البلاستيكية إلى وقود؟ زيادة الإنتاجية



