الاكتشافات التاريخية في الكيمياء الكهربائية
تجربة ضفدع جالفاني
في عام 1791، أجرى العالم الإيطالي لويجي جالفاني تجربة رائدة من شأنها أن تربط بين علم الأحياء والكيمياء الكهربية إلى الأبد. فخلال تشريح ساق ضفدع، لاحظ جالفاني أن الساق ترتعش عندما تلامس معدنين مختلفين. أدت هذه الملاحظة التي تبدو بسيطة إلى إدراك عميق: يمكن للأنسجة البيولوجية توليد إشارات كهربائية والاستجابة لها.
لم يكن هذا الاكتشاف مجرد فضول أكاديمي، بل كانت له آثار عملية أيضًا. وقد أطلق على الظاهرة التي لاحظها جالفاني فيما بعد اسم "الحركة الجلفانية"، وأرسى الأساس لتطوير أجهزة مثل الجلفانومتر، وهو أداة تستخدم لقياس التيارات الكهربائية الصغيرة. علاوة على ذلك، سُميت عملية الجلفنة، وهي طلاء المعادن لمنع التآكل، باسمه تكريمًا له، مما يؤكد على التأثير الدائم لعمله.
كانت تجربة جالفاني لحظة محورية في تاريخ العلوم، حيث سدت الفجوة بين علوم الحياة والعلوم الفيزيائية. فقد أثبتت أنه يمكن فهم الأنظمة البيولوجية من خلال عدسة المبادئ الكهروكيميائية، مما مهد الطريق للتقدم المستقبلي في كلا المجالين.
اختراع فولتا للكومة الفولتية
في عام 1799، حقق الفيزيائي الإيطالي أليساندرو فولتا اكتشافًا رائدًا أرسى الأساس للأنظمة الكهروكيميائية الحديثة. فقد اخترع أول مصدر كيميائي للطاقة، والمعروف باسم الكومة الفولتية، والذي كان في الأساس عبارة عن كومة من أقراص النحاس والزنك مفصولة بقطعة قماش مبللة أو كرتون مبلل بمحلول ملحي. وقد استطاع هذا الجهاز البسيط والمبتكر في الوقت نفسه توليد تيار كهربائي ثابت، مما يمثل فجر توليد الكهرباء العملي.
وسرعان ما أُدركت أهمية اختراع فولتا وسرعان ما حفزت على إجراء المزيد من الأبحاث حول التطبيقات المحتملة لمصدر الطاقة الجديد هذا. وبعد عام واحد فقط، أي في عام 1800، استخدم ويليام نيكلسون وأنتوني كارلايل كومة فولتا لإجراء أول تحليل كهربائي ناجح للماء. وخلال هذه التجربة، لاحظا ترسيب الغازات، وتحديداً الهيدروجين والأكسجين، مما أكد تحلل جزيئات الماء إلى العناصر المكونة لها تحت تأثير التيار الكهربائي.
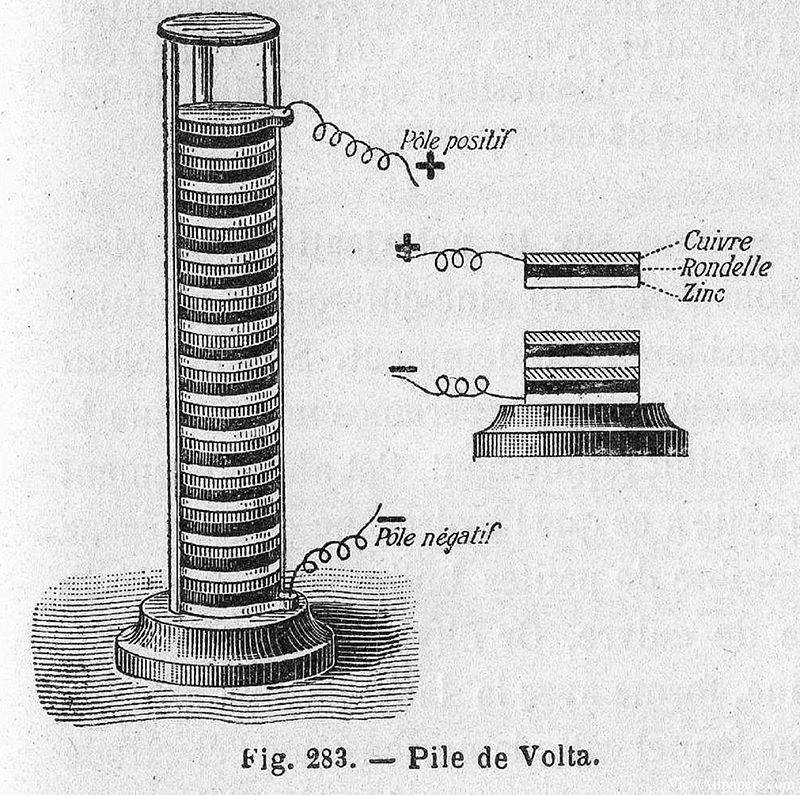
لم يؤكد هذا الاكتشاف صحة مفهوم التحليل الكهربائي فحسب، بل أظهر أيضًا الفائدة العملية لكومة فولتا في التجارب العلمية. وفتحت القدرة على تفكيك المركبات إلى أجزائها الأولية باستخدام الكهرباء آفاقًا جديدة للبحث في الكيمياء والفيزياء، ممهدةً الطريق للتطورات المستقبلية في النظرية الكهروكيميائية وتطبيقاتها.
نجاحات التحليل الكهربائي
في عام 1803، حقق همفري ديفي نجاحًا رائدًا في مجال الكيمياء الكهربية من خلال النجاح في عزل فلزات البوتاسيوم والصوديوم من خلال عملية التحليل الكهربي. لم يُظهر هذا الاكتشاف الضخم قوة الأساليب الكهروكيميائية فحسب، بل مهّد الطريق لإنتاج المونومرات المعدنية النشطة التي تُعد ضرورية في مختلف التطبيقات الصناعية.
تضمنت تجارب ديفي استخدام الكومة الفولتية، وهي أول مصدر للطاقة الكيميائية اخترعه أليساندرو فولتا. ومن خلال تمرير تيار كهربائي عبر الأملاح المنصهرة، تمكن ديفي من تفكيك هذه المركبات والحصول على معادن نقية. كانت هذه التقنية بمثابة تقدم كبير في استخلاص المعادن التفاعلية التي كان من الصعب عزلها في السابق باستخدام الطرق الكيميائية التقليدية.
امتدت آثار عمل ديفي إلى ما وراء المختبر. فقد أرسى نجاحه في التحليل الكهربائي الأساس للأبحاث المستقبلية في العمليات الكهروكيميائية، مما أدى إلى تطوير طرق أكثر كفاءة لاستخلاص المعادن وتنقيتها. كما أكد هذا الاكتشاف أيضًا على إمكانات التقنيات الكهروكيميائية في مختلف القطاعات الصناعية، من علم المعادن إلى التصنيع الكيميائي.
وعلاوة على ذلك، ساهمت النتائج التي توصل إليها ديفي في فهم المبادئ الكهروكيميائية على نطاق أوسع، مما مهد الطريق للتطورات النظرية اللاحقة مثل قانون فاراداي للتحليل الكهربائي ومعادلة نيرنست. وقد أتاحت هذه الأطر النظرية بدورها إجراء دراسات كمية أكثر دقة للظواهر الكهروكيميائية مما أدى إلى مزيد من التقدم في هذا المجال.
وباختصار، كان نجاح ديفي في التحليل الكهربائي للبوتاسيوم والصوديوم في عام 1803 لحظة محورية في تاريخ الكيمياء الكهربائية، حيث أظهر التطبيقات العملية للطرق الكهروكيميائية ووضع الأساس للابتكارات المستقبلية في هذا المجال.
الأسس النظرية للكيمياء الكهربية
قانون فاراداي للتحليل الكهربائي
في عام 1834، صاغ مايكل فاراداي، وهو فيزيائي وكيميائي رائد، قانون التحليل الكهربائي، الذي يعد حجر الزاوية في مجال الكيمياء الكهربائية. قدم هذا القانون إطاراً كمياً لفهم الظواهر الكهروكيميائية وتحليلها، مما أدى إلى تقدم كبير في الأسس النظرية لهذا المجال. وقد كان لعمل فاراداي دور أساسي في سد الفجوة بين الملاحظات التجريبية والنماذج النظرية، ممهدًا الطريق للاكتشافات والتطبيقات المستقبلية في الكيمياء الكهربية.
يتكون قانون فاراداي للتحليل الكهربي من مبدأين أساسيين:
- القانون الأول: تتناسب كتلة المادة المترسبة أو المتحررة عند القطب أثناء التحليل الكهربي تناسباً طردياً مع كمية الكهرباء التي تمر عبر الإلكتروليت.
- القانون الثاني: تتناسب كتلة المادة المترسبة أو المتحررة عند القطب أثناء التحليل الكهربائي تناسبًا طرديًا مع الوزن الكيميائي المكافئ للمادة.
وقد مكّن هذان القانونان العلماء من قياس كمية المادة المتحوّلة بدقة أثناء التفاعل الكهروكيميائي، ما سهّل تطوير إجراءات وتقنيات موحدة في الكيمياء الكهربائية. ومن خلال تحديد العلاقة بين التيار الكهربي والزمن والتغيرات الكيميائية الناتجة، وفرت قوانين فاراداي طريقة قوية لدراسة العمليات الكهروكيميائية والتنبؤ بها.
امتد تأثير عمل فاراداي إلى ما هو أبعد من مجرد القياس الكمي. فقد عززت قوانينه فهماً أعمق للآليات الكامنة وراء التحليل الكهربي، وهو ما أدى بدوره إلى تطورات في تطبيقات عملية مختلفة. وتراوحت هذه التطبيقات من العمليات الصناعية مثل تكرير المعادن والطلاء بالكهرباء إلى تطوير البطاريات وخلايا الوقود، التي تعد جزءاً لا يتجزأ من أنظمة الطاقة الحديثة.
علاوة على ذلك، مهدت مساهمات فاراداي الطريق للتطورات النظرية اللاحقة في الكيمياء الكهربية. وكانت قوانينه أساسية لعمل العلماء اللاحقين مثل فالتر نيرنست، الذي اشتق معادلة نيرنست، وجوليوس تافيل، الذي صاغ معادلة تافيل. وقد حسنت هذه التطورات من فهم إمكانات القطب الكهربائي وحركية التفاعل وسلوك الأيونات في المحلول، وكلها جوانب مهمة في الأبحاث الكهروكيميائية الحديثة.
باختصار، لم يُحدث قانون فاراداي للتحليل الكهربي ثورة في الدراسة الكمية للظواهر الكهروكيميائية فحسب، بل أرسى أيضاً أساساً نظرياً متيناً لمجال الكيمياء الكهربية المزدهر. ولا تزال أعماله تؤثر وتلهم الأبحاث والتطبيقات المعاصرة، مما يؤكد الأهمية الدائمة لإسهاماته في العلوم.
معادلة نيرنست
في عام 1889، قدم الكيميائي الألماني فالتر نيرنست مساهمة رائدة في مجال الكيمياء الكهربية من خلال اشتقاق علاقة رياضية تربط جهد القطب الكهربي بتركيز المواد المشاركة في التفاعل الكهروكيميائي. أصبحت هذه العلاقة، المعروفة الآن باسم معادلة نيرنست، حجر الزاوية في دراسة الأنظمة الكهروكيميائية.
توفر معادلة نيرنست وسيلة كمية للتنبؤ بإمكانية الخلية الكهروكيميائية في ظل ظروف غير قياسية، وهو أمر بالغ الأهمية لفهم العمليات الكهروكيميائية والتحكم فيها. ويتم التعبير عنها على النحو التالي:
[ E = E ^ ^ \circ - \frac{RT}{nF} \nnQ ]
حيث:
- (E) هو جهد القطب الكهربائي.
- (E^\circ) هو جهد القطب القياسي.
- (R) هو ثابت الغاز العام.
- (T) هي درجة الحرارة بالكلفن.
- ( n ) هو عدد مولات الإلكترونات المنقولة في التفاعل.
- ( F ) هو ثابت فاراداي.
- ( Q ) هو حاصل التفاعل.
توضح المعادلة كيف يمكن للتغيرات في التركيز أن تؤثر على إمكانات القطب الكهربائي، وهو أمر حيوي للتطبيقات التي تتراوح بين تصميم البطاريات وعمليات التحليل الكهربائي الصناعية. ومن خلال السماح للعلماء بالتنبؤ بإمكانيات القطب الكهربائي والتلاعب بها، ساهمت معادلة نيرنست في تعزيز قدرتنا على هندسة الأنظمة الكهروكيميائية وتحسينها.
لم يكن هذا الاكتشاف انتصارًا نظريًا فحسب، بل كان انتصارًا عمليًا أيضًا، حيث وفر أداة للعلماء والمهندسين لفهم سلوك الخلايا الكهروكيميائية في ظل ظروف مختلفة والتحكم فيه بشكل أفضل. لا تزال معادلة نيرنست جزءًا لا غنى عنه في النظرية والممارسة الكهروكيميائية، مما يسلط الضوء على التأثير العميق لعمل نيرنست على هذا المجال.
معادلة تافل
في عام 1905، قدم يوليوس تافل معادلة تجريبية رائدة أسست لعلاقة مباشرة بين كثافة التيار والجهد الزائد للهيدروجين. وقد لعبت هذه المعادلة، المعروفة باسم معادلة تافل، دورًا محوريًا في تطوير فهمنا للحركية الكهروكيميائية. كان لعمل تافل دور فعال في توضيح الآليات الكامنة وراء معدل التفاعلات الكهروكيميائية، خاصة تلك التي تنطوي على تطور الهيدروجين.
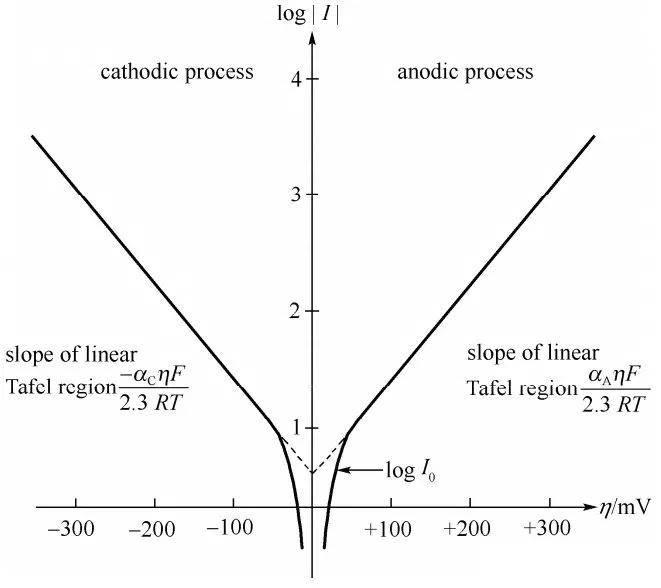
يتم التعبير عن معادلة تافل عادةً على النحو التالي:
$$ \eta = a + b \log(i) $$$$$
حيث:
- (\eta) هو الجهد الزائد,
- (i) هي كثافة التيار,
- (أ) و(ب) هي الثوابت الخاصة بمادة القطب وظروف التفاعل.
وتكمن أهمية معادلة تافل في قدرتها على الوصف الكمي لمعدل العمليات الكهروكيميائية، وهو أمر بالغ الأهمية لتحسين مواد القطب وظروف التفاعل. وقد تم التحقق من صحة هذا القانون التجريبي وتطبيقه على نطاق واسع في مختلف الأنظمة الكهروكيميائية، بدءًا من الأبحاث الأساسية إلى التطبيقات الصناعية.
| المعلمة | الوصف |
|---|---|
| (\إيتا) | الجهد الكهربي الزائد، الجهد الإضافي المطلوب بعد جهد التوازن |
| (i) | كثافة التيار، التيار لكل وحدة مساحة من سطح القطب الكهربائي |
| (a) | ثابت مرتبط بكثافة التيار التبادلي وعامل التماثل |
| (b) | منحدر تافل، المرتبط بمعامل نقل الشحنة |
أرسى عمل تافل الرائد الأساس للأبحاث اللاحقة في الحركيات الكهروكيميائية، مما أثر على تطوير نظريات وتقنيات أكثر تطوراً. وتظل معادلته حجر الزاوية في هذا المجال، حيث تسلط الضوء على التفاعل المعقد بين العمليات الكهربائية والكيميائية في الكيمياء الكهربية.
الحركيات والتقنيات الكهروكيميائية
منذ عام 1940 فصاعدًا، شهد مجال الكيمياء الكهروكيميائية البينية تطورات كبيرة، لا سيما في فهم بنية الطبقة المزدوجة وحركية ترسيب الهيدروجين. وأرست هذه التطورات الأساس لنظريات وتقنيات أكثر تطوراً في الحركيات الكهروكيميائية. وكان من أبرز المساهمات خلال هذه الفترة وضع نظرية ماركوس المجهرية لانتقال الإلكترون. قدمت هذه النظرية إطاراً مفصلاً لفهم كيفية انتقال الإلكترونات عبر السطوح البينية، وهو أمر بالغ الأهمية للعديد من العمليات الكهروكيميائية.
لم تقتصر التطورات في الحركيات الكهروكيميائية على البنى النظرية. فقد تطورت التقنيات التجريبية أيضًا، ما مكّن الباحثين من سبر سلوك الإلكترونات والأيونات في الواجهات بدقة أكبر. على سبيل المثال، سمح تطوير طرق طيفية جديدة بمراقبة التفاعلات الكيميائية التي تحدث على أسطح الأقطاب الكهربائية في الوقت الحقيقي. وكانت هذه التقنيات مفيدة في التحقق من صحة النماذج النظرية وتنقيحها، مثل نظرية ماركوس، من خلال توفير بيانات تجريبية يمكن مقارنتها مباشرة بالتنبؤات النظرية.
علاوة على ذلك، أدى التفاعل بين التطورات النظرية والتجريبية إلى تطوير أنظمة كهروكيميائية أكثر كفاءة. على سبيل المثال، تم تطبيق فهم حركية ترسيب الهيدروجين في تصميم خلايا وقود وبطاريات أفضل، وهي ضرورية لتقنيات تخزين الطاقة وتحويلها الحديثة. وتستفيد هذه الأنظمة من الحركية المحسّنة، مما يؤدي إلى كفاءة أعلى وعمر تشغيلي أطول.
باختصار، شهدت الفترة من عام 1940 فصاعدًا حقبة تحول في الحركيات والتقنيات الكهروكيميائية. ولم يؤد التآزر بين الرؤى النظرية والقدرات التجريبية إلى تعميق فهمنا للعمليات الأساسية فحسب، بل مهّد الطريق أيضًا للتطبيقات العملية في مجال الطاقة وعلوم المواد.
التقنيات الكهروكيميائية في الموقع
أحدثت التقنيات الكهروكيميائية الموضعية ثورة في استكشاف الآليات الكهروكيميائية منذ ظهورها في السبعينيات. تسمح هذه التقنيات للباحثين بمراقبة وتحليل العمليات الكهروكيميائية مباشرةً داخل بيئاتها التشغيلية، مما يوفر رؤى لا مثيل لها في ديناميكيات التفاعلات في واجهة القطب الكهربائي-الإلكتروليت.
ويتمثل أحد أهم التطورات في هذا المجال في دمج التحليل الطيفي للامتصاص الكهروكيميائي في الموقع بالأشعة السينية (XAS). تتيح هذه الطريقة المراقبة في الوقت الحقيقي للتغيرات في البنية الإلكترونية وحالات الأكسدة للمواد أثناء التفاعلات الكهروكيميائية. من خلال الجمع بين XAS والتقنيات الكهروكيميائية، يمكن للعلماء ربط التحولات الهيكلية بالأداء الكهروكيميائي، وبالتالي تعميق فهمنا للعمليات التحفيزية ومواد الأقطاب الكهربائية.
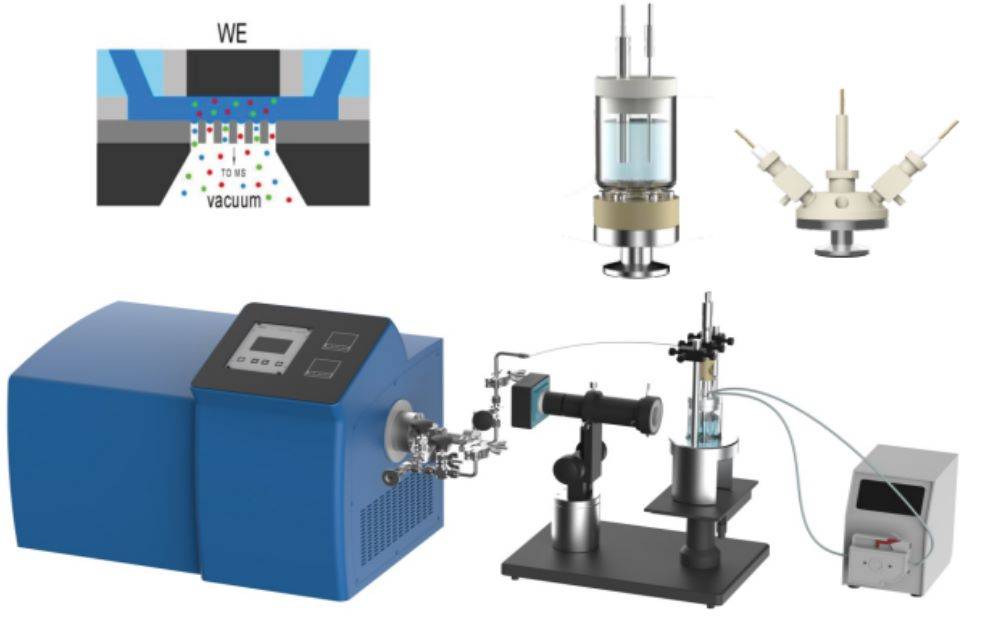
وبالإضافة إلى XAS، اكتسبت تقنيات أخرى في الموقع مثل الفحص المجهري الكهروكيميائي الماسح (SECM) والتحليل الطيفي لرامان في الموقع أهمية كبيرة. ويتيح الفحص المجهري الكهروكيميائي الماسح إمكانية الاستبانة المكانية للعمليات الكهروكيميائية على مقياس الميكرومتر، بينما يوفر التحليل الطيفي لرامان في الموقع معلومات اهتزازية مفصلة عن الأنواع المشاركة في التفاعلات.
لم تقتصر براعة ودقة التقنيات الكهروكيميائية في الموقع على تعزيز البحوث الأساسية فحسب، بل سرّعت أيضًا من تطوير التطبيقات العملية. على سبيل المثال، هذه التقنيات مفيدة في تحسين أداء البطاريات وخلايا الوقود والمحفزات الكهربائية. من خلال توفير بيانات في الوقت الفعلي عن المواد الوسيطة للتفاعل والتعديلات السطحية، تساعد الطرق الموضعية في تصميم أجهزة كهروكيميائية كهربائية أكثر كفاءة ومتانة.
وعلاوة على ذلك، فإن التطور المستمر لهذه التقنيات يوسع نطاق تطبيقها. وتتيح التطورات في الأجهزة وأساليب تحليل البيانات دقة أعلى، والحصول على البيانات بشكل أسرع، وتفسير النتائج بشكل أكثر دقة. يمهد هذا التقدم الطريق للجيل القادم من الأبحاث الكهروكيميائية حيث ستلعب التقنيات الموضعية دورًا محوريًا في كشف تعقيدات الأنظمة الكهروكيميائية.
الاتجاهات الحديثة في الكيمياء الكهروكيميائية
الآليات الكهروكيميائية المجهرية
يعد استكشاف العمليات الكهروكيميائية على المستويين الذري والجزيئي نقطة محورية في الأبحاث المعاصرة. يستخدم هذا المجال في المقام الأول في الموقع و وغير الموضعية وغير الموضعية لتشريح الآليات المعقدة التي تحكم هذه العمليات. وتسمح هذه التقنيات للباحثين بمراقبة التفاعلات الكهروكيميائية أثناء حدوثها وتحليلها، مما يوفر رؤى غير مسبوقة في الديناميكيات التي تحدث.
أحد التطورات الرئيسية في هذا المجال هو استخدام التحليل الطيفي لامتصاص الأشعة السينية الكهروكيميائية في الموقع (XAS) . تتيح هذه الطريقة المراقبة في الوقت الفعلي للتغيرات في البنية الإلكترونية وحالات الأكسدة للمواد أثناء التفاعلات الكهروكيميائية. على سبيل المثال، يمكن أن يكشف XAS عن كيفية تغير سطح المحفز أثناء تحفيز تفاعل معين، مما يوفر أدلة لتحسين المحفز لتحسين الأداء.
بالإضافة إلى ذلك الفحص المجهري النفقي بالمسح الضوئي (STM) و ومجهر القوة الذرية (AFM) في تصوير مورفولوجيا السطح والخصائص الإلكترونية للأقطاب الكهربائية على المستوى الذري. وقد كانت هذه التقنيات حاسمة في فهم كيفية تأثير العيوب السطحية والممتزات والخصائص المجهرية الأخرى على السلوك الكهروكيميائي للمواد.
ولبناء آلية تفاعل شاملة ومنطقية، غالبًا ما يجمع الباحثون بين هذه الملاحظات المجهرية والنماذج النظرية. على سبيل المثال نظرية الكثافة الوظيفية (DFT) يمكن لحسابات نظرية الكثافة الوظيفية (DFT) أن تتنبأ بمناظر الطاقة لمسارات التفاعل المحتملة، بينما الديناميكيات الجزيئية (MD) محاكاة الديناميكيات الجزيئية (MD) يمكن أن تمثل السلوك المعتمد على الوقت للأيونات والجزيئات في المنحل بالكهرباء.
وقد أدى التكامل بين النهج التجريبية والنظرية إلى تحقيق اختراقات كبيرة في هذا المجال. على سبيل المثال، استرشد التصميم العقلاني للمحفزات الكهربائية لتقسيم الماء واختزال ثاني أكسيد الكربون بالرؤى المكتسبة من هذه الجهود المشتركة. ومثل هذه التطورات لا تعزز فهمنا الأساسي للعمليات الكهروكيميائية فحسب، بل تمهد الطريق لتطوير تقنيات طاقة أكثر كفاءة واستدامة.
باختصار، أحدث استخدام التقنيات المتقدمة في الموقع وغير الموقعية، إلى جانب النمذجة النظرية، ثورة في دراسة الآليات الكهروكيميائية على المستوى المجهري. ويستمر هذا النهج متعدد التخصصات في دفع عجلة الابتكار في كل من البحوث الأكاديمية والتطبيقات الصناعية.
التطورات في مجال الاختبارات الكهروكيميائية
تشهد الطرق الكهروكيميائية التقليدية تحولات كبيرة لتلبية المتطلبات المعاصرة. هذه التطورات مدفوعة بالحاجة إلى تعزيز حساسية المراقبة والتكيف مع الظروف البيئية القاسية ودمج المعالجات الرياضية المتطورة. إن تطور تقنيات الاختبار الكهروكيميائية ليس مجرد تحسين تدريجي بل هو نقلة نوعية تسد الفجوة بين الفهم النظري والتطبيق العملي.
ويتمثل أحد مجالات التطور الرئيسية في دمج النماذج الرياضية المتقدمة. وتسمح هذه النماذج بتنبؤات وتفسيرات أكثر دقة للظواهر الكهروكيميائية، خاصة في الأنظمة المعقدة التي تقصر فيها الطرق التقليدية. على سبيل المثال، أتاح دمج خوارزميات التعلّم الآلي تحليل العمليات الكهروكيميائية في الوقت الحقيقي وتحسينها، مما قلل بشكل كبير من الوقت والموارد اللازمة للتجارب.

وعلاوة على ذلك، فتحت قدرة هذه الأساليب على التكيف مع الظروف القاسية مجالات جديدة للبحث والتطبيق. وسواء كانت درجات الحرارة المرتفعة للعمليات الصناعية أو درجات الحرارة المنخفضة لاستكشاف الفضاء، يتم تصميم التقنيات الكهروكيميائية الحديثة لتؤدي أداءً موثوقًا وفعالاً. هذه القدرة على التكيف أمر بالغ الأهمية للصناعات التي تتراوح بين إنتاج الطاقة وعلوم المواد، حيث يمكن أن تختلف الظروف بشكل كبير.
وبالإضافة إلى التطورات الرياضية، شهدت مكونات الأجهزة الخاصة بالاختبارات الكهروكيميائية تحسينات ملحوظة. أصبحت أجهزة الاستشعار عالية الدقة والأنظمة الآلية شائعة الآن، مما يسمح بالمراقبة المستمرة وجمع البيانات. ولم تعد هذه الأنظمة أكثر دقة فحسب، بل أصبحت أيضًا أكثر سهولة في الاستخدام، مما يجعل الاختبارات الكهروكيميائية المتقدمة في متناول مجموعة واسعة من الباحثين والصناعات.
وقد أدى التآزر بين هذه التطورات في النمذجة الرياضية والقدرة على التكيف البيئي وتحسينات الأجهزة إلى حقبة جديدة في الاختبارات الكهروكيميائية. وتتميز هذه الحقبة بمزيد من الدقة والكفاءة وقابلية التطبيق، مما يمهد الطريق لتحقيق اختراقات في كل من البحوث الأساسية والتطبيقات العملية.
تطبيقات متعددة التخصصات
تتجلى براعة الكيمياء الكهربائية في تطبيقاتها الواسعة النطاق في مختلف المجالات العلمية والصناعية. أحد أهم مجالات التطبيق هو التخليق الكهربي الذي يستفيد من العمليات الكهروكيميائية لتخليق مركبات عضوية وغير عضوية معقدة. وتعد هذه الطريقة مفيدة بشكل خاص في إنتاج المستحضرات الصيدلانية والكيماويات الزراعية والمواد الكيميائية المتخصصة، مما يوفر تحكمًا دقيقًا في ظروف التفاعل وتقليل النفايات.
عمليات التحليل الكهربائي هي حجر الزاوية الآخر في الكيمياء الكهربائية الحديثة، حيث تلعب دورًا حاسمًا في إنتاج المواد الكيميائية الصناعية الأساسية مثل الكلور وهيدروكسيد الصوديوم في صناعة الكلور والقلويات. بالإضافة إلى ذلك، يعتبر التحليل الكهربائي حيويًا في استخراج المعادن مثل الألومنيوم وفي توليد الهيدروجين من خلال التحليل الكهربائي للماء، وهو أمر محوري لحلول الطاقة المستدامة.
الحماية من التآكل هو تطبيق بالغ الأهمية حيث يتم استخدام المبادئ الكهروكيميائية لحماية المعادن من التآكل. وتستخدم تقنيات مثل الطلاء الكهربائي وحماية الأنود القرباني والحماية الأنودية على نطاق واسع لإطالة عمر الهياكل المعدنية في بيئات مختلفة، من البيئات البحرية إلى المنشآت الصناعية.
التحفيز الكهربائي يمثل مجالاً متطورًا تتقاطع فيه الكيمياء الكهربية مع الحفز لتعزيز كفاءة التفاعلات الكيميائية. ويكتسب هذا الأمر أهمية خاصة في تطوير خلايا الوقود التي تحوّل الطاقة الكيميائية مباشرةً إلى طاقة كهربائية بكفاءة عالية وأثر بيئي ضئيل.
في مجال مصادر الطاقة الجديدة تحتل الكيمياء الكهربائية موقع الصدارة في مجال الأبحاث المتعلقة بتقنيات البطاريات المتقدمة، بما في ذلك بطاريات الليثيوم أيون وبطاريات الحالة الصلبة. وتعد هذه التقنيات ضرورية للانتقال إلى أنظمة الطاقة المتجددة، حيث توفر كثافة طاقة أعلى وعمر افتراضي أطول مقارنة بالبطاريات التقليدية.
الكيمياء الكهروضوئية تدمج الكيمياء الضوئية مع الكيمياء الكهروكيميائية باستخدام الطاقة الضوئية لتحريك التفاعلات الكهروكيميائية. ويُعد هذا المجال بالغ الأهمية لتطوير الخلايا الشمسية وتقسيم الماء الكهروكيميائي الضوئي، الذي يمكنه تحويل ضوء الشمس مباشرة إلى هيدروجين، وهو وقود نظيف ووفير.
وأخيراً الكيمياء الكهروكيميائية الحيوية هو تخصص ناشئ يطبق المبادئ الكهروكيميائية على الأنظمة البيولوجية. ويشمل ذلك تطوير أجهزة استشعار حيوية للتشخيص الطبي والتحفيز الكهروكيميائي الحيوي من أجل المعالجة الحيوية وإنتاج الطاقة الحيوية. تسلط هذه التطبيقات الضوء على التأثير العميق للكيمياء الكهربائية على كل من صحة الإنسان والاستدامة البيئية.
التطبيقات العملية للكيمياء الكهربائية
التحليل الكهربي والتخليق الكهربي
يلعب التحليل الكهربائي والتخليق الكهربائي دورًا محوريًا في تحويل المواد الخام إلى منتجات قيّمة، مما يقود العديد من العمليات الصناعية. إن صناعة الكلور والقلويات باعتبارها حجر الزاوية، حيث تستخدم التحليل الكهربائي لإنتاج الكلور وهيدروكسيد الصوديوم الضروريين لمختلف العمليات الكيميائية وقطاعات التصنيع. ولا تضمن هذه العملية توفير إمدادات ثابتة من هذه المواد الكيميائية فحسب، بل تؤكد أيضًا على كفاءة الأساليب الكهروكيميائية وقابليتها للتطوير.
في مجال التحليل الكهربائي للألومنيوم تظل عملية Hall-Héroult لا غنى عنها. وتعد هذه الطريقة، التي تنطوي على الاختزال الإلكتروليتي للألومينا الذائبة في الكريوليت المنصهر، حاسمة بالنسبة لصناعة إنتاج الألومنيوم العالمية. وقد أدى التنقيح والتحسين المستمر لهذه العملية إلى تقليل استهلاك الطاقة والأثر البيئي بشكل كبير، مما يجعلها نموذجًا للممارسات الصناعية المستدامة.

التحليل الكهربائي للماء اهتمامًا كبيرًا، لا سيما في سياق تخزين الطاقة المتجددة وإنتاج الهيدروجين. فمن خلال تقسيم الماء إلى هيدروجين وأكسجين باستخدام تيار كهربائي، تقدم هذه العملية حلاً نظيفاً وقابلاً للتطوير لتوليد وقود الهيدروجين، الذي يمكن تخزينه واستخدامه لتشغيل تطبيقات مختلفة، من النقل إلى العمليات الصناعية.
التخليق الكهربائي يوسّع نطاق التطبيقات الكهروكيميائية، مما يتيح تخليق الجزيئات العضوية المعقدة والمستحضرات الصيدلانية. وتسمح هذه التقنية بالتحكم الدقيق في ظروف التفاعل، مما يؤدي إلى زيادة المردود ونقاء المنتجات. وتتجلى براعة التخليق الكهروكيميائي في استخدامها في إنتاج المواد الكيميائية الدقيقة والكيماويات الزراعية والمواد المتخصصة، مما يعزز أهميتها في التصنيع الكيميائي الحديث.
وتسلط هذه التطبيقات مجتمعةً الضوء على الإمكانات التحويلية للتحليل الكهربائي والتخليق الكهربائي، مما يدفع الابتكار في العديد من الصناعات ويساهم في تحقيق أهداف التنمية المستدامة.
تآكل المعادن وحمايتها
يعد تآكل المعادن مشكلة كبيرة في مختلف الصناعات، مما يؤدي إلى خسائر اقتصادية كبيرة ومخاطر تتعلق بالسلامة. وللتخفيف من هذه الآثار، تم تطوير وتنفيذ العديد من الطرق المتقدمة. ومن بين هذه الطرق الطلاء الكهربائي كتقنية متعددة الاستخدامات لا تعزز المظهر الجمالي للمعادن فحسب، بل تحسن أيضًا من مقاومتها للتآكل بشكل كبير. فعن طريق ترسيب طبقة رقيقة من معدن أكثر مقاومة للتآكل على سطح المعدن الأساسي، يعمل الطلاء الكهربائي كحاجز وقائي ضد العناصر البيئية.
وهناك طريقة فعالة أخرى وهي حماية الأنود القرباني والتي تتضمن ربط معدن أكثر تفاعلية بالهيكل الذي يحتاج إلى حماية. ويتآكل هذا المعدن المضحي، المصنوع غالباً من المغنيسيوم أو الزنك، بشكل تفضيلي، وبالتالي حماية المعدن الأساسي من التآكل. تُستخدم هذه التقنية على نطاق واسع في البيئات البحرية حيث تكون معدلات التآكل عالية بشكل خاص.
الحماية الأنودية هي طريقة متطورة أخرى تنطوي على استقطاب المعدن إلى إمكانات تجعل المعدن سلبيًا، مما يقلل بشكل كبير من معدل التآكل. هذه الطريقة فعالة بشكل خاص للمعادن التي يمكن أن تشكل طبقة أكسيد مستقرة، مثل الفولاذ المقاوم للصدأ. ومن خلال التحكم في الإمكانات، يمكن للحماية الأنودية إطالة عمر البنية التحتية الحيوية في صناعات مثل المعالجة الكيميائية وتكرير النفط.
هذه الطرق، إلى جانب طرق أخرى مثل الحماية الكاثودية و وتقنيات الطلاء تشكل مجتمعةً ترسانة قوية ضد تآكل المعادن، مما يضمن طول عمر الهياكل المعدنية وموثوقيتها في تطبيقات متنوعة.
الكيمياء الكهربائية الحيوية
تمثل الكيمياء الكهروكيميائية الحيوية تقاطعًا رائعًا بين علم الأحياء والكيمياء الكهربائية، مع تطبيقات تمتد من التشخيص الطبي إلى المراقبة البيئية. ويتمثل أحد أبرز التطبيقات في تطوير المستشعرات الحيوية التي تستفيد من الجزيئات البيولوجية للكشف عن مواد معينة وتحديد كميتها. وتُعد هذه المستشعرات محورية في التشخيص الطبي، حيث تسمح بالكشف السريع والدقيق عن المؤشرات الحيوية والهرمونات ومسببات الأمراض. على سبيل المثال، تُستخدم أجهزة الاستشعار البيولوجية للجلوكوز على نطاق واسع في إدارة مرض السكري، مما يوفر مراقبة فورية لمستويات الجلوكوز في الدم.
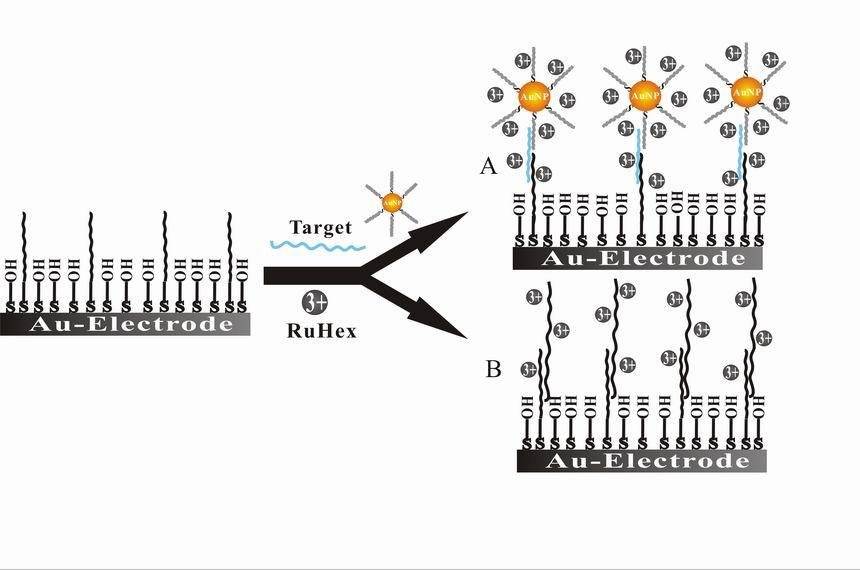
بالإضافة إلى المستشعرات الحيوية التحفيز الكهربي الحيوي هو مجال آخر بالغ الأهمية في الكيمياء الحيوية. ويركز هذا المجال على استخدام الإنزيمات أو الكائنات الحية الدقيقة كمحفزات في التفاعلات الكهروكيميائية، مما يعزز كفاءة هذه العمليات وخصوصيتها. وللحفز الكهروكيميائي الحيوي آثار كبيرة في الطاقة المتجددة ومعالجة النفايات والعمليات الصناعية. على سبيل المثال، تستخدم خلايا الوقود الميكروبية التحفيز الكهربي الحيوي لتحويل النفايات العضوية مباشرة إلى كهرباء، مما يوفر حلاً مستداماً لإنتاج الطاقة وإدارة النفايات.
| التطبيق | الوصف | مثال |
|---|---|---|
| المستشعرات الحيوية | استخدام الجزيئات البيولوجية للكشف والقياس الكمي | أجهزة الاستشعار الحيوية للجلوكوز لإدارة مرض السكري |
| الحفز الكهروكيميائي الحيوي | استخدام الإنزيمات أو الكائنات الحية الدقيقة كمحفزات في التفاعلات الكهروكيميائية | خلايا الوقود الميكروبية لإنتاج الطاقة من النفايات العضوية |
يستمر التآزر بين المبادئ البيولوجية والكهروكيميائية الحيوية في الكيمياء الحيوية في دفع عجلة الابتكار، مما يعد بأدوات وأساليب جديدة واعدة لكل من البحث العلمي والتطبيقات العملية.
إمدادات الطاقة الكيميائية
تشمل إمدادات الطاقة الكيميائية مجموعة متنوعة من التقنيات، لكل منها خصائص وتطبيقات فريدة من نوعها. وتشمل الفئات الأساسية البطاريات الأولية والبطاريات الثانوية وبطاريات أيونات الليثيوم وخلايا الوقود. البطاريات الأولية، مثل البطاريات القلوية وبطاريات الزنك والكربون، مصممة للاستخدام مرة واحدة وتوجد عادة في الأجهزة اليومية مثل أجهزة التحكم عن بعد والمصابيح الكهربائية. أما البطاريات الثانوية، أو البطاريات القابلة لإعادة الشحن، فتشمل بطاريات الرصاص الحمضية وهيدريد النيكل المعدني، والتي يمكن إعادة شحنها عدة مرات، مما يجعلها مثالية للتطبيقات التي تتطلب طاقة مستمرة لفترات طويلة.
وقد أحدثت بطاريات الليثيوم أيون ثورة في مجال الإلكترونيات المحمولة والمركبات الكهربائية نظراً لكثافة طاقتها العالية وعمرها الطويل ومعدلات التفريغ الذاتي المنخفضة. وتتألف هذه البطاريات من مركبات الليثيوم كأقطاب كهربائية وإلكتروليت غير مائي، مما يوفر توازناً بين التكلفة والأداء والأثر البيئي.
من ناحية أخرى، تمثل خلايا الوقود تقدماً كبيراً في تكنولوجيا الطاقة المستدامة. وعلى عكس البطاريات التي تخزّن الطاقة كيميائياً، تولّد خلايا الوقود الكهرباء من خلال التفاعل الكهروكيميائي للوقود، وهو عادةً الهيدروجين، مع مادة مؤكسدة، وهي عادةً الأكسجين. وتؤدي هذه العملية إلى كفاءة عالية وتلوث منخفض وقدرة على ضبط توليد الطاقة حسب الطلب. تعد خلايا الوقود واعدة بشكل خاص لتطبيقات مثل السيارات الكهربائية وأنظمة الطاقة الاحتياطية وحتى استكشاف الفضاء، حيث تكون الطاقة الموثوقة والنظيفة ذات أهمية قصوى.
| نوع البطارية | حالات الاستخدام الأساسية | المزايا الرئيسية |
|---|---|---|
| البطاريات الأساسية | الأجهزة ذات الاستخدام الواحد (أجهزة التحكم عن بعد والمصابيح الكهربائية) | فعالة من حيث التكلفة ومتوفرة على نطاق واسع |
| البطاريات الثانوية | الأجهزة القابلة لإعادة الشحن (الهواتف، أجهزة الكمبيوتر المحمولة) | قابلة لإعادة الاستخدام، وعمر افتراضي طويل |
| بطاريات الليثيوم أيون | الأجهزة الإلكترونية المحمولة والمركبات الكهربائية | كثافة طاقة عالية، تفريغ ذاتي منخفض |
| خلايا الوقود | المركبات الكهربائية، والطاقة الاحتياطية، والفضاء | كفاءة عالية، منخفضة التلوث، قابلة للتطوير |
المنتجات ذات الصلة
- محطة عمل كهروكيميائية مقياس الجهد للاستخدام المخبري
- قطب القرص الذهبي
- قطب ورقة الذهب الكهروكيميائي قطب الذهب
- تركيبة قطب كهربائي للتجارب الكهروكيميائية
- خلية التحليل الكهربائي من النوع H خلية كهروكيميائية ثلاثية
المقالات ذات الصلة
- الدليل النهائي لأجهزة تحليل السبائك المحمولة باليد: الميزات والتطبيقات والمزايا
- استكشاف حمام ماء الخلايا الإلكتروليتية متعدد الوظائف: التطبيقات والفوائد
- إحداث ثورة في مراقبة الجودة: الدليل النهائي لأجهزة تحليل بطاريات الليثيوم المحمولة باليد
- هندسة اليقين: إتقان التحكم في الخلايا الكهروكيميائية متعددة الوظائف
- فهم أقطاب الكالوميل المشبعة المرجعية: التركيب والاستخدامات والاعتبارات













