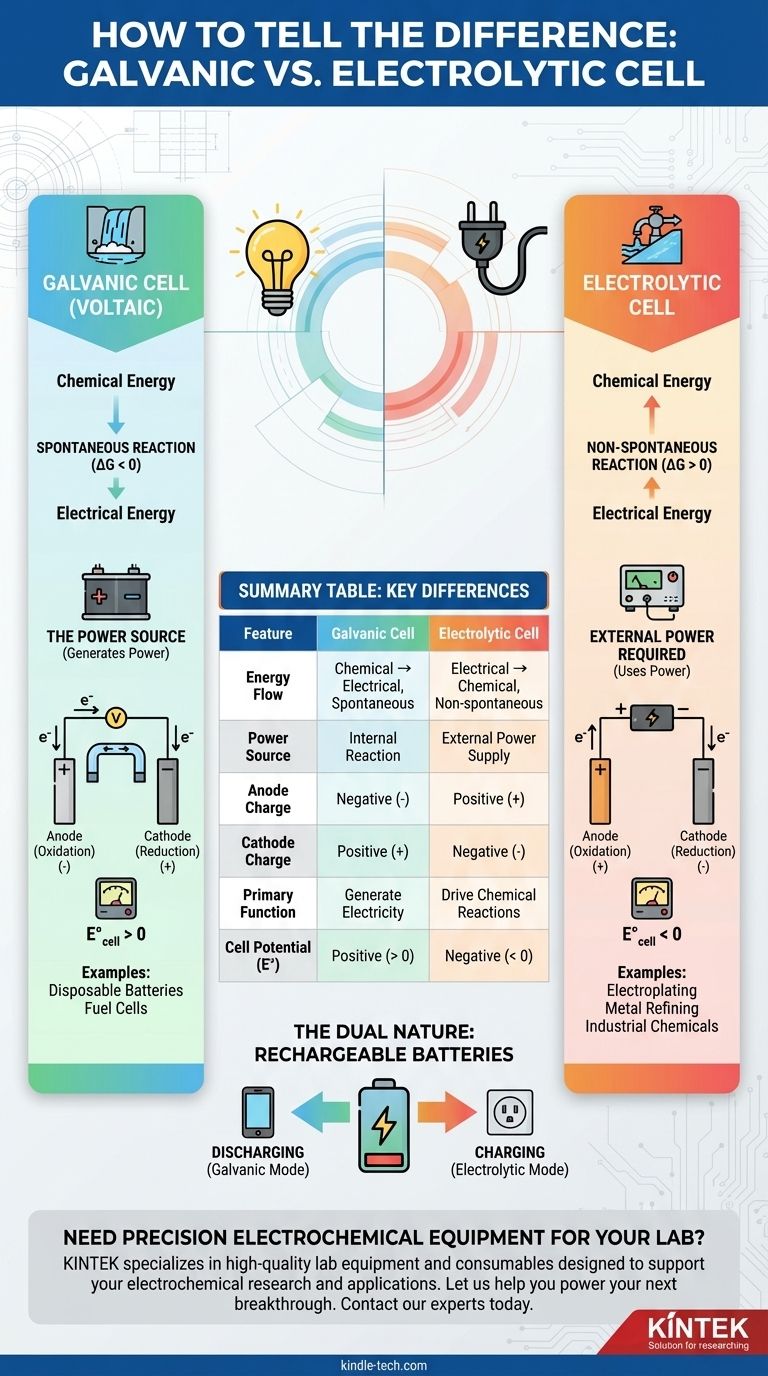
يكمن الاختلاف الأساسي بين الخلية الغلفانية والخلية الإلكتروليتية في تدفق الطاقة. تستخدم الخلية الغلفانية، والمعروفة أيضًا باسم الخلية الفولتية، تفاعلًا كيميائيًا تلقائيًا لتوليد طاقة كهربائية. في المقابل، تستخدم الخلية الإلكتروليتية طاقة كهربائية خارجية لإجبار تفاعل كيميائي غير تلقائي على الحدوث.
فكر في الأمر بهذه الطريقة: الخلية الغلفانية تشبه الشلال الذي يولد الطاقة أثناء تدفقه إلى الأسفل بشكل طبيعي. أما الخلية الإلكتروليتية فهي تشبه المضخة التي تستخدم طاقة خارجية لدفع الماء صعودًا ضد الجاذبية.

المبدأ الأساسي: التلقائية وتحويل الطاقة
يُملي سلوك أي خلية كهروكيميائية ما إذا كان تفاعلها الداخلي يحدث من تلقاء نفسه أم يتطلب تدخلًا خارجيًا.
الخلايا الغلفانية: إطلاق الطاقة الكيميائية
تُعرَّف الخلية الغلفانية بتفاعل أكسدة واختزال تلقائي. هذا يعني أن التفاعل يريد أن يحدث من تلقاء نفسه، مطلقًا الطاقة في هذه العملية.
هذه العملية تحول الطاقة الكيميائية المخزنة مباشرة إلى طاقة كهربائية. الخلية نفسها هي مصدر الطاقة.
من الناحية الديناميكية الحرارية، يتوافق هذا مع طاقة جيبس الحرة السالبة (ΔG < 0) وجهد خلية موجب (E°_cell > 0).
الخلايا الإلكتروليتية: إدخال الطاقة الكهربائية
تتضمن الخلية الإلكتروليتية تفاعلًا غير تلقائي. بدون دفعة خارجية، لن يحدث هذا التفاعل.
إنه يتطلب مصدر طاقة خارجيًا، مثل بطارية أو مصدر تيار مستمر، لدفع التفاعل إلى الأمام. هذه العملية تحول الطاقة الكهربائية إلى طاقة كيميائية.
يتوافق هذا مع طاقة جيبس الحرة الموجبة (ΔG > 0) وجهد خلية سالب (E°_cell < 0). يجب أن يكون الجهد الخارجي أكبر من هذا الجهد السالب لإجبار التفاعل.
كيفية تحديد كل خلية: المؤشرات الرئيسية
إلى جانب اتجاه تدفق الطاقة، يمكنك التمييز بين الخليتين من خلال ملاحظة قطبية الأقطاب الكهربائية والدائرة الكلية.
مصدر الطاقة
هذا هو المؤشر الأكثر وضوحًا. إذا كانت الخلية الكهروكيميائية هي البطارية التي تزود جهازًا بالطاقة، فهي خلية غلفانية.
إذا كانت الخلية متصلة ببطارية خارجية أو مصدر طاقة، فهي خلية إلكتروليتية. يوفر المصدر الخارجي الطاقة لدفع العملية.
قطبية الأقطاب الكهربائية (نقطة شائعة للالتباس)
تعاريف المصعد والمهبط ثابتة لكلا نوعي الخلايا:
- المصعد (Anode): القطب الذي تحدث عنده الأكسدة.
- المهبط (Cathode): القطب الذي تحدث عنده الاختزال.
ومع ذلك، فإن شحنتها الموجبة/السالبة (القطبية) تنعكس:
في الخلية الغلفانية، يتسبب التفاعل التلقائي عند المصعد في إطلاق الإلكترونات، مما يجعله الطرف السالب (-). أما المهبط، الذي يستهلك الإلكترونات، فهو الطرف الموجب (+).
في الخلية الإلكتروليتية، يحدد مصدر الطاقة الخارجي القطبية. يسحب الإلكترونات بعيدًا عن المصعد، مما يجعله الطرف الموجب (+)، ويدفع الإلكترونات إلى المهبط، مما يجعله الطرف السالب (-).
التطبيقات والمزالق الشائعة
إن الغرض من الخلية هو الفاصل العملي الأكثر أهمية. إحداهما تولد الطاقة، بينما تستخدم الأخرى الطاقة لإنشاء مادة أو تغيير.
الغرض من الخلية الغلفانية
الوظيفة الوحيدة للخلية الغلفانية هي العمل كمصدر للطاقة الكهربائية.
تشمل الأمثلة الشائعة البطاريات التي تستخدم لمرة واحدة (AA، AAA)، وخلايا الوقود، والوظيفة الأساسية لبطارية السيارة عند تشغيل المحرك.
الغرض من الخلية الإلكتروليتية
الهدف من الخلية الإلكتروليتية هو دفع تحول كيميائي مفيد لن يحدث لولا ذلك.
تشمل التطبيقات النموذجية الطلاء الكهربائي لطبقة رقيقة من المعدن على سطح ما، وتكرير المعادن مثل النحاس والألمنيوم، وإنتاج مواد كيميائية صناعية مثل غاز الكلور.
الطبيعة المزدوجة للبطاريات القابلة لإعادة الشحن
البطارية القابلة لإعادة الشحن هي المثال المثالي لكلا نوعي الخلايا في جهاز واحد.
- عند التفريغ (تشغيل هاتفك): تعمل كـ خلية غلفانية، حيث يؤدي تفاعل تلقائي إلى توليد الكهرباء.
- عند الشحن (موصولة بالكهرباء): تعمل كـ خلية إلكتروليتية، حيث تجبر الطاقة الخارجية التفاعل العكسي غير التلقائي لتخزين الطاقة.
إجراء التمييز الصحيح لهدفك
لتحديد الخلية التي تتعامل معها بسرعة، ركز على تدفق الطاقة والهدف العام للنظام.
- إذا كان تركيزك الأساسي هو توليد الطاقة: فأنت تتعامل مع خلية غلفانية، حيث يطلق تفاعل تلقائي الطاقة.
- إذا كان تركيزك الأساسي هو إنشاء مادة أو عكس تفاعل: فأنت تستخدم خلية إلكتروليتية، والتي تتطلب مصدر طاقة خارجيًا لدفع عملية غير تلقائية.
- إذا كنت تقوم بتحليل علامات الأقطاب الكهربائية: تذكر أنه في الخلية الغلفانية يكون المصعد سالبًا، بينما في الخلية الإلكتروليتية يكون موجبًا، لأن مصدر الطاقة إما داخلي أو خارجي.
في نهاية المطاف، يعد فهم ما إذا كانت الطاقة منتجًا أم متطلبًا هو المفتاح للتمييز بين هاتين الخليتين الكهروكيميائيتين الأساسيتين.
جدول ملخص:
| الميزة | الخلية الغلفانية | الخلية الإلكتروليتية |
|---|---|---|
| تدفق الطاقة | كيميائي ← كهربائي (تلقائي) | كهربائي ← كيميائي (غير تلقائي) |
| مصدر الطاقة | تفاعل داخلي | مصدر طاقة خارجي |
| شحنة المصعد | سالب (-) | موجب (+) |
| شحنة المهبط | موجب (+) | سالب (-) |
| الوظيفة الأساسية | توليد الكهرباء | دفع التفاعلات الكيميائية (مثل الطلاء الكهربائي) |
| جهد الخلية (E°) | موجب (> 0) | سالب (< 0) |
هل تحتاج إلى معدات كهروكيميائية دقيقة لمختبرك؟
يعد فهم الفروق الدقيقة بين الخلايا الغلفانية والإلكتروليتية أمرًا بالغ الأهمية للأعمال المخبرية المتقدمة. سواء كنت تقوم بتطوير تقنيات بطاريات جديدة، أو إجراء طلاء كهربائي، أو إجراء تحليل للمواد، فإن الحصول على المعدات المناسبة أمر ضروري.
تتخصص KINTEK في المعدات والمواد الاستهلاكية المخبرية عالية الجودة المصممة لدعم أبحاثك وتطبيقاتك الكهروكيميائية. نحن نقدم حلولًا موثوقة تضمن نتائج دقيقة وتعزز كفاءة مختبرك.
دعنا نساعدك في تزويد ابتكارك القادم بالطاقة. اتصل بخبرائنا اليوم لمناقشة احتياجات مختبرك المحددة واكتشاف كيف يمكن لمنتجاتنا أن تدفع نجاحك.
دليل مرئي
المنتجات ذات الصلة
- خلية كهروكيميائية تحليل كهربائي بخمسة منافذ
- خلية كهروكيميائية بالتحليل الكهربائي لتقييم الطلاء
- خلية غاز الانتشار الكهروكيميائية التحليلية خلية تفاعل سائل
- معدات مختبر البطاريات، جهاز اختبار سعة البطارية والاختبار الشامل
- ورق كربون محب للماء TGPH060 لتطبيقات مختبر البطاريات
يسأل الناس أيضًا
- ما هي الطريقة الصحيحة للتعامل مع خلية تحليل كهربائي بحوض مائي خماسي المنافذ؟ ضمان تجارب كيميائية كهربائية دقيقة وآمنة
- من أي مادة صُنِعَ خزان التحليل الكهربائي ذو الخمسة منافذ؟ شرح للزجاج البورسليكاتي العالي و PTFE
- ما هي المكونات القياسية لخلية التحليل الكهربائي ذات الحمام المائي بخمسة منافذ؟ أتقن الأداة الدقيقة للتحليل الكهروكيميائي
- ما الاحتياط العام الذي يجب اتخاذه عند التعامل مع الخلية الإلكتروليتية؟ ضمان نتائج معملية آمنة ودقيقة
- كيف يمكن تجنب التلوث أثناء التجارب باستخدام خلية التحليل الكهربائي ذات الحمام المائي بخمسة منافذ؟ أتقن بروتوكول الأعمدة الثلاثة




