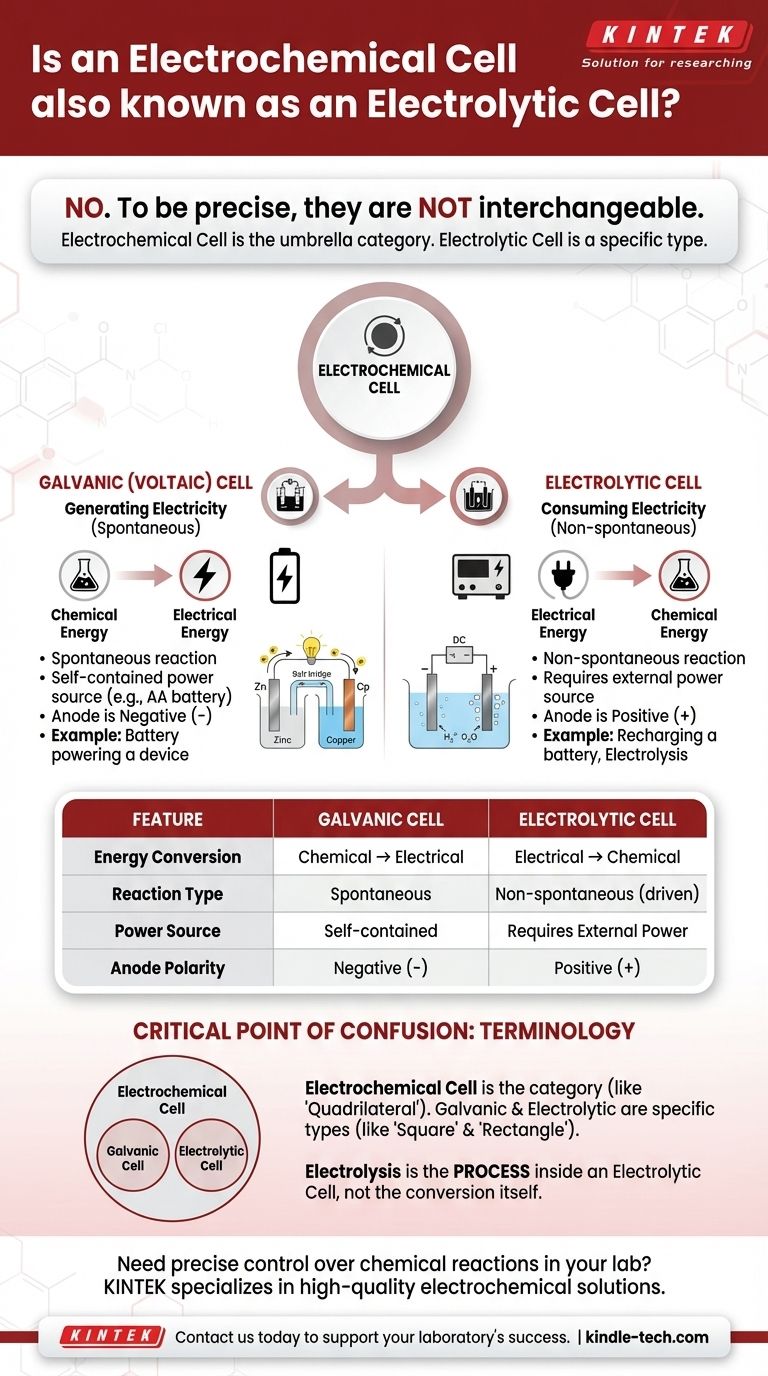
للدقة، لا. الخلية الإلكتروليتية هي نوع محدد من الخلايا الكهروكيميائية، ولكن المصطلحين ليسا مترادفين. "الخلية الكهروكيميائية" هي الفئة الواسعة والشاملة لأي جهاز يحول الطاقة الكيميائية إلى طاقة كهربائية أو العكس. الخلايا الإلكتروليتية هي النوع الذي يستخدم الطاقة الكهربائية على وجه التحديد لإحداث تفاعل كيميائي.
يكمن التمييز الأساسي في اتجاه تحويل الطاقة. تطلق الخلية الغلفانية (أو الفولتية) الطاقة تلقائيًا من تفاعل كيميائي لإنتاج الكهرباء. بينما تستهلك الخلية الإلكتروليتية الكهرباء من مصدر خارجي لإجبار تفاعل كيميائي على الحدوث.

التمييز الأساسي: تدفق الطاقة
يحدد الغرض من الخلية الكهروكيميائية تصنيفها. السؤال الأساسي الذي يجب طرحه هو ما إذا كانت الخلية تنتج الطاقة أم تستهلكها.
الخلايا الغلفانية (الفولتية): توليد الكهرباء
تستغل الخلية الغلفانية، والمعروفة أيضًا بالخلية الفولتية، تفاعلًا كيميائيًا تلقائيًا.
تميل المتفاعلات داخل الخلية بشكل طبيعي إلى التفاعل، مطلقة الطاقة في هذه العملية. يتم التقاط هذه الطاقة كتيار كهربائي.
فكر في بطارية AA قياسية في جهاز التحكم عن بعد. إنها خلية غلفانية، تحول طاقتها الكيميائية الداخلية إلى الطاقة الكهربائية اللازمة لتشغيل الجهاز.
الخلايا الإلكتروليتية: استهلاك الكهرباء
تستخدم الخلية الإلكتروليتية مصدرًا خارجيًا للطاقة الكهربائية (مثل مصدر طاقة) لدفع تفاعل كيميائي غير تلقائي.
بدون هذا المصدر الخارجي للطاقة، لن يحدث التفاعل الكيميائي من تلقاء نفسه. الكهرباء تجبر التفاعل على المضي قدمًا ضد ميله الطبيعي.
مثال شائع هو التحليل الكهربائي، مثل فصل الماء إلى غاز الهيدروجين والأكسجين. مثال آخر هو إعادة شحن بطارية الليثيوم أيون؛ فأنت تستخدم الكهرباء لعكس تفاعل التفريغ واستعادة إمكاناتها الكيميائية.
المعرفات الرئيسية لكل نوع خلية
بالإضافة إلى اتجاه تدفق الطاقة، تساعد بعض الخصائص التقنية في التمييز بين نوعي الخلايا.
دور مصدر الطاقة الخارجي
هذا هو المؤشر الأكثر وضوحًا. إذا كان الجهاز مكتفيًا ذاتيًا ويعمل كمصدر طاقة، فهو خلية غلفانية.
إذا كان الجهاز يتطلب توصيله بمصدر طاقة خارجي ليعمل، فهو خلية إلكتروليتية.
قطبية الأنود والكاثود
بينما تظل تعريفات الأنود (حيث يحدث الأكسدة) والكاثود (حيث يحدث الاختزال) ثابتة، فإن شحنتها الكهربائية (القطبية) تتبدل بين نوعي الخلايا.
في الخلية الغلفانية، يكون الأنود هو الطرف السالب (-) والكاثود هو الطرف الموجب (+).
في الخلية الإلكتروليتية، يعكس مصدر الطاقة الخارجي هذا. يصبح الأنود هو الطرف الموجب (+) والكاثود هو الطرف السالب (-).
نقطة الالتباس الحرجة: المصطلحات
ينبع المصدر الرئيسي للالتباس من الطبيعة المتداخلة ولكن المميزة للمصطلحات. يؤدي عدم التمييز بينها إلى سوء فهم أساسي.
"الخلية الكهروكيميائية" هي المصطلح الشامل
فكر في "الخلية الكهروكيميائية" كفئة عامة، مثل "الشكل الرباعي".
الخلايا الغلفانية والخلايا الإلكتروليتية هي الأنواع المحددة ضمن تلك الفئة، تمامًا مثل "المربع" و"المستطيل" هما نوعان محددان من الأشكال الرباعية. الخلية الإلكتروليتية هي دائمًا خلية كهروكيميائية، ولكن ليست كل الخلايا الكهروكيميائية إلكتروليتية.
سوء استخدام "التحليل الكهربائي"
التحليل الكهربائي هو العملية التي تستخدم الكهرباء لدفع تفاعل كيميائي. تحدث هذه العملية داخل خلية إلكتروليتية.
تذكر بعض التعريفات بشكل غير صحيح أن التحليل الكهربائي هو تحويل الطاقة الكيميائية إلى طاقة كهربائية. هذا هو عكس الحقيقة. التحليل الكهربائي يدور أساسًا حول استخدام الكهرباء لإحداث تغيير كيميائي.
التمييز الصحيح لهدفك
لتطبيق هذه المعرفة بشكل صحيح، ما عليك سوى تحديد الوظيفة الأساسية للجهاز الذي تقوم بتحليله.
- إذا كان تركيزك على جهاز يقوم بتشغيل شيء ما (جهاز تحكم عن بعد، هاتف، ساعة): فأنت تتعامل مع خلية غلفانية (فولتية)، والتي تحول الطاقة الكيميائية المخزنة إلى كهرباء.
- إذا كان تركيزك على عملية تستخدم الكهرباء لإنشاء مادة (إعادة شحن بطارية، طلاء معدن، إنتاج غاز الكلور): فأنت تتعامل مع خلية إلكتروليتية، والتي تستخدم الطاقة الكهربائية لإجبار تغيير كيميائي.
- إذا كنت تصف المجال العام أو جهازًا ذا قدرات مزدوجة (مثل بطارية قابلة لإعادة الشحن): فإن مصطلح "الخلية الكهروكيميائية" هو الخيار الصحيح والأكثر شمولاً.
فهم اتجاه تحويل الطاقة هو المفتاح لإتقان هذا المفهوم الأساسي في الكيمياء والهندسة.
جدول الملخص:
| الميزة | الخلية الغلفانية (الفولتية) | الخلية الإلكتروليتية |
|---|---|---|
| تحويل الطاقة | كيميائية ← كهربائية | كهربائية ← كيميائية |
| نوع التفاعل | تلقائي | غير تلقائي (مدفوع) |
| مصدر الطاقة | مكتفية ذاتيًا (مثل البطارية) | تتطلب مصدر طاقة خارجي |
| قطبية الأنود | طرف سالب (-) | طرف موجب (+) |
| مثال شائع | بطارية AA في جهاز تحكم عن بعد | إعادة شحن بطارية ليثيوم أيون |
هل تحتاج إلى تحكم دقيق في التفاعلات الكيميائية في مختبرك؟ فهم النوع الصحيح من الخلايا الكهروكيميائية أمر بالغ الأهمية لأبحاثك وعملياتك. في KINTEK، نحن متخصصون في توفير معدات ومواد استهلاكية عالية الجودة للمختبرات مصممة خصيصًا لتلبية احتياجاتك الكهروكيميائية المحددة. سواء كنت تعمل مع الخلايا الغلفانية لتوليد الطاقة أو الخلايا الإلكتروليتية للتخليق، فإن حلولنا تضمن الدقة والموثوقية. اتصل بنا اليوم لمناقشة كيف يمكننا دعم نجاح مختبرك!
دليل مرئي
المنتجات ذات الصلة
- خلية التحليل الكهربائي البصري مزدوجة الطبقة من النوع H مع حمام مائي
- خلية كهروكيميائية بالتحليل الكهربائي لتقييم الطلاء
- خلية كهروكيميائية كهروكيميائية كوارتز للتجارب الكهروكيميائية
- خلية التحليل الكهربائي من النوع H خلية كهروكيميائية ثلاثية
- خلية التحليل الكهربائي من PTFE خلية كهروكيميائية مقاومة للتآكل مختومة وغير مختومة
يسأل الناس أيضًا
- ما هي خلية من النوع H؟ دليل للخلايا الكهروكيميائية المقسمة لإجراء تجارب دقيقة
- ما هو الهيكل العام لخلية التحليل الكهربائي بحوض مائي بصري مزدوج الطبقة من النوع H؟ تصميم دقيق للتجارب الخاضعة للرقابة
- ما هو النظام التجريبي النموذجي المستخدم مع خلية التحليل الكهربائي ذات الحمام المائي المزدوج الطبقة؟ تحقيق تحكم كهروكيميائي دقيق
- ما هي مواصفات الفتحات القياسية لخلية التحليل الكهربائي ذات الغشاء القابل للتبديل من النوع H؟ منافذ غير متماثلة للكيمياء الكهربائية الدقيقة
- ما هي الميزات الرئيسية لخلية التحليل الكهربائي ذات الحمام المائي مزدوج الطبقة؟ حقق تحكمًا دقيقًا في درجة الحرارة لتجاربك



















