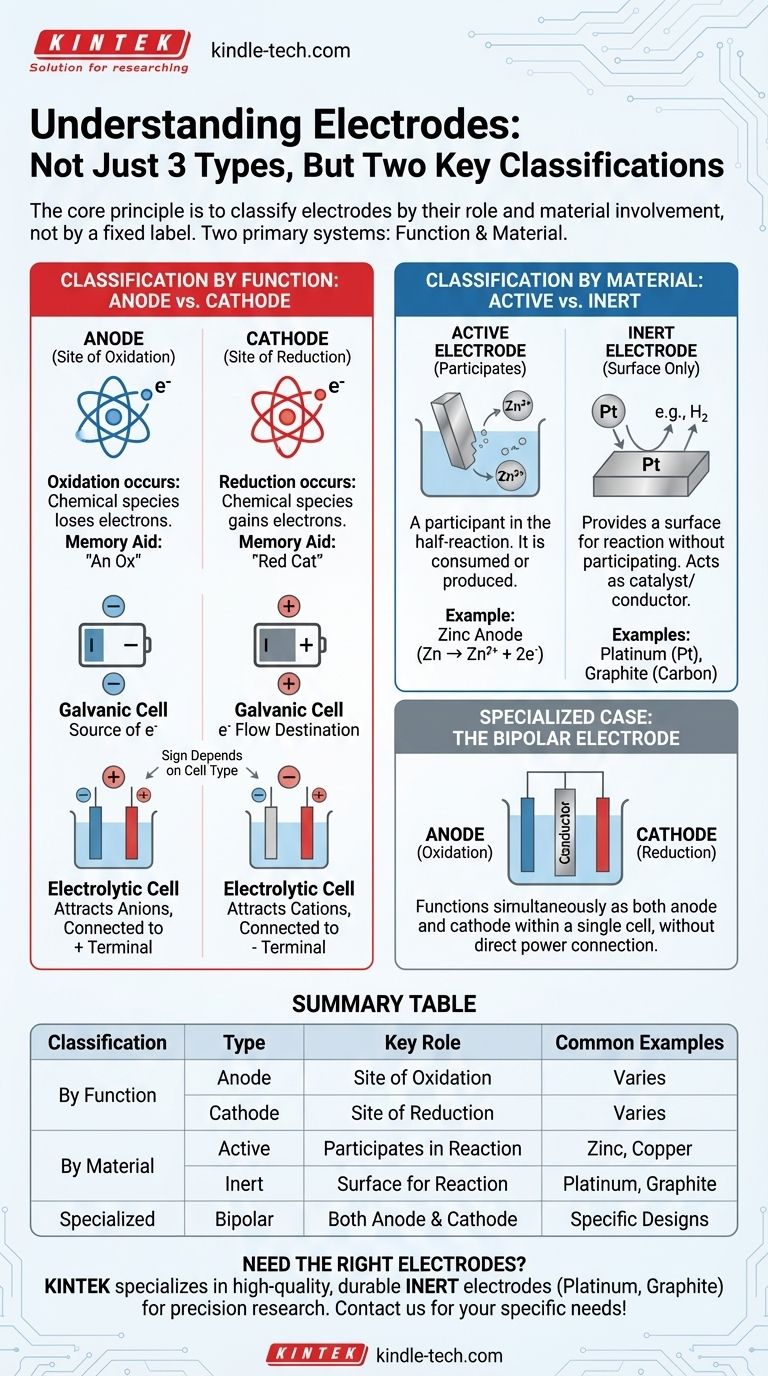
في الكيمياء الكهربائية، تُفهم الأقطاب الكهربائية بشكل أفضل ليس كأنواع ثلاثة متميزة، بل من خلال نظامي تصنيف أساسيين. يحدد النظام الأكثر جوهرية القطب الكهربائي بوظيفته: إما أنود، حيث يحدث الأكسدة، أو كاثود، حيث يحدث الاختزال. يصنف نظام ثانٍ، لا يقل أهمية، الأقطاب حسب تركيبها المادي ودورها في التفاعل: إما نشطة (تشارك في التفاعل) أو خاملة (توفر سطحًا للتفاعل).
المبدأ الأساسي هو تصنيف الأقطاب الكهربائية حسب دورها، وليس حسب تسمية ثابتة. التصنيفان الأكثر أهمية يعتمدان على الوظيفة (الأنود مقابل الكاثود) ومشاركة المادة (النشطة مقابل الخاملة). فهم هذين الزوجين هو المفتاح لتحليل أي خلية كيميائية كهربائية.

التصنيف حسب الوظيفة: الأنود مقابل الكاثود
الطريقة الأساسية لتعريف القطب الكهربائي هي من خلال العملية الكيميائية التي تحدث على سطحه. يمكن أن يتغير هذا الدور اعتمادًا على تدفق الكهرباء.
الأنود: موقع الأكسدة
يُعرّف الأنود بأنه القطب الكهربائي الذي تحدث فيه الأكسدة. هذه عملية تفقد فيها الأنواع الكيميائية الإلكترونات.
مساعدة بسيطة للذاكرة هي "أنود أكسدة" (Anode is Oxidation).
الكاثود: موقع الاختزال
الكاثود هو القطب الكهربائي الذي يحدث فيه الاختزال. هذه عملية تكتسب فيها الأنواع الكيميائية الإلكترونات.
مساعدة مماثلة للذاكرة هي "كاثود اختزال" (Reduction at the Cathode).
التمييز الحاسم: الإشارة مقابل الوظيفة
نقطة الالتباس الشائعة هي ما إذا كان الأنود والكاثود موجبين أم سالبين. هذا يعتمد كليًا على نوع الخلية الكهروكيميائية.
في الخلية الغلفانية (مثل البطارية)
تنتج الخلية الغلفانية الكهرباء من تفاعل تلقائي.
- الأنود هو الطرف السالب (-). وهو مصدر الإلكترونات من تفاعل الأكسدة.
- الكاثود هو الطرف الموجب (+). وهو المكان الذي تتدفق إليه الإلكترونات لإحداث تفاعل الاختزال.
في الخلية الإلكتروليتية (مثل الطلاء الكهربائي)
تستخدم الخلية الإلكتروليتية الكهرباء الخارجية لدفع تفاعل غير تلقائي.
- الأنود هو الطرف الموجب (+). وهو متصل بالطرف الموجب لمصدر الطاقة، ويجذب الأنيونات لتتأكسد.
- الكاثود هو الطرف السالب (-). وهو متصل بالطرف السالب لمصدر الطاقة، ويجذب الكاتيونات لتختزل.
التصنيف حسب المادة: النشطة مقابل الخاملة
يصف التصنيف الرئيسي الثاني ما إذا كانت مادة القطب الكهربائي نفسها جزءًا من التفاعل الكيميائي.
الأقطاب النشطة
القطب النشط (أو القطب المتفاعل) هو مشارك في نصف التفاعل. وهو مصنوع من مادة تتأكسد أو هي ناتج اختزال.
على سبيل المثال، في بطارية الزنك والنحاس، يذوب أنود الزنك فعليًا (يتأكسد) إلى أيونات الزنك (Zn → Zn²⁺ + 2e⁻). يستهلك القطب نفسه.
الأقطاب الخاملة
يوفر القطب الخامل ببساطة سطحًا لحدوث الأكسدة أو الاختزال دون المشاركة في التفاعل نفسه. يعمل كمحفز وموصل كهربائي.
تشمل الأقطاب الخاملة الشائعة البلاتين (Pt) والجرافيت (الكربون). تُستخدم عندما تكون الأنواع التي تتأكسد أو تختزل أيونات أو غازات في المحلول.
حالة متخصصة: القطب ثنائي القطب
القطب ثنائي القطب هو موصل متخصص يوضع في محلول إلكتروليتي ولا يتصل مباشرة بمصدر الطاقة.
يعمل في نفس الوقت كأنود على الجانب المواجه للكاثود الرئيسي وككاثود على الجانب المواجه للأنود الرئيسي، مما يتيح سلسلة من التفاعلات داخل خلية واحدة.
اتخاذ القرار الصحيح
يجب أن يوجه فهمك للأقطاب الكهربائية كيفية تحليل نظام كهروكيميائي. يتم تعريف "نوع" القطب الكهربائي من خلال سياقه داخل الخلية.
- إذا كنت تحلل بطارية (خلية غلفانية): حدد موقع الأكسدة على أنه الأنود السالب وموقع الاختزال على أنه الكاثود الموجب.
- إذا كنت تحلل عملية إلكتروليتية (مثل الطلاء الكهربائي): حدد القطب المتصل بالطرف الموجب على أنه الأنود (الأكسدة) والقطب المتصل بالطرف السالب على أنه الكاثود (الاختزال).
- عند تصميم تجربة: يجب أن تقرر ما إذا كنت بحاجة إلى قطب نشط يشارك في التفاعل أو قطب خامل لتسهيل التفاعل بين الأنواع الموجودة بالفعل في المحلول.
من خلال التركيز على الوظيفة ومشاركة المواد، يمكنك وصف وتوقع سلوك أي قطب كهربائي في أي نظام كهروكيميائي بدقة.
جدول الملخص:
| التصنيف | النوع | الدور الرئيسي | أمثلة شائعة |
|---|---|---|---|
| حسب الوظيفة | الأنود | موقع الأكسدة (يفقد الإلكترونات) | يختلف حسب نوع الخلية |
| الكاثود | موقع الاختزال (يكتسب الإلكترونات) | يختلف حسب نوع الخلية | |
| حسب المادة | نشط | يشارك في التفاعل | الزنك، النحاس |
| خامل | يوفر سطحًا للتفاعل (غير متفاعل) | البلاتين، الجرافيت | |
| متخصص | ثنائي القطب | يعمل كأنود وككاثود | يستخدم في تصاميم خلايا محددة |
هل تحتاج إلى الأقطاب الكهربائية المناسبة لتطبيقك الكهروكيميائي؟ تتخصص KINTEK في توفير معدات ومواد استهلاكية عالية الجودة للمختبرات، بما في ذلك الأقطاب الخاملة المتينة المصنوعة من البلاتين والجرافيت، والمصممة للدقة والموثوقية في مختبرك. دع خبرائنا يساعدونك في اختيار المكونات المثالية لبحثك أو عمليتك. اتصل بنا اليوم لمناقشة احتياجاتك المحددة!
دليل مرئي
المنتجات ذات الصلة
- قطب ورقة الذهب الكهروكيميائي قطب الذهب
- قطب القرص المعدني الكهربائي
- قطب مرجعي كالوميل كلوريد الفضة كبريتات الزئبق للاستخدام المخبري
- قطب قرص البلاتين الدوار للتطبيقات الكهروكيميائية
- قطب القرص الذهبي
يسأل الناس أيضًا
- كيف يؤثر اختيار مادة القطب الكهربائي على معالجة مياه الصرف الصحي؟ تحسين كفاءة استعادة الطاقة الحيوية وإزالة الطلب الكيميائي على الأكسجين
- ما هو القطب المرجعي للزئبق وكلوريد الزئبق؟ اكتشف قطب الكالوميل المشبع (SCE)
- ما هي طرق التنظيف الموصى بها والمحظورة لحامل قطب الـ PTFE؟ احمِ معدات مختبرك
- ما هو التمثيل القطبي للفضة/كلوريد الفضة؟ دليل لقطب الفضة/كلوريد الفضة المرجعي
- ما هي المواصفات المتاحة لأقطاب البلاتين الصفائحية؟ ابحث عن المقاس المثالي لاحتياجاتك الكهروكيميائية
- لماذا تعتبر أقطاب الماس المشوب بالبورون (BDD) مثالية لتحلل اللدائن الدقيقة؟ تمكين التمعدن الكامل
- لماذا تُستخدم صفيحة البلاتين (Pt) كقطب كهربائي مضاد في نظام اختبار كهروكيميائي ثلاثي الأقطاب؟
- ماذا يجب فعله إذا لم يمكن إزالة الخدوش على القطب الكهربائي باستخدام مسحوق الألومينا 1.0 ميكرومتر؟ نصائح الخبراء للإصلاح



















