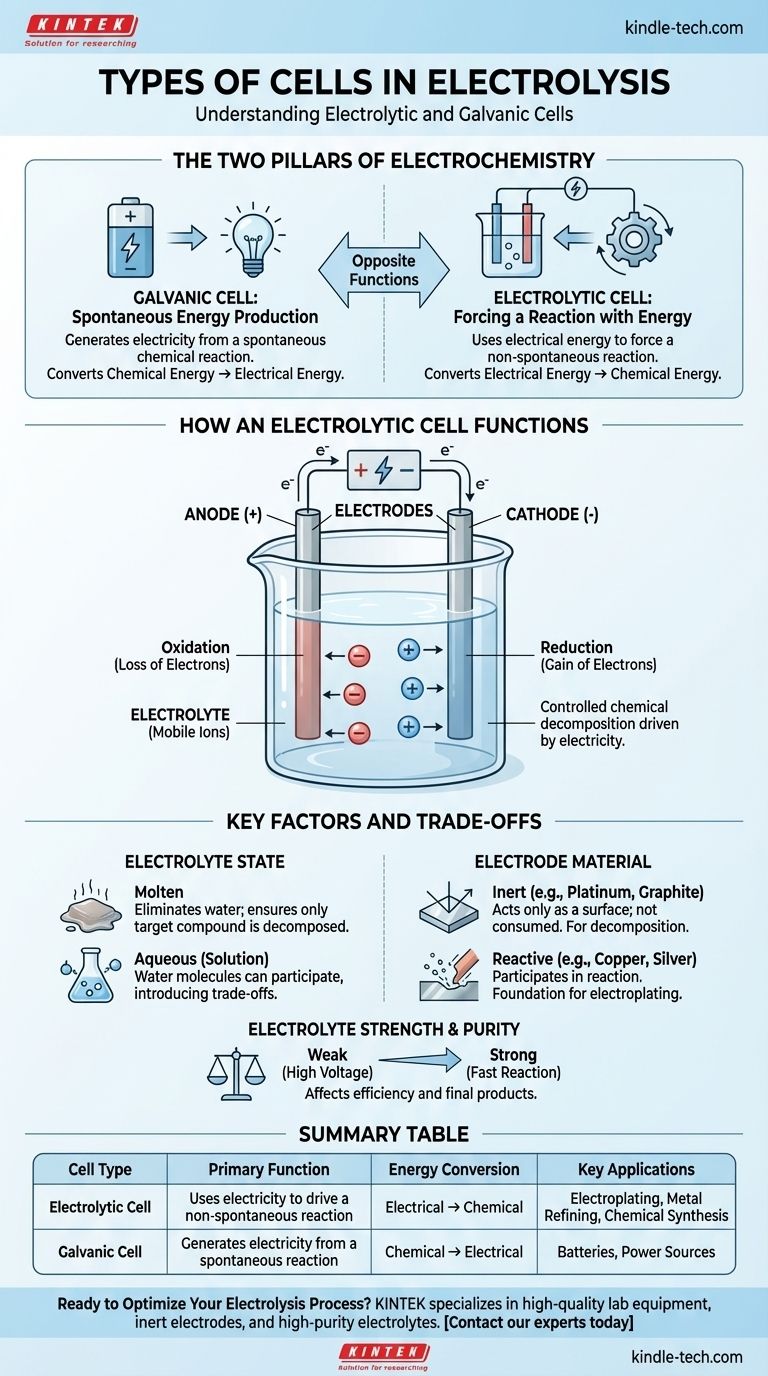
في جوهرها، يحدث التحليل الكهربائي داخل نوع معين من الخلايا الكهروكيميائية يُعرف باسم الخلية التحليلية. هذه الخلية هي أحد النوعين الأساسيين للخلايا الكهروكيميائية، والآخر هو الخلية الجلفانية. تستخدم الخلية التحليلية الطاقة الكهربائية لإجبار تفاعل كيميائي غير تلقائي على الحدوث، بينما تفعل الخلية الجلفانية العكس، حيث تولد الكهرباء من تفاعل كيميائي تلقائي.
التمييز الحاسم هو الغرض. الخلية الجلفانية (مثل البطارية) تنتج الكهرباء من تفاعل كيميائي. الخلية التحليلية تستخدم الكهرباء لدفع تفاعل كيميائي لن يحدث من تلقاء نفسه.

الركيزتان الأساسيتان للكيمياء الكهربائية
لفهم الخلية المستخدمة في التحليل الكهربائي، يجب عليك أولاً فهم نظيرتها. كلا نوعي الخلايا أساسيان للكيمياء الكهربائية، لكنهما يخدمان وظائف متعاكسة.
الخلية الجلفانية: إنتاج الطاقة التلقائي
الخلية الجلفانية هي ما نعرفه عادة باسم البطارية. تستغل تفاعلاً كيميائياً تلقائياً يرغب في الحدوث بشكل طبيعي.
مع تقدم هذا التفاعل، يطلق طاقة على شكل تيار كهربائي. إنه يحول مباشرة الطاقة الكيميائية المخزنة إلى طاقة كهربائية.
الخلية التحليلية: إجبار التفاعل بالطاقة
الخلية التحليلية هي محرك التحليل الكهربائي. وهي مصممة لجعل تفاعل كيميائي غير تلقائي يحدث عن طريق توفير طاقة خارجية.
تقوم بتطبيق تيار كهربائي من مصدر خارجي (مثل مصدر طاقة) على الخلية. هذا يجبر تحلل المادة، مما يحول بشكل فعال الطاقة الكهربائية مرة أخرى إلى طاقة كيميائية عن طريق إنشاء مواد جديدة.
كيف تعمل الخلية التحليلية
عملية التحليل الكهربائي هي تحلل كيميائي متحكم فيه مدفوع بالكهرباء. يتطلب هذا بضعة مكونات رئيسية تعمل معًا.
المكونات الأساسية
تتكون الخلية التحليلية من قطبين كهربائيين (أنود موجب وكاثود سالب) مغمورين في إلكتروليت. يتم توصيل مصدر طاقة خارجي بهذه الأقطاب الكهربائية، مما يخلق دائرة.
دور الإلكتروليت
الإلكتروليت هو المادة التي سيتم تفكيكها. وعادة ما يكون مركبًا أيونيًا، إما في حالة منصهرة أو مذابًا في محلول (مائي).
يجب أن تحتوي هذه المادة على أيونات متحركة حرة الحركة وقادرة على حمل الشحنة. الإلكتروليتات هي عمومًا محاليل من الأحماض أو القواعد أو الأملاح.
وظيفة الأقطاب الكهربائية
الأقطاب الكهربائية هي الموصلات التي تمر من خلالها الكهرباء إلى الإلكتروليت وتخرج منه.
- الأنود: القطب الموجب. يجذب الأيونات السالبة (الأنيونات)، حيث يحدث الأكسدة (فقدان الإلكترونات).
- الكاثود: القطب السالب. يجذب الأيونات الموجبة (الكاتيونات)، حيث يحدث الاختزال (اكتساب الإلكترونات).
مصدر الطاقة الخارجي هو ما يحافظ على هذا الفصل بين الشحنات ويدفع العملية بأكملها.
فهم العوامل الرئيسية والمقايضات
نتيجة التحليل الكهربائي ليست تلقائية. تعتمد المنتجات المحددة التي تنشئها بالكامل على المواد والظروف التي تختارها.
حالة الإلكتروليت: منصهر مقابل مائي
تعد حالة الإلكتروليت قرارًا حاسمًا. إذا استخدمت محلولًا مائيًا (مذابًا في الماء)، يمكن لجزيئات الماء نفسها المشاركة في التفاعل.
هذا يقدم مفاضلة، حيث قد تقسم الكهرباء الماء بدلاً من المركب المذاب، اعتمادًا على التفاعل الأسهل للدفع. استخدام إلكتروليت منصهر يزيل الماء من المعادلة، مما يضمن تحلل المركب المستهدف فقط.
مادة القطب: خاملة مقابل تفاعلية
يمكن أن تكون الأقطاب الكهربائية مشاركين سلبيين أو لاعبين نشطين في التفاعل.
- الأقطاب الخاملة (مثل البلاتين، الجرافيت): تعمل هذه فقط كسطح لحدوث التفاعل. لا تستهلك وتستخدم عندما تريد تحلل الإلكتروليت نفسه، كما هو الحال عند تقسيم الماء إلى هيدروجين وأكسجين.
- الأقطاب التفاعلية (مثل النحاس، الفضة): يمكن أن تذوب أو تشارك في التفاعل الكيميائي. هذا هو المبدأ وراء الطلاء الكهربائي، حيث يذوب الأنود وتترسب أيوناته المعدنية على الجسم عند الكاثود.
قوة ونقاء الإلكتروليت
تتأثر كفاءة التحليل الكهربائي أيضًا بالإلكتروليت. الإلكتروليتات القوية، التي تتفكك تمامًا إلى أيونات، توصل الكهرباء جيدًا وتسمح بتفاعل أسرع.
تتطلب الإلكتروليتات الضعيفة مزيدًا من الطاقة (جهدًا أعلى) لبدء التفاعل واستمراره. يمكن أن يؤدي وجود عوامل مؤكسدة أو مختزلة أخرى في الإلكتروليت أيضًا إلى تغيير المنتجات النهائية.
تطبيق هذا على هدفك
يسمح لك فهم وظيفة الخلية التحليلية بالتحكم في التفاعلات الكيميائية لأغراض صناعية وعلمية محددة.
- إذا كان تركيزك الأساسي هو إنتاج مادة نقية: اختر قطبًا خاملًا وإلكتروليتًا عالي النقاء (منصهرًا أو مائيًا) لضمان تحلل المركب المستهدف، كما هو الحال عند إنتاج الألومنيوم من خام البوكسيت.
- إذا كان تركيزك الأساسي هو طلاء أو تنقية معدن: استخدم أنودًا تفاعليًا مصنوعًا من مادة الطلاء وإلكتروليتًا يحتوي على أيونات نفس المعدن. هذا هو أساس الطلاء الكهربائي والتنقية الكهربائية.
- إذا كان تركيزك الأساسي هو توليد الكهرباء: فأنت بحاجة إلى خلية جلفانية، وليست تحليلية، حيث أن وظيفتها هي إطلاق الطاقة من تفاعل تلقائي.
في النهاية، يوفر التحليل الكهربائي طريقة قوية لاستخدام الطاقة الكهربائية للتحكم بدقة في التغير الكيميائي ودفعه.
جدول ملخص:
| نوع الخلية | الوظيفة الأساسية | تحويل الطاقة | التطبيقات الرئيسية |
|---|---|---|---|
| الخلية التحليلية | تستخدم الكهرباء لدفع تفاعل غير تلقائي | كهربائية → كيميائية | الطلاء الكهربائي، تكرير المعادن، التخليق الكيميائي |
| الخلية الجلفانية | تولد الكهرباء من تفاعل تلقائي | كيميائية → كهربائية | البطاريات، مصادر الطاقة |
هل أنت مستعد لتحسين عملية التحليل الكهربائي الخاصة بك؟
يعد فهم نوع الخلية والمكونات الصحيحة أمرًا بالغ الأهمية للطلاء الكهربائي الفعال، وتكرير المعادن، أو التخليق الكيميائي. تتخصص KINTEK في توفير معدات ومواد استهلاكية عالية الجودة للمختبرات، بما في ذلك الأقطاب الخاملة والإلكتروليتات عالية النقاء، لضمان دقة وفعالية عمليات التحليل الكهربائي الخاصة بك.
اتصل بخبرائنا اليوم لمناقشة تطبيقك المحدد واكتشاف كيف يمكن لحلولنا تعزيز قدرات ونتائج مختبرك.
دليل مرئي
المنتجات ذات الصلة
- خلية كهروكيميائية تحليل كهربائي بخمسة منافذ
- خلية كهروكيميائية كهروكيميائية كوارتز للتجارب الكهروكيميائية
- خلية التحليل الكهربائي البصري مزدوجة الطبقة من النوع H مع حمام مائي
- خلية التحليل الكهربائي من النوع H خلية كهروكيميائية ثلاثية
- خلية التحليل الكهربائي من PTFE خلية كهروكيميائية مقاومة للتآكل مختومة وغير مختومة
يسأل الناس أيضًا
- ما الفرق بين تدفق الإلكترونات في الخلية الجلفانية والخلية الإلكتروليتية؟ أتقن مصدر الطاقة
- ما هي فائدة استخدام نظام خلية كهروكيميائية بثلاثة أقطاب لتقييم أغشية TiN؟ تحقيق الدقة
- لماذا يتم اختيار البولي إيثر إيثر كيتون (PEEK) لخلايا الكيمياء الكهربائية XAS؟ ضمان الخمول الكيميائي والدقة
- كيف تساعد منحنيات الاستقطاب والتحليل الطيفي للممانعة الكهروكيميائية (EIS) في تقييم تأثير عناصر التطعيم على السبائك عالية الإنتروبيا؟ عزز أبحاث السبائك الخاصة بك
- ما هي الوظائف الأساسية للحشيات المصنوعة من السيليكون المخصصة في خلية التدفق الكهروكيميائي؟ مفتاح التحليل الدقيق
- ما هي الوظيفة الأساسية للخلايا الكهروضوئية في الاستخلاص الحيوي؟ استعادة المعادن عالية النقاء مع تحكم دقيق
- ما هي المعلمات والظواهر التي يجب مراقبتها أثناء تجربة باستخدام الخلية الإلكتروليتية؟ ضمان التحليل الكهربائي الآمن والفعال
- ما هي الخلية الكهروكيميائية الضوئية من النوع H؟ دليل لعزل ودراسة التفاعلات التي تحركها الضوء



















