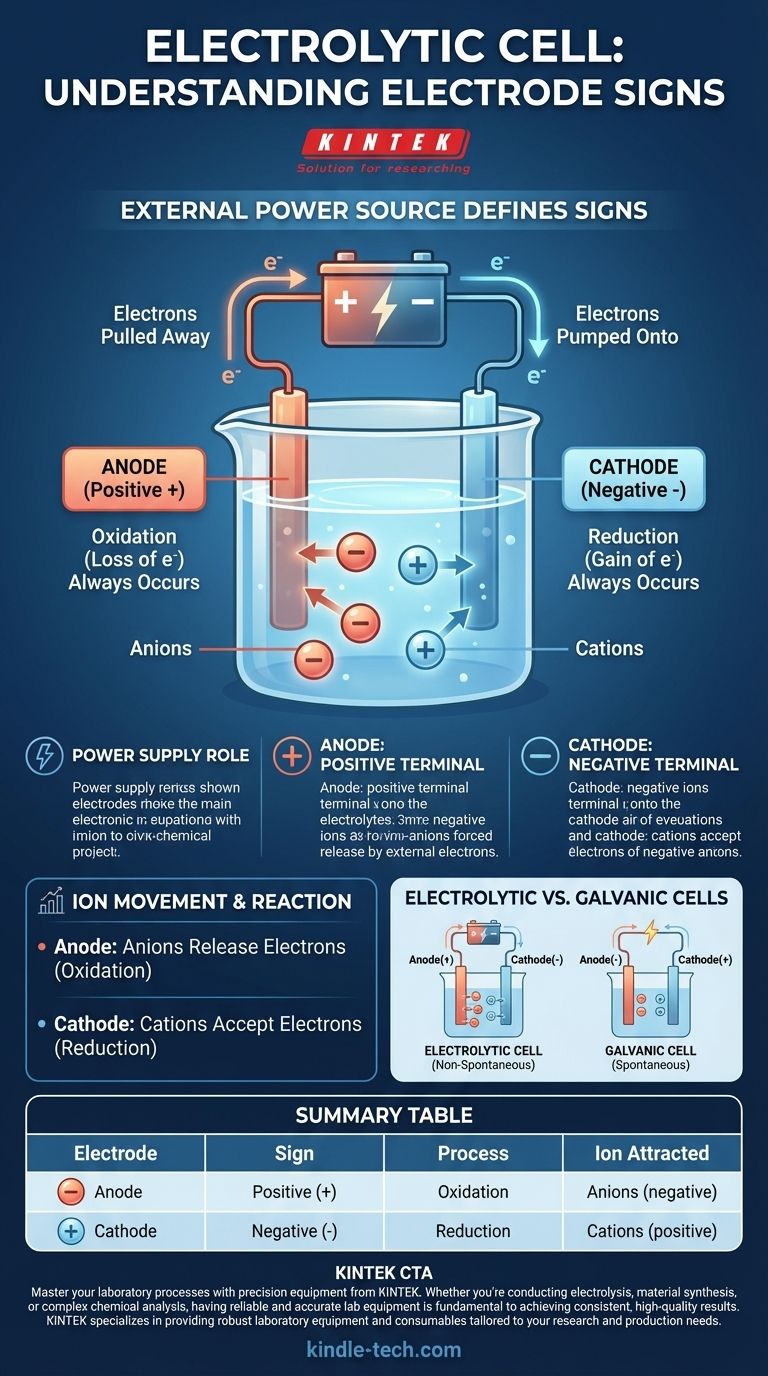
في الخلية الإلكتروليتية، يتم تحديد اصطلاح الإشارة بواسطة مصدر الطاقة الخارجي. يتم تعيين إشارة موجبة (+) للأنود، ويتم تعيين إشارة سالبة (-) للكاثود. وذلك لأن جهدًا خارجيًا يُطبق لدفع تفاعل كيميائي لن يحدث تلقائيًا.
مفتاح فهم الخلية الإلكتروليتية هو إدراك أنها ليست نظامًا مكتفيًا ذاتيًا. إشارات أقطابها تُمليها بالكامل وحدة تزويد الطاقة الخارجية التي تتصل بها، مما يجبر حدوث تغيير كيميائي غير تلقائي.

لماذا يحدد مصدر الطاقة الخارجي الإشارات
تستخدم الخلية الإلكتروليتية الطاقة الكهربائية لإنشاء طاقة كيميائية. تتطلب هذه العملية، المعروفة بالتحليل الكهربائي، قوة خارجية — بطارية أو مصدر طاقة تيار مستمر — لبدء التفاعل واستمراره.
دور مصدر الطاقة
يعمل مصدر الطاقة "كمضخة إلكترونات". يسحب الإلكترونات من قطب ويدفعها إلى الآخر، مما يخلق خللاً في الشحنة يجبر الأيونات في محلول الإلكتروليت على التفاعل.
الأنود متصل بالطرف الموجب
يتم توصيل الطرف الموجب لمصدر الطاقة الخارجي بالأنود. يسحب هذا الطرف بنشاط الإلكترونات بعيدًا عن الأنود، تاركًا إياه بشحنة موجبة صافية.
الكاثود متصل بالطرف السالب
على العكس من ذلك، يتم توصيل الطرف السالب لمصدر الطاقة بالكاثود. يضخ هذا الطرف بنشاط الإلكترونات إلى الكاثود، مما يمنحه فائضًا من الإلكترونات وشحنة سالبة صافية.
كيف تخلق حركة الأيونات التفاعل
الشحنات المفروضة على الأقطاب هي ما يجذب الأيونات المذابة في الإلكتروليت، مما يجبرها على التحرك والتفاعل. تظل التعريفات الأساسية للأكسدة والاختزال ثابتة.
الأنود: موقع الأكسدة (دائمًا)
بغض النظر عن نوع الخلية، تحدث الأكسدة (فقدان الإلكترونات) دائمًا عند الأنود. في الخلية الإلكتروليتية، تنجذب الأيونات سالبة الشحنة (الأنيونات) إلى الأنود الموجب، حيث تطلق إلكتروناتها الزائدة وتتأكسد.
الكاثود: موقع الاختزال (دائمًا)
وبالمثل، يحدث الاختزال (اكتساب الإلكترونات) دائمًا عند الكاثود. تنجذب الأيونات موجبة الشحنة (الكاتيونات) في المحلول إلى الكاثود السالب، حيث تقبل الإلكترونات الزائدة وتختزل.
تمييز حاسم: الخلايا الإلكتروليتية مقابل الخلايا الغلفانية
ينشأ مصدر رئيسي للارتباك عند مقارنة الخلايا الإلكتروليتية بالخلايا الغلفانية (أو الفولتية)، مثل البطارية القياسية. اصطلاحات إشاراتها متضادة لسبب محدد للغاية.
التفاعلات التلقائية مقابل غير التلقائية
تعتمد الخلية الغلفانية على تفاعل كيميائي تلقائي ينتج طاقة كهربائية. هنا، الأنود هو المصدر الطبيعي للإلكترونات، مما يجعله سالبًا، والكاثود هو حيث تستهلك، مما يجعله موجبًا.
تُجري الخلية الإلكتروليتية تفاعلًا غير تلقائي يستهلك الطاقة الكهربائية. يعكس مصدر الطاقة الخارجي القطبية الطبيعية لإجبار التفاعل على المضي قدمًا.
الثابت العالمي
على الرغم من اختلاف الإشارات، فإن العمليات الأساسية هي نفسها في كلا النوعين من الخلايا:
- الأنود هو دائمًا موقع الأكسدة.
- الكاثود هو دائمًا موقع الاختزال.
كيف تتذكر الإشارات
استخدم هذه المبادئ للحفاظ على الاصطلاحات واضحة بناءً على هدفك.
- إذا كان تركيزك الأساسي هو تحديد الأطراف: تذكر أنه في الخلية الإلكتروليتية، تتطابق الإشارات مع مصدر الطاقة الخارجي: الأنود موجب و الكاثود سالب.
- إذا كان تركيزك الأساسي هو تتبع الأيونات: اتبع القاعدة البسيطة للشحنات المتضادة: الأنيونات السالبة تتحرك نحو الأنود الموجب، والكاتيونات الموجبة تتحرك نحو الكاثود السالب.
- إذا كان تركيزك الأساسي هو التمييز بين أنواع الخلايا: اربط "الإلكتروليتية" بمصدر طاقة خارجي يفرض شحنة موجبة على الأنود وشحنة سالبة على الكاثود لدفع التفاعل.
في النهاية، إشارات الخلية الإلكتروليتية هي نتيجة مباشرة لمصدر طاقة خارجي يتجاوز التدفق الطبيعي للتفاعل الكيميائي.
جدول الملخص:
| القطب | الإشارة | العملية | الأيون المنجذب |
|---|---|---|---|
| الأنود | موجب (+) | الأكسدة | الأنيونات (سالبة) |
| الكاثود | سالب (-) | الاختزال | الكاتيونات (موجبة) |
أتقن عملياتك المخبرية باستخدام معدات دقيقة من KINTEK.
سواء كنت تجري التحليل الكهربائي، أو تخليق المواد، أو التحليل الكيميائي المعقد، فإن امتلاك معدات معملية موثوقة ودقيقة أمر أساسي لتحقيق نتائج متسقة وعالية الجودة. تتخصص KINTEK في توفير معدات ومواد استهلاكية معملية قوية مصممة خصيصًا لتلبية احتياجات البحث والإنتاج لديك.
تواصل مع خبرائنا اليوم لمناقشة كيف يمكن لحلولنا أن تدعم ابتكاراتك وتعزز كفاءة سير عمل مختبرك.
دليل مرئي
المنتجات ذات الصلة
- خلية كهروكيميائية تحليل كهربائي بخمسة منافذ
- خلية تحليل كهربائي مزدوجة الطبقة بخمسة منافذ وحمام مائي
- خلية تحليل كهربائي مزدوجة الطبقة بحمام مائي
- خلية كهروكيميائية كهروكيميائية كوارتز للتجارب الكهروكيميائية
- خلية كهروكيميائية بوعاء مائي بصري
يسأل الناس أيضًا
- ما هي إجراءات التخزين الصحيحة للخلية الإلكتروليتية متعددة الوظائف؟ احمِ استثمارك واضمن دقة البيانات
- ما هي المكونات القياسية لخلية التحليل الكهربائي ذات الحمام المائي بخمسة منافذ؟ أتقن الأداة الدقيقة للتحليل الكهروكيميائي
- من أي مادة صُنِعَ خزان التحليل الكهربائي ذو الخمسة منافذ؟ شرح للزجاج البورسليكاتي العالي و PTFE
- ما هي الطريقة الصحيحة للتعامل مع خلية تحليل كهربائي بحوض مائي خماسي المنافذ؟ ضمان تجارب كيميائية كهربائية دقيقة وآمنة
- كيف يمكن منع التسربات عند استخدام خلية تحليل كهربائي بحوض مائي خماسي المنافذ؟ ضمان إعداد كيميائي كهربائي موثوق وآمن



















