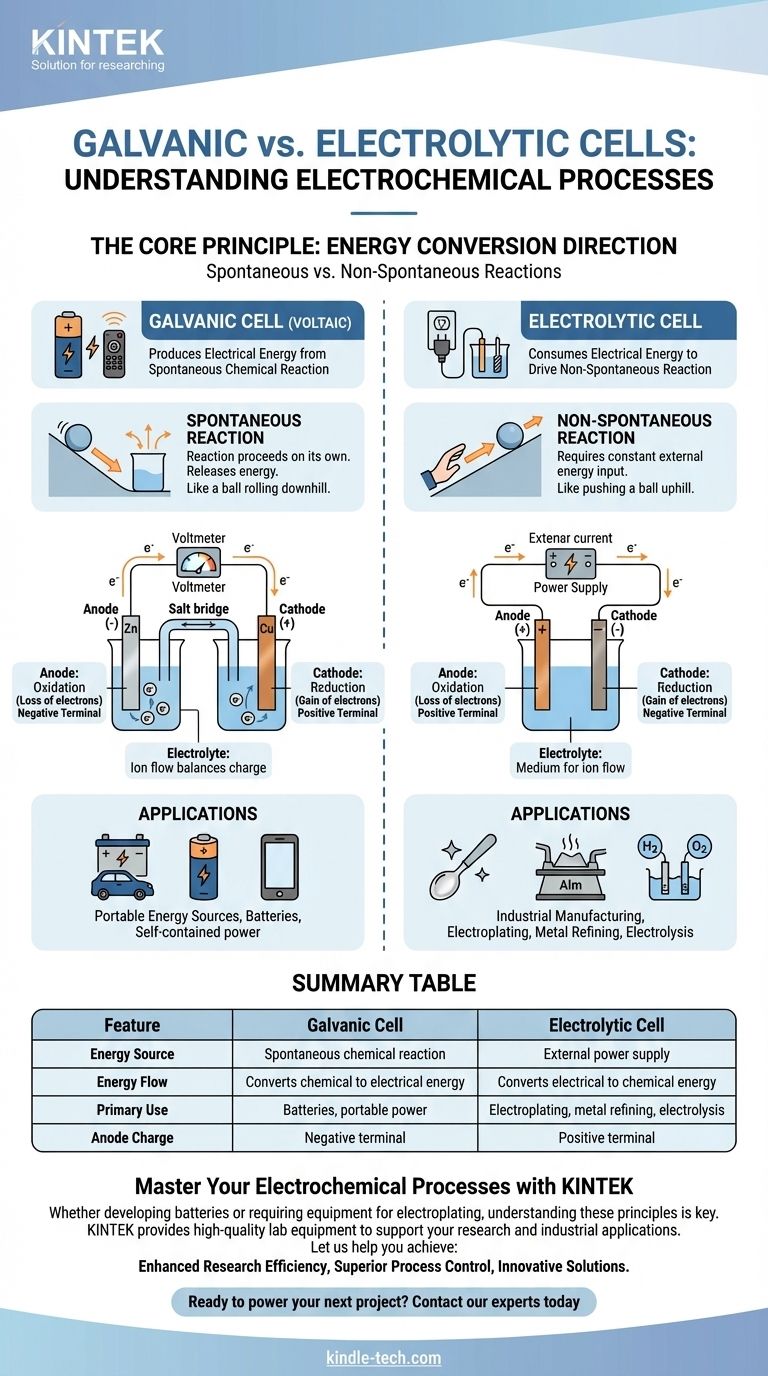
في جوهرها، الخلية الغلفانية هي خلية كهروكيميائية تنتج طاقة كهربائية من تفاعل كيميائي تلقائي، مثل بطارية تشغل جهاز التحكم عن بعد الخاص بك. في المقابل، تستهلك الخلية الإلكتروليتية طاقة كهربائية من مصدر خارجي لإجبار تفاعل كيميائي غير تلقائي على الحدوث، وهي عملية تستخدم في طلاء المعادن وتنقيته.
التمييز الأساسي هو اتجاه تحويل الطاقة. تحول الخلية الغلفانية الطاقة الكيميائية المخزنة إلى طاقة كهربائية، بينما تحول الخلية الإلكتروليتية الطاقة الكهربائية الخارجية إلى طاقة كيميائية.

المبدأ الأساسي: تفاعلات تلقائية مقابل تفاعلات غير تلقائية
يتم تحديد سلوك أي خلية كهروكيميائية من خلال الميل الطبيعي لتفاعلها الكيميائي. هذا الميل هو المفتاح لفهم سبب إنتاج خلية واحدة للطاقة ويتطلبها الأخرى.
كيف تولد الخلايا الغلفانية الطاقة
تُبنى الخلية الغلفانية، والمعروفة أيضًا باسم الخلية الفولتية، حول تفاعل كيميائي تلقائي.
هذا تفاعل يحدث من تلقاء نفسه دون تدخل خارجي، ويطلق الطاقة في هذه العملية. فكر في الأمر ككرة تتدحرج إلى أسفل التل.
يؤدي إطلاق الطاقة هذا إلى دفع الإلكترونات عبر دائرة خارجية، مما يخلق تيارًا كهربائيًا. هذا هو المبدأ وراء جميع البطاريات غير القابلة لإعادة الشحن والبطاريات القابلة لإعادة الشحن أثناء التفريغ.
كيف تستهلك الخلايا الإلكتروليتية الطاقة
تدفع الخلية الإلكتروليتية تفاعلًا كيميائيًا غير تلقائي.
هذا تفاعل لن يحدث من تلقاء نفسه ويتطلب إدخالًا مستمرًا للطاقة للمتابعة. إنه يعادل دفع كرة إلى أعلى التل.
يوفر مصدر طاقة خارجي، مثل مزود الطاقة، الجهد اللازم لإجبار الإلكترونات على التدفق عكس اتجاهها الطبيعي، مما يدفع التغيير الكيميائي المطلوب.
نظرة عملية على وظيفة الخلية
على الرغم من أن أغراضها متعاكسة، إلا أن كلا الخليتين تشتركان في مكونات شائعة تعمل بموجب نفس القواعد الأساسية للكيمياء، ولكن مع اختلاف حاسم في القطبية.
الأنود والكاثود: حكاية قطبين
في كلا نوعي الخلايا، يكون الأنود دائمًا هو المكان الذي يحدث فيه الأكسدة (فقدان الإلكترونات) ويكون الكاثود هو المكان الذي تحدث فيه الاختزال (اكتساب الإلكترونات).
ومع ذلك، يتم عكس شحنتهما الكهربائية. في الخلية الغلفانية، يكون الأنود هو القطب السالب لأن التفاعل التلقائي يطلق الإلكترونات منه.
في الخلية الإلكتروليتية، يكون الأنود هو القطب الموجب لأن مصدر الطاقة الخارجي يسحب الإلكترونات بعيدًا عنه، مما يجبر الأكسدة على الحدوث.
دور الإلكتروليت
تحتوي كلتا الخليتين على إلكتروليت، عادةً محلول يحتوي على أيونات.
هذا الوسط ضروري لإكمال الدائرة الكهربائية. بينما تتدفق الإلكترونات عبر السلك الخارجي، تتدفق الأيونات عبر الإلكتروليت لموازنة الشحنة عند الأقطاب الكهربائية.
فهم التطبيقات والمقايضات
تؤدي الوظائف المتعارضة لهذه الخلايا إلى تطبيقات واقعية مختلفة بشكل كبير وقيود متأصلة.
الخلايا الغلفانية: مصادر طاقة محمولة
الاستخدام الأساسي للخلايا الغلفانية هو العمل كبطاريات. إنها توفر مصدرًا محمولًا ومكتفيًا ذاتيًا للطاقة الكهربائية.
المقايضة هي أن المتفاعلات الكيميائية داخل الخلية محدودة. بمجرد استهلاكها، تتوقف الخلية عن إنتاج الطاقة ويجب التخلص منها أو إعادة شحنها.
الخلايا الإلكتروليتية: التصنيع الصناعي والتنقية
الخلايا الإلكتروليتية هي محركات الصناعة، وتستخدم في العمليات التي تكون مستحيلة كيميائيًا أو غير فعالة بطريقة أخرى.
تشمل التطبيقات الرئيسية الطلاء الكهربائي (طلاء معدن بآخر)، وتكرير المعادن مثل الألومنيوم والنحاس، والتحليل الكهربائي للماء لإنتاج الهيدروجين والأكسجين. يكمن القيد الرئيسي لها في الحاجة إلى إمداد كبير ومستمر من الطاقة الكهربائية الخارجية.
كيفية تطبيق هذه المعرفة
يعتمد اختيارك بين هذه المفاهيم كليًا على ما إذا كان هدفك هو توليد الطاقة أو إحداث تغيير كيميائي.
- إذا كان تركيزك الأساسي هو توليد الكهرباء من تفاعل كيميائي: فأنت تعمل بمبادئ الخلية الغلفانية، كما هو الحال عند تصميم بطارية أو فهمها.
- إذا كان تركيزك الأساسي هو استخدام الكهرباء لإنشاء منتج أو تكرير مادة: فأنت تعمل بمبادئ الخلية الإلكتروليتية، الشائعة في التصنيع الكيميائي وعلم الفلزات.
يعد فهم هذا التقسيم الخطوة الأولى نحو إتقان التطبيق العملي للكيمياء الكهربائية.
جدول ملخص:
| الميزة | الخلية الغلفانية | الخلية الإلكتروليتية |
|---|---|---|
| مصدر الطاقة | تفاعل كيميائي تلقائي | مزود طاقة خارجي |
| تدفق الطاقة | تحويل الطاقة الكيميائية إلى كهربائية | تحويل الطاقة الكهربائية إلى كيميائية |
| الاستخدام الأساسي | البطاريات، الطاقة المحمولة | الطلاء الكهربائي، تكرير المعادن، التحليل الكهربائي |
| شحنة الأنود | القطب السالب | القطب الموجب |
أتقن عملياتك الكهروكيميائية مع KINTEK
سواء كنت تقوم بتطوير تقنيات بطاريات جديدة أو تحتاج إلى معدات دقيقة للطلاء الكهربائي وتنقية المعادن، فإن فهم هذه المبادئ الكهروكيميائية الأساسية هو مجرد البداية. تتخصص KINTEK في توفير معدات ومواد استهلاكية معملية عالية الجودة لدعم أبحاثك وتطبيقاتك الصناعية.
دعنا نساعدك في تحقيق:
- كفاءة بحثية معززة: باستخدام معدات موثوقة لاختبار وتطوير كل من الأنظمة الغلفانية والإلكتروليتية.
- تحكم فائق في العمليات: للحصول على نتائج متسقة في الطلاء الكهربائي والتحليل الكهربائي وتخليق المواد.
- حلول مبتكرة: مصممة خصيصًا لتلبية الاحتياجات الفريدة للمختبرات ومرافق الإنتاج.
هل أنت مستعد لتشغيل مشروعك القادم؟ اتصل بخبرائنا اليوم للعثور على الحل الأمثل لاحتياجات مختبرك!
دليل مرئي
المنتجات ذات الصلة
- خلية التحليل الكهربائي البصري مزدوجة الطبقة من النوع H مع حمام مائي
- خلية كهروكيميائية بالتحليل الكهربائي لتقييم الطلاء
- خلية كهروكيميائية كهروكيميائية كوارتز للتجارب الكهروكيميائية
- خلية التحليل الكهربائي من النوع H خلية كهروكيميائية ثلاثية
- خلية التحليل الكهربائي من PTFE خلية كهروكيميائية مقاومة للتآكل مختومة وغير مختومة
يسأل الناس أيضًا
- ما هي الأحجام وتكوينات الفتحات النموذجية لخلية تحليل كهربائي مزدوجة الطبقة بحمام مائي؟ حسّن إعدادك الكهروكيميائي
- ما هو النظام التجريبي النموذجي المستخدم مع خلية التحليل الكهربائي ذات الحمام المائي المزدوج الطبقة؟ تحقيق تحكم كهروكيميائي دقيق
- ما هو الهيكل العام لخلية التحليل الكهربائي بحوض مائي بصري مزدوج الطبقة من النوع H؟ تصميم دقيق للتجارب الخاضعة للرقابة
- ما هي خلية من النوع H؟ دليل للخلايا الكهروكيميائية المقسمة لإجراء تجارب دقيقة
- ما هو الغرض من الهيكل مزدوج الطبقات في خلية التحليل الكهربائي من النوع H؟ تحقيق تحكم دقيق في درجة الحرارة



















