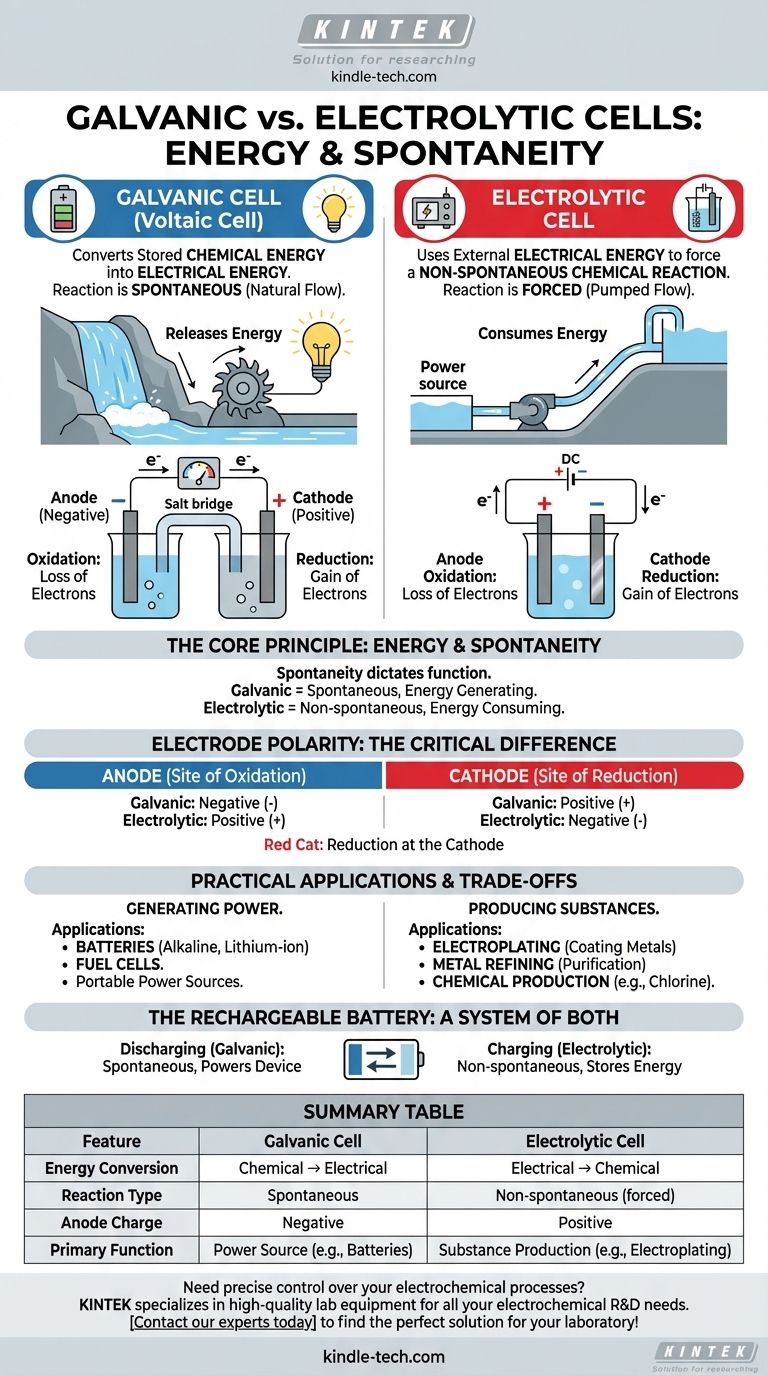
في جوهرها، يكمن الاختلاف بين الخلية الغلفانية (أو الفولتية) والخلية التحليلية في اتجاه تحويل الطاقة. تحول الخلية الغلفانية (أو الفولتية) الطاقة الكيميائية المخزنة إلى طاقة كهربائية من خلال تفاعل تلقائي، مثل بطارية تشغل جهازًا. في المقابل، تستخدم الخلية التحليلية طاقة كهربائية خارجية لإجبار تفاعل كيميائي غير تلقائي على الحدوث، كما هو الحال في طلاء المعادن.
التمييز الأساسي يكمن في العفوية. تستغل الخلايا الغلفانية تفاعلًا كيميائيًا يريد أن يحدث من تلقاء نفسه، مطلقًا الطاقة على شكل كهرباء. تستخدم الخلايا التحليلية الكهرباء لإجبار تفاعل كيميائي لا يحدث لولا ذلك.

المبدأ الأساسي: الطاقة والعفوية
يخضع سلوك أي خلية كهروكيميائية لما إذا كان تفاعل الأكسدة والاختزال الداخلي تلقائيًا أم غير تلقائي. هذا المبدأ الوحيد يحدد وظيفتها وبنيتها.
الخلايا الغلفانية: توليد الطاقة
في الخلية الغلفانية، يكون التفاعل الكيميائي تلقائيًا. هذا يعني أن المتفاعلات لديها طاقة كامنة أعلى من النواتج، ويحدث التفاعل بشكل طبيعي، مطلقًا الطاقة.
هذه الطاقة المتحررة تدفع الإلكترونات عبر دائرة خارجية، مما يخلق تيارًا كهربائيًا. فكر في الأمر مثل الشلال: يتدفق الماء بشكل طبيعي إلى الأسفل، ويمكننا وضع توربين في مساره لتوليد الكهرباء.
الخلايا التحليلية: استهلاك الطاقة
في الخلية التحليلية، يكون التفاعل الكيميائي المطلوب غير تلقائي. تكون النواتج في حالة طاقة أعلى من المتفاعلات، لذلك لن يحدث التفاعل من تلقاء نفسه.
لجعله يحدث، يجب علينا تزويد طاقة من مصدر طاقة خارجي (مثل بطارية أو مزود طاقة). يجبر هذا الجهد الخارجي الإلكترونات على التحرك عكس اتجاهها الطبيعي، مما يدفع التفاعل. هذا يشبه استخدام مضخة لتحريك الماء إلى الأعلى.
كيف يحدد هذا المبدأ مكونات الخلية
على الرغم من أن التعريفات الأساسية للأنود والكاثود تظل كما هي، إلا أن شحنتها (القطبية) تنعكس بين نوعي الخلية. هذه نقطة شائعة للالتباس ولكنها نتيجة مباشرة للعفوية.
الأنود: دائمًا موقع الأكسدة
في كلا نوعي الخلايا، يُعرَّف الأنود بأنه القطب الذي تحدث فيه الأكسدة (فقدان الإلكترونات).
الكاثود: دائمًا موقع الاختزال
وبالمثل، في كلا نوعي الخلايا، الكاثود هو القطب الذي يحدث فيه الاختزال (اكتساب الإلكترونات). هناك تذكير بسيط هو "الكاثود اختزال" (Reduction at the Cathode).
الفرق الحاسم: قطبية الأقطاب الكهربائية
في الخلية الغلفانية، تؤدي الأكسدة التلقائية عند الأنود إلى إطلاق تدفق للإلكترونات. هذا التراكم للشحنة السالبة يجعل الأنود سالبًا والكاثود، الذي يجذب الإلكترونات، موجبًا.
في الخلية التحليلية، يتم استخدام مصدر طاقة خارجي. يتم توصيل طرفه الموجب بالأنود، حيث يسحب الإلكترونات قسرًا بعيدًا عن الأنواع الكيميائية، مسببًا الأكسدة. لذلك، يكون الأنود موجبًا والكاثود سالبًا.
التطبيقات العملية والمقايضات
يؤدي الاختلاف بين توليد الطاقة واستهلاكها إلى تطبيقات مختلفة تمامًا في العالم الحقيقي لهذين النوعين من الخلايا.
الخلايا الغلفانية عمليًا: الطاقة المحمولة
صُممت الخلايا الغلفانية لتكون مصادر للطاقة. تطبيقها الأساسي هو في البطاريات، بدءًا من بطاريات القلويات للاستخدام الواحد إلى خلايا الليثيوم أيون القابلة لإعادة الشحن في هاتفك وسيارتك.
خلايا الوقود هي نوع آخر من الخلايا الغلفانية، تولد الكهرباء باستمرار طالما تم تزويدها بالوقود (مثل الهيدروجين).
الخلايا التحليلية عمليًا: التصنيع والتنقية
الخلايا التحليلية هي آلات صناعية قوية تستخدم لإنتاج المواد. تشمل التطبيقات الرئيسية الطلاء الكهربائي (تغطية جسم بطبقة معدنية رقيقة) وتنقية المعادن مثل النحاس والألمنيوم.
كما أنها ضرورية لإنتاج مواد كيميائية صناعية رئيسية، مثل غاز الكلور وهيدروكسيد الصوديوم من الماء المالح (المحلول الملحي).
البطارية القابلة لإعادة الشحن: نظام يجمع بين الاثنين
البطارية القابلة لإعادة الشحن هي التوضيح المثالي لكلا المبدأين. عندما تشغل جهازك، فإنها تعمل كـ خلية غلفانية، حيث يتم تشغيل تفاعل تلقائي. عندما تقوم بتوصيلها للشحن، يعكس مصدر الطاقة الخارجي العملية، ويحولها إلى خلية تحليلية لدفع تفاعل غير تلقائي واستعادة المتفاعلات الأولية.
اتخاذ القرار الصحيح لهدفك
يعتمد فهمك للخلية التي يجب النظر فيها كليًا على ما إذا كنت بحاجة إلى إنتاج طاقة أو إنتاج مادة.
- إذا كان تركيزك الأساسي هو توليد الطاقة من تفاعل كيميائي: فأنت تتعامل مع خلية غلفانية، حيث تخلق عملية تلقائية تيارًا كهربائيًا.
- إذا كان تركيزك الأساسي هو إنشاء مادة باستخدام الكهرباء: فأنت تستخدم خلية تحليلية، حيث يدفع جهد خارجي تغييرًا كيميائيًا غير تلقائي.
- إذا كان تركيزك الأساسي هو تخزين الطاقة الكهربائية وإعادة استخدامها: فأنت تتعامل مع نظام قابل لإعادة الشحن يتناوب بين كونه خلية تحليلية (شحن) وخلية غلفانية (تفريغ).
في نهاية المطاف، هذان النوعان من الخلايا هما وجهان لعملة كهروكيميائية واحدة، يتم تعريفهما باتجاه تدفق الطاقة.
جدول ملخص:
| الميزة | الخلية الغلفانية | الخلية التحليلية |
|---|---|---|
| تحويل الطاقة | كيميائي ← كهربائي | كهربائي ← كيميائي |
| نوع التفاعل | تلقائي | غير تلقائي (مُجبَر) |
| شحنة الأنود | سالبة | موجبة |
| الوظيفة الأساسية | مصدر طاقة (مثل البطاريات) | إنتاج مادة (مثل الطلاء الكهربائي) |
هل تحتاج إلى تحكم دقيق في عملياتك الكهروكيميائية؟ المعدات المخبرية المناسبة ضرورية للحصول على نتائج دقيقة، سواء كنت تطور مواد بطاريات جديدة أو تحسن تقنيات طلاء المعادن. KINTEK متخصصة في المعدات والمستهلكات المخبرية عالية الجودة لجميع احتياجات البحث والتطوير الكهروكيميائي لديك. اتصل بخبرائنا اليوم للعثور على الحل المثالي لمختبرك!
دليل مرئي
المنتجات ذات الصلة
- خلية كهروكيميائية بالتحليل الكهربائي لتقييم الطلاء
- خلية كهروكيميائية تحليل كهربائي بخمسة منافذ
- خلية التحليل الكهربائي البصري مزدوجة الطبقة من النوع H مع حمام مائي
- خلية غاز الانتشار الكهروكيميائية التحليلية خلية تفاعل سائل
- حمام مائي متعدد الوظائف للخلية الكهروكيميائية بطبقة واحدة أو مزدوجة
يسأل الناس أيضًا
- ما هي مزايا استخدام خلية تفاعل كهروكيميائية بخمسة منافذ لتقييم التآكل الموضعي في السبائك؟
- ما هي المواد المستخدمة في بناء خلية التحليل الكهربائي من النوع H وغطائها؟ دليل إلى الخمول الكيميائي والاستقرار
- ما هي مواصفات الفتحة القياسية للخلية الإلكتروليتية؟ أحجام رئيسية لإعدادك الكهروكيميائي
- لماذا يُستخدم نظام خلية كهروكيميائية ثابتة درجة الحرارة بثلاثة أقطاب في الترسيب الكهربائي للمنجنيز؟
- كيف يتم اختيار أغشية التبادل الأيوني لخلايا التحليل الكهربائي من النوع H؟ ضمان النقل الأمثل للأيونات ونقاء التفاعل
- كيف تسهل الخلايا الكهروكيميائية تحضير سبائك المعادن السائلة؟ إتقان نجاح السبائك الكهروكيميائية
- ما هي احتياطات السلامة الرئيسية التي يجب اتباعها أثناء تشغيل خلية التحليل الكهربائي من النوع H؟ إرشادات أساسية لتجارب خالية من المخاطر
- ما هي خلية التحليل الكهربائي وما هي تطبيقاتها الأساسية؟ إطلاق العنان للتحولات الكيميائية بالكهرباء







