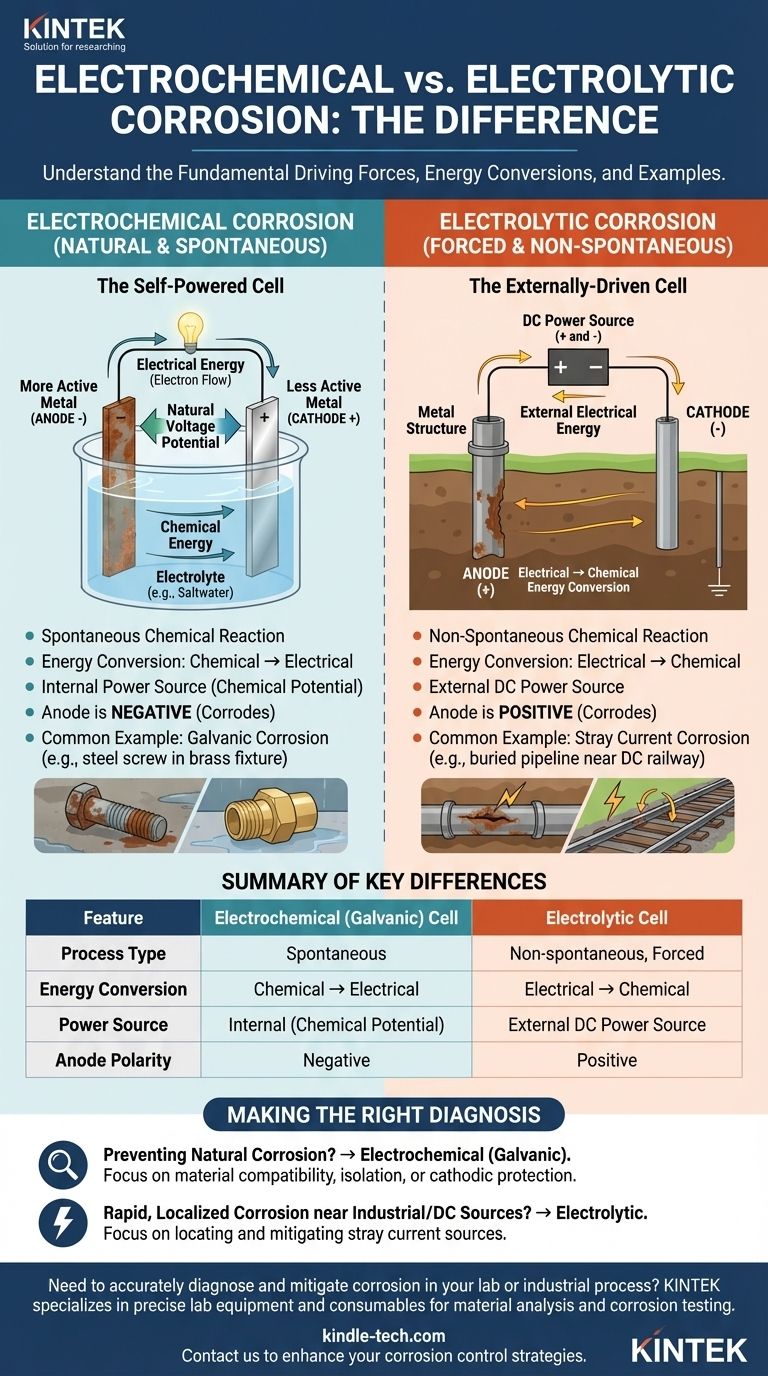
على المستوى الأساسي، يكمن الفرق بين الخلية التحليلية والخلية الكهروكيميائية للتآكل في تحويل الطاقة والقوة الدافعة. تعد الخلية الكهروكيميائية عملية تلقائية تحول الطاقة الكيميائية المخزنة إلى طاقة كهربائية، مما يسبب التآكل الطبيعي. في المقابل، تعد الخلية التحليلية عملية غير تلقائية تستخدم طاقة كهربائية خارجية لإجبار تفاعل كيميائي، مما يسبب تآكلاً مستحثًا.
التمييز الأساسي هو العفوية. يحدث التآكل الكهروكيميائي بشكل طبيعي من تلقاء نفسه، مثل تفريغ البطارية. يتم إجبار التآكل التحليلي على المادة بواسطة مصدر طاقة خارجي، مثل التيار المستمر الشارد من نظام سكة حديد.

الخلية الكهروكيميائية: الحالة الطبيعية للتآكل
تُعرف الخلية الكهروكيميائية، التي تسمى غالبًا الخلية الغلفانية، بالآلية الكامنة وراء الأشكال الأكثر شيوعًا للتآكل. إنها عملية مكتفية ذاتيًا وتحدث بشكل طبيعي.
تفاعل كيميائي تلقائي
تتشكل هذه الأنواع من الخلايا عندما يكون هناك تلامس كهربائي بين معدنين مختلفين في وجود إلكتروليت (مثل المياه المالحة). يوجد جهد كهربائي طبيعي بينهما.
يصبح المعدن الأكثر نشاطًا كيميائيًا هو الأنود (القطب السالب) ويتآكل، مطلقًا الإلكترونات. ويصبح المعدن الأقل نشاطًا هو الكاثود (القطب الموجب) ويستقبل هذه الإلكترونات.
تحويل الطاقة: من كيميائي إلى كهربائي
القوة الدافعة هي إطلاق الطاقة الكيميائية المخزنة داخل المعدن الأكثر نشاطًا. يتم تحويل هذه الطاقة الكيميائية مباشرة إلى طاقة كهربائية في شكل تدفق للإلكترونات من الأنود إلى الكاثود. هذه العملية لا تتطلب طاقة خارجية.
أحد الأمثلة الكلاسيكية هو التآكل الغلفاني، حيث يصدأ مسمار فولاذي (أنود) بسرعة عند توصيله بتركيب نحاسي (كاثود) في بيئة رطبة.
الخلية التحليلية: التآكل بالقوة
تدفع الخلية التحليلية تفاعلًا كيميائيًا لا يحدث عادةً. وهي تفعل ذلك عن طريق تطبيق مصدر خارجي للطاقة الكهربائية.
تفاعل كيميائي غير تلقائي
تتغلب هذه العملية على الميول الطبيعية للمواد المعنية. يجبر مصدر الطاقة الخارجي المعدن على أن يصبح أنودًا ويتآكل، حتى لو كان مستقرًا بخلاف ذلك.
يحدث التآكل حيث يغادر هذا التيار المستمر (DC) المزوّد خارجيًا الهيكل المعدني ليدخل إلكتروليتًا.
تحويل الطاقة: من كهربائي إلى كيميائي
هنا، يتم تحويل الطاقة الكهربائية من مصدر خارجي إلى طاقة كيميائية، والتي تتجلى كتفاعل تآكل. تستهلك الخلية الطاقة لتعمل.
أحد السيناريوهات الواقعية الشائعة هو تآكل التيار الشارد. يمكن لخط أنابيب مدفون يمر بالقرب من سكة حديد تعمل بالتيار المستمر أن يلتقط تيارًا متسربًا، مما يجبر جزء الأنبوب الذي يخرج منه التيار عائدًا إلى التربة على التآكل بمعدل متسارع.
فهم الفروق الرئيسية
في حين أن كلتا العمليتين تتضمنان أنودات وكاثودات وإلكتروليتًا، فإن خصائصهما الأساسية متعاكسة. يعد التعرف على هذه الاختلافات أمرًا بالغ الأهمية للتشخيص والتخفيف المناسبين.
القوة الدافعة ومصدر الطاقة
التمييز الأكثر أهمية هو القوة الدافعة. يتم تشغيل الخلية الكهروكيميائية ذاتيًا بواسطة فرق الجهد الكيميائي بين المواد. يتم تشغيل الخلية التحليلية خارجيًا بواسطة مصدر تيار مستمر خارجي.
قطبية الأقطاب الكهربائية
يتم عكس قطبية الأنود والكاثود بين الخليتين، وهو موضع ارتباك متكرر.
- في الخلية الكهروكيميائية (الغلفانية)، يكون الأنود (حيث يحدث التآكل) سالبًا، ويكون الكاثود موجبًا.
- في الخلية التحليلية، يجعل مصدر الطاقة الخارجي الأنود (حيث يحدث التآكل) موجبًا، ويكون الكاثود سالبًا.
الآثار العملية
يؤدي تحديد نوع خلية التآكل بشكل خاطئ إلى حلول غير صحيحة. على سبيل المثال، قد يؤدي تغيير أزواج المواد إلى حل مشكلة التآكل الغلفاني ولكنه لن يفعل شيئًا لوقف تآكل التيار الشارد.
إجراء التشخيص الصحيح
يعد فهم الآلية الأساسية هو الخطوة الأولى نحو التحكم الفعال في التآكل. يجب أن يسترشد نهجك التشخيصي بنوع الخلية المشتبه به.
- إذا كان تركيزك الأساسي هو منع التآكل الطبيعي: فمن المحتمل أنك تتعامل مع خلية كهروكيميائية (غلفانية). يتضمن الحل الخاص بك اختيار مواد متوافقة، أو عزلها كهربائيًا، أو تطبيق حماية كاثودية.
- إذا كنت تحقق في تآكل سريع وموضعي بالقرب من المعدات الصناعية أو النقل بالتيار المستمر: فمن المؤكد تقريبًا أنك تتعامل مع خلية تحليلية. يجب أن تكون أولويتك هي تحديد مصدر تيار الشارد الخارجي وتخفيفه.
في نهاية المطاف، فإن معرفة ما إذا كان التآكل يحدث بشكل طبيعي أو يتم فرضه بواسطة تأثير خارجي يحدد استراتيجية الوقاية والتحكم بأكملها.
جدول الملخص:
| الميزة | الخلية الكهروكيميائية (الغلفانية) | الخلية التحليلية |
|---|---|---|
| نوع العملية | تلقائي | غير تلقائي، مُجبر |
| تحويل الطاقة | كيميائي ← كهربائي | كهربائي ← كيميائي |
| مصدر الطاقة | داخلي (فرق الجهد الكيميائي) | مصدر طاقة تيار مستمر خارجي |
| قطبية الأنود | سالب | موجب |
| مثال شائع | التآكل الغلفاني (مثل الفولاذ/النحاس الأصفر) | تآكل التيار الشارد (مثل السكك الحديدية) |
هل تحتاج إلى تشخيص وتخفيف التآكل بدقة في مختبرك أو عمليتك الصناعية؟
يعد فهم النوع الدقيق لخلية التآكل هو الخطوة الأولى نحو حل فعال. يتخصص الخبراء في KINTEK في توفير معدات المختبر والمواد الاستهلاكية الدقيقة اللازمة لتحليل المواد واختبار التآكل. سواء كنت تبحث في التفاعلات الغلفانية أو آثار التيار الشارد، لدينا الأدوات اللازمة لدعم أبحاثك وضمان سلامة المواد.
اتصل بنا اليوم عبر نموذج الاتصال الخاص بنا لمناقشة احتياجات مختبرك المحددة واكتشاف كيف يمكن لحلول KINTEK تعزيز استراتيجياتك للتحكم في التآكل.
دليل مرئي
المنتجات ذات الصلة
- خلية كهروكيميائية بالتحليل الكهربائي لتقييم الطلاء
- خلية كهروكيميائية للتآكل المسطح
- خلية كهروكيميائية تحليل كهربائي بخمسة منافذ
- خلية التحليل الكهربائي البصري مزدوجة الطبقة من النوع H مع حمام مائي
- خلية التحليل الكهربائي من PTFE خلية كهروكيميائية مقاومة للتآكل مختومة وغير مختومة
يسأل الناس أيضًا
- كيف يختلف أداء الخلايا المدعومة بالإلكتروليت (ESC) والخلايا المدعومة بالكاثود (CSC) في التحليل الكهربائي عالي الحرارة للأكاسيد الصلبة (SOE)؟
- لماذا يُستخدم نظام خلية التحليل الكهربائي بثلاثة أقطاب لاختبار تفاعل تطور الهيدروجين (HER)؟ ضمان تحليل تحفيزي دقيق
- ما هو الإعداد التجريبي النموذجي لخلية تحليل كهربائي فائقة الإحكام؟ تحقيق تحكم فائق في التحليل الكهروكيميائي
- ما هي المزايا التقنية التي يتم اكتسابها من خلال ربط تجديد راتنج التبادل الأيوني بأنظمة الأكسدة الكهروكيميائية؟
- ما هي متطلبات الخلية الكهروضوئية المزودة بنافذة كوارتز؟ ضمان دقة اختبارات الأداء الكهروضوئي (PEC)
- ما هي الخطوات الرئيسية لإعداد التجربة؟ دليل للقياسات الكهروكيميائية الخالية من العيوب
- كيف تمنع أغشية التبادل الأيوني تحلل بيروكسيد الهيدروجين؟ تعزيز الإنتاجية والكفاءة في الخلايا المتدفقة
- ما هي الاحتياطات التي يجب اتخاذها عند التعامل مع خلية التحليل الكهربائي المصنوعة بالكامل من الكوارتز واستخدامها؟ ضمان أداء آمن ودقيق ومتين



















