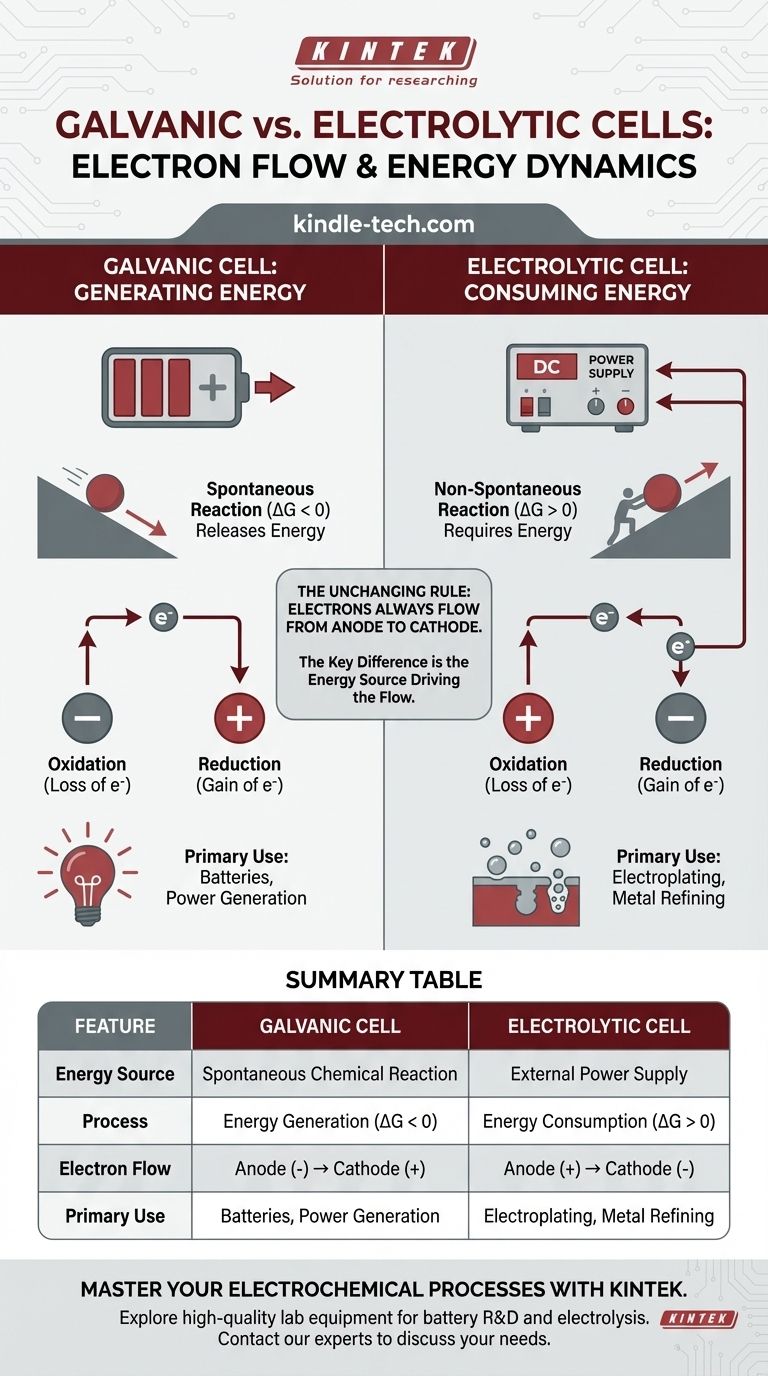
في أي خلية كيميائية كهربائية، يتدفق الإلكترون في الدائرة الخارجية دائمًا من الأنود إلى الكاثود. يكمن التمييز الحاسم في سبب تدفقها. في الخلية الجلفانية، يولد تفاعل كيميائي تلقائي الطاقة ويدفع الإلكترونات. في الخلية الإلكتروليتية، يوفر مصدر طاقة خارجي الطاقة لإجبار الإلكترونات على التدفق ودفع تفاعل غير تلقائي.
الفرق الأساسي ليس في اتجاه تدفق الإلكترونات بالنسبة للأكسدة والاختزال، بل في مصدر الطاقة الذي يدفع العملية. تحول الخلية الجلفانية الطاقة الكيميائية المخزنة إلى طاقة كهربائية، بينما تستخدم الخلية الإلكتروليتية طاقة كهربائية خارجية لإجبار التغيير الكيميائي.

المبدأ الأساسي: التفاعلات التلقائية مقابل غير التلقائية
لفهم تدفق الإلكترونات، يجب عليك أولاً فهم ديناميكيات الطاقة للخلية. يتم التحكم في النظام بأكمله من خلال ما إذا كان التفاعل الكيميائي يحدث من تلقاء نفسه أو يجب إجباره.
الخلايا الجلفانية: توليد الطاقة
تستغل الخلية الجلفانية (وتسمى أيضًا الخلية الفولتية) تفاعلًا كيميائيًا تلقائيًا. فكر في الأمر ككرة تتدحرج إلى أسفل التل - العملية تطلق الطاقة بشكل طبيعي.
يحتوي هذا التفاعل التلقائي على طاقة جيبس حرة سالبة (ΔG < 0). يتم تحويل هذا الإطلاق للطاقة الكيميائية مباشرة إلى طاقة كهربائية، مما يدفع الإلكترونات من الأنود، عبر الدائرة الخارجية، وإلى الكاثود.
الخلايا الجلفانية هي أساس جميع البطاريات التقليدية.
الخلايا الإلكتروليتية: استهلاك الطاقة
تُستخدم الخلية الإلكتروليتية لدفع تفاعل كيميائي غير تلقائي. هذا يشبه دفع كرة إلى أعلى التل - يتطلب إدخالًا مستمرًا للطاقة الخارجية ليحدث.
يحتوي هذا التفاعل على طاقة جيبس حرة موجبة (ΔG > 0). يعمل مصدر طاقة خارجي، مثل بطارية أو مزود طاقة، "كمضخة إلكترونات". فهو يجبر الإلكترونات على الكاثود ويسحبها بعيدًا عن الأنود، مما يدفع تفاعلًا لن يحدث من تلقاء نفسه.
تفكيك تدفق الإلكترونات وقطبية الأقطاب الكهربائية
ينبع الارتباك حول تدفق الإلكترونات غالبًا من تغير قطبية الأقطاب الكهربائية. بينما أدوار الأنود والكاثود ثابتة، فإن شحناتهما ليست كذلك.
القاعدة الثابتة: من الأنود إلى الكاثود
بحكم التعريف، موقع الأكسدة (فقدان الإلكترونات) هو دائمًا الأنود، وموقع الاختزال (اكتساب الإلكترونات) هو دائمًا الكاثود.
نظرًا لأن الإلكترونات تُفقد عند الأنود وتُكتسب عند الكاثود، فإن الإلكترونات في السلك الخارجي تتدفق دائمًا من الأنود إلى الكاثود. هذا ثابت عالمي لكلا نوعي الخلايا.
الفرق الحاسم: شحنة القطب الكهربائي
تنعكس قطبية (الشحنة الموجبة أو السالبة) الأقطاب الكهربائية بين نوعي الخلايا، وهو مصدر معظم الارتباك.
في الخلية الجلفانية، الأنود هو موقع الأكسدة التلقائية التي تطلق الإلكترونات. يؤدي تراكم هذه الشحنة السالبة إلى جعل الأنود هو الطرف السالب (-). يصبح الكاثود، الذي يستهلك الإلكترونات، هو الطرف الموجب (+).
في الخلية الإلكتروليتية، يحدد مصدر الطاقة الخارجي القطبية. فهو يوصل طرفه السالب بـ كاثود الخلية لإجبار الإلكترونات عليه ودفع الاختزال. ويوصل طرفه الموجب بـ أنود الخلية لسحب الإلكترونات بعيدًا ودفع الأكسدة.
- الخلية الجلفانية: الأنود (-) إلى الكاثود (+)
- الخلية الإلكتروليتية: الأنود (+) إلى الكاثود (-)
فهم التطبيقات العملية
يحدد الفرق الأساسي في تحويل الطاقة كيفية استخدام هذه الخلايا. إحداهما تنتج الطاقة، والأخرى تستهلكها لإنتاج مواد قيمة.
الخلايا الجلفانية: طاقة عند الطلب
الفائدة الأساسية للخلية الجلفانية هي قدرتها على العمل كمصدر محمول للطاقة الكهربائية.
إنها الأساس للبطاريات، من خلايا AA البسيطة إلى بطارية السيارة. يكمن قيودها الرئيسية في أن المتفاعلات الكيميائية تُستهلك في النهاية، مما يتسبب في انخفاض الجهد وموت البطارية.
الخلايا الإلكتروليتية: إجبار التغيير الكيميائي
الغرض من الخلية الإلكتروليتية هو استخدام الكهرباء لإنشاء منتج كيميائي.
هذه العملية، المعروفة باسم التحليل الكهربائي، ضرورية للتطبيقات الصناعية مثل تكرير المعادن (مثل إنتاج الألومنيوم النقي)، وطلاء الأسطح بالكهرباء بطبقة معدنية واقية، وتقسيم الماء إلى هيدروجين وأكسجين. عيبها هو الحاجة إلى إمداد مستمر وغالبًا ما يكون مكلفًا من الطاقة الكهربائية.
كيفية تطبيق هذا على هدفك
يعتمد نهجك كليًا على ما إذا كنت بحاجة إلى توليد الكهرباء أو دفع تفاعل كيميائي.
- إذا كان تركيزك الأساسي هو توليد الطاقة أو إنشاء بطارية: فأنت تعمل بخلية جلفانية، حيث ينتج تفاعل تلقائي تيارًا كهربائيًا.
- إذا كان تركيزك الأساسي هو تنقية معدن، أو طلاء سطح بالكهرباء، أو تقسيم مركب: فأنت بحاجة إلى خلية إلكتروليتية، والتي تستخدم طاقة خارجية لدفع تفاعل غير تلقائي.
- إذا كان تركيزك الأساسي هو فهم المبدأ الأساسي: تذكر أن الأكسدة دائمًا عند الأنود والاختزال عند الكاثود؛ والفرق الرئيسي هو ما إذا كان التفاعل تلقائيًا (جلفاني) أو مجبرًا (إلكتروليتي).
فهم هذا التمييز بين إطلاق الطاقة التلقائي وإدخال الطاقة القسري هو مفتاح إتقان الخلايا الكهروكيميائية.
جدول ملخص:
| الميزة | الخلية الجلفانية | الخلية الإلكتروليتية |
|---|---|---|
| مصدر الطاقة | تفاعل كيميائي تلقائي | مصدر طاقة خارجي |
| العملية | توليد الطاقة (ΔG < 0) | استهلاك الطاقة (ΔG > 0) |
| تدفق الإلكترونات | الأنود (-) ← الكاثود (+) | الأنود (+) ← الكاثود (-) |
| الاستخدام الأساسي | البطاريات، توليد الطاقة | الطلاء الكهربائي، تكرير المعادن |
أتقن عملياتك الكهروكيميائية مع KINTEK
سواء كنت تقوم بتطوير تقنيات بطاريات جديدة أو تكرير مواد من خلال التحليل الكهربائي، فإن امتلاك المعدات المختبرية المناسبة أمر بالغ الأهمية للحصول على نتائج دقيقة وموثوقة. تتخصص KINTEK في المعدات والمواد الاستهلاكية المختبرية عالية الجودة، وتوفر الأدوات الدقيقة التي تحتاجها لجميع أبحاثك وتطويرك الكهروكيميائي.
دعنا نساعدك في تجهيز مختبرك للنجاح. اتصل بخبرائنا اليوم لمناقشة احتياجاتك الخاصة واكتشاف كيف يمكن لـ KINTEK دعم عملك الرائد.
دليل مرئي
المنتجات ذات الصلة
- خلية التحليل الكهربائي البصري مزدوجة الطبقة من النوع H مع حمام مائي
- خلية كهروكيميائية بالتحليل الكهربائي لتقييم الطلاء
- خلية كهروكيميائية كهروكيميائية كوارتز للتجارب الكهروكيميائية
- خلية التحليل الكهربائي من النوع H خلية كهروكيميائية ثلاثية
- خلية التحليل الكهربائي من PTFE خلية كهروكيميائية مقاومة للتآكل مختومة وغير مختومة
يسأل الناس أيضًا
- كيف يجب إعداد الدائرة الكهربائية للخلية التحليلية؟ دليل خطوة بخطوة للتحليل الكهربائي الآمن والدقيق
- ما أنواع الأقطاب الكهربائية المستخدمة في الخلية الإلكتروليتية من النوع H؟ دليل لنظام الأقطاب الثلاثة الأساسي
- ما هي التطبيقات الأساسية للخلية الإلكتروليتية المصنوعة بالكامل من الكوارتز؟ ضرورية للتحليل عالي النقاوة والتحليل البصري
- كيف يتعاون مصدر طاقة التيار المستمر والخلية الكهروكيميائية لتقييم التقصف الهيدروجيني للسبائك؟
- كيف يعمل خلية التحليل الكهربائي الغشائية في الخرسانة الواقية من الإشعاع؟ تحسين الكثافة بالماء النشط
- كيف يؤثر المحرك المغناطيسي الدقيق على كفاءة التفاعل؟ تعزيز أداء التحلل الكهروكيميائي
- ما هي الخصائص الهيكلية والمزايا لخلية التحليل الكهربائي المصنوعة بالكامل من PTFE؟ خمول كيميائي مطلق
- كيف يتم تعريف وظائف الكاثود والأنود داخل خلية التحليل الكهربائي؟ دليل الخبراء للتحليل الكهربائي



















