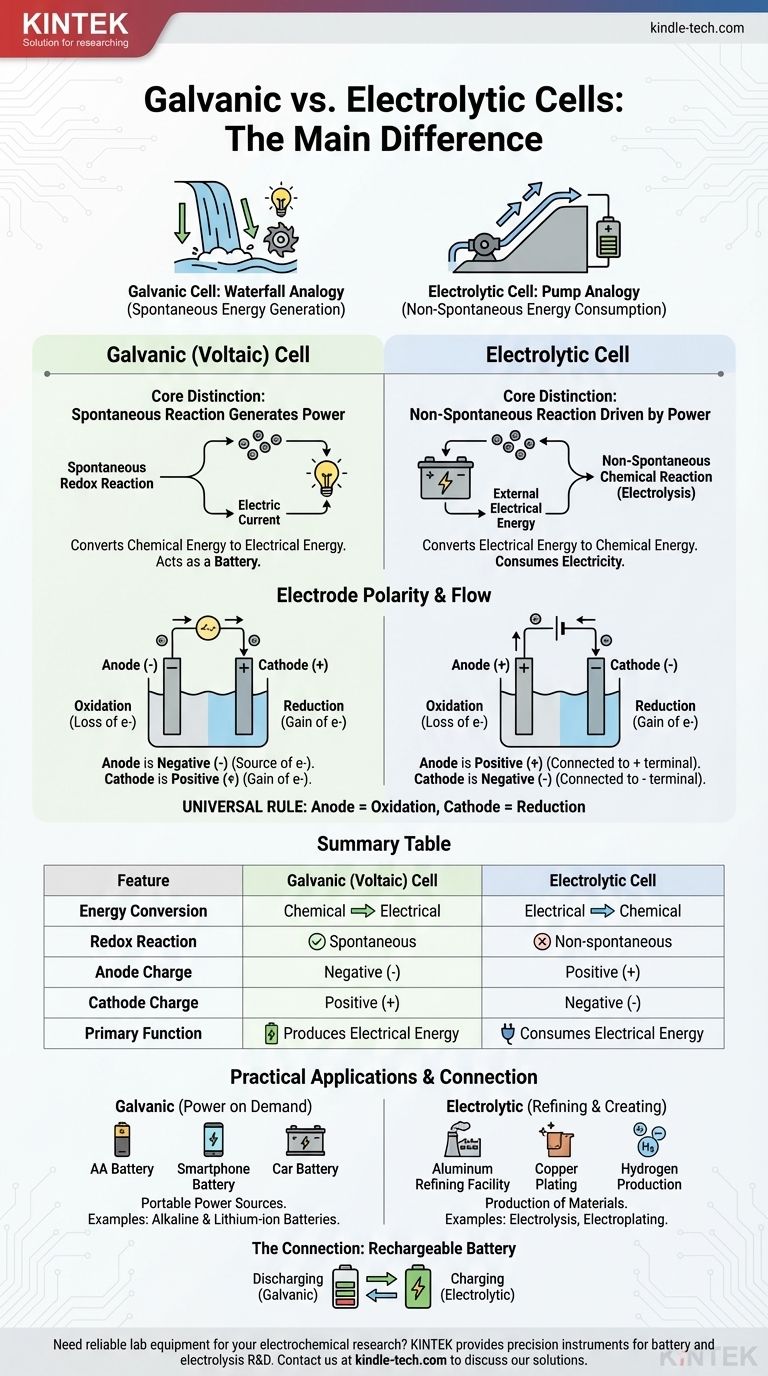
يكمن الاختلاف الجوهري في اتجاه تحويل الطاقة وطبيعة التفاعل الكيميائي. تحول الخلية الغلفانية الطاقة الكيميائية المخزنة إلى طاقة كهربائية تلقائيًا، وتعمل بفعالية كبطارية. في المقابل، تستخدم الخلية الإلكتروليتية مصدرًا خارجيًا للطاقة الكهربائية لإجبار تفاعل كيميائي غير تلقائي على الحدوث.
فكر في الأمر على أنه الفرق بين شلال يولد الطاقة ومضخة تستخدم الطاقة. الخلية الغلفانية تشبه الشلال، حيث تخلق عملية طبيعية وتلقائية (تدفق الماء إلى الأسفل) طاقة. أما الخلية الإلكتروليتية فتشبه المضخة، حيث تستخدم طاقة خارجية لإجبار عملية لن تحدث من تلقاء نفسها (دفع الماء إلى الأعلى).

التمييز الأساسي: التلقائية وتدفق الطاقة
يخضع سلوك هاتين الخليتين لمبدأ واحد: ما إذا كان تفاعل الأكسدة والاختزال الداخلي يحدث من تلقاء نفسه.
الخلايا الغلفانية: تفاعلات تلقائية تولد الطاقة
في الخلية الغلفانية، والمعروفة أيضًا باسم الخلية الفولتية، يميل الكيميائيون المختارون للتفاعل مع بعضهم البعض بشكل طبيعي.
إن تفاعل الأكسدة والاختزال التلقائي هذا يطلق الطاقة. يتم بناء الخلية لتوجيه هذه الطاقة ليس كحرارة، ولكن كتدفق موجه للإلكترونات - أي تيار كهربائي.
في الأساس، تسخر الخلية الغلفانية عملية كيميائية طبيعية للقيام بعمل كهربائي. هذا هو المبدأ وراء جميع البطاريات.
الخلايا الإلكتروليتية: تفاعلات غير تلقائية مدفوعة بالطاقة
في الخلية الإلكتروليتية، يكون التفاعل الكيميائي غير تلقائي. لن تتفاعل المواد المتفاعلة من تلقاء نفسها لإنتاج النواتج المرجوة.
لجعل التفاعل يحدث، يتم توصيل مصدر طاقة خارجي (مثل بطارية أو مزود طاقة) بالخلية. يوفر هذا الجهد الخارجي الطاقة اللازمة لإجبار الإلكترونات على التحرك ودفع التغيير الكيميائي.
تستهلك الخلايا الإلكتروليتية الكهرباء لإنتاج منتج كيميائي، وهي عملية تُعرف باسم التحليل الكهربائي.
نظرة أعمق على قطبية الأقطاب الكهربائية
على الرغم من أن مصطلحي "الأنود" و "الكاثود" ثابتان، إلا أن شحنتهما (القطبية) هي نقطة شائعة للارتباك لأنهما معكوسان بين نوعي الخلايا. المفتاح هو تذكر ما يدفع تدفق الإلكترونات.
الأنود: دائمًا موقع الأكسدة
في كلا نوعي الخلايا، يُعرَّف الأنود بأنه القطب الكهربائي الذي تحدث عنده الأكسدة (فقدان الإلكترونات). هذا التعريف عالمي.
الكاثود: دائمًا موقع الاختزال
بالمثل، فإن الكاثود هو دائمًا القطب الكهربائي الذي تحدث عنده عملية الاختزال (اكتساب الإلكترونات). هذه هي القاعدة العالمية الثانية.
التحول الحاسم: لماذا تتغير القطبية
يأتي الاختلاف في القطبية من كون التفاعل تلقائيًا أو قسريًا.
في الخلية الغلفانية، تطلق الأكسدة التلقائية عند الأنود إلكترونات، مما يخلق شحنة سالبة. الأنود هو القطب السالب لأنه مصدر الإلكترونات التي تندفع خارجًا إلى الدائرة.
في الخلية الإلكتروليتية، يتم استخدام مصدر طاقة خارجي. يسحب طرفه الموجب الإلكترونات بعيدًا عن الأنود لإجبار الأكسدة. لذلك، يتم توصيل الأنود بالجانب الموجب ويصبح القطب الموجب.
| الميزة | الخلية الغلفانية (الفولتية) | الخلية الإلكتروليتية |
|---|---|---|
| تحويل الطاقة | كيميائية إلى كهربائية | كهربائية إلى كيميائية |
| تفاعل الأكسدة والاختزال | تلقائي | غير تلقائي |
| شحنة الأنود | سالب (-) | موجب (+) |
| شحنة الكاثود | موجب (+) | سالب (-) |
| الوظيفة الأساسية | توليد طاقة كهربائية | استهلاك طاقة كهربائية |
فهم التطبيقات العملية
يؤدي هذا الاختلاف الأساسي إلى استخدامات متميزة في التكنولوجيا والصناعة.
الخلايا الغلفانية قيد العمل: طاقة عند الطلب
تم تصميم الخلايا الغلفانية لتكون مصادر محمولة للطاقة الكهربائية. تشمل الأمثلة الشائعة جميع أنواع البطاريات، من بطاريات AA القلوية القياسية إلى بطارية الليثيوم أيون في هاتفك.
الخلايا الإلكتروليتية قيد العمل: التكرير والإنشاء
تستخدم الخلايا الإلكتروليتية الطاقة لإنتاج المواد. تعتمد العمليات الصناعية الرئيسية على التحليل الكهربائي، مثل إنتاج الألومنيوم النقي من خامته، وتكرير النحاس، وفصل الماء لإنتاج غاز الهيدروجين والأكسجين. الطلاء الكهربائي، حيث يتم ترسيب طبقة رقيقة من المعدن مثل الفضة أو الكروم على جسم آخر، هو تطبيق شائع آخر.
الرابط: كيف تعمل البطارية القابلة لإعادة الشحن
البطارية القابلة لإعادة الشحن هي التوضيح المثالي لكلا نوعي الخلايا في جهاز واحد.
عندما تزود جهازك بالطاقة (التفريغ)، فإنها تعمل كـ خلية غلفانية. ينتج تفاعل كيميائي تلقائي داخل البطارية تيارًا كهربائيًا.
عندما تقوم بتوصيلها للشحن، يعمل الشاحن كمصدر طاقة خارجي. يطبق جهدًا يجبر التفاعل العكسي غير التلقائي على الحدوث، مما يجدد المواد المتفاعلة. أثناء الشحن، تعمل البطارية كـ خلية إلكتروليتية.
اختيار الخيار الصحيح لهدفك
يحدد هدفك أي إطار عمل كهروكيميائي تستخدمه.
- إذا كان تركيزك الأساسي هو توليد الكهرباء من عملية كيميائية: فأنت تصف خلية غلفانية (فولتية).
- إذا كان تركيزك الأساسي هو استخدام الكهرباء لدفع تغيير كيميائي محدد: فأنت تتعامل مع خلية إلكتروليتية.
- إذا كنت تحلل بطارية قابلة لإعادة الشحن: تذكر أنها تعمل كخلية غلفانية أثناء التفريغ وخلية إلكتروليتية أثناء إعادة الشحن.
في نهاية المطاف، فإن تلقائية التفاعل واتجاه تدفق الطاقة الناتج هما الخصائص المحددة التي تفصل بين هذين الركنين من أركان الكيمياء الكهربائية.
جدول ملخص:
| الميزة | الخلية الغلفانية (الفولتية) | الخلية الإلكتروليتية |
|---|---|---|
| تحويل الطاقة | كيميائية إلى كهربائية | كهربائية إلى كيميائية |
| تفاعل الأكسدة والاختزال | تلقائي | غير تلقائي |
| شحنة الأنود | سالب (-) | موجب (+) |
| شحنة الكاثود | موجب (+) | سالب (-) |
| الوظيفة الأساسية | توليد طاقة كهربائية | استهلاك طاقة كهربائية |
هل تحتاج إلى معدات مختبرية موثوقة لأبحاثك الكهروكيميائية؟ سواء كنت تطور تقنيات بطاريات جديدة أو تحسن عمليات التحليل الكهربائي، توفر KINTEK الأدوات والمواد الاستهلاكية الدقيقة التي يتطلبها مختبرك. اتصل بنا اليوم لمناقشة كيف يمكن لحلولنا أن تدعم ابتكاراتك!
دليل مرئي
المنتجات ذات الصلة
- خلية كهروكيميائية بالتحليل الكهربائي لتقييم الطلاء
- خلية كهروكيميائية تحليل كهربائي بخمسة منافذ
- خلية التحليل الكهربائي البصري مزدوجة الطبقة من النوع H مع حمام مائي
- خلية غاز الانتشار الكهروكيميائية التحليلية خلية تفاعل سائل
- حمام مائي متعدد الوظائف للخلية الكهروكيميائية بطبقة واحدة أو مزدوجة
يسأل الناس أيضًا
- لماذا يعتبر مقياس الجهد أو مقياس التيار الثابت ضروريًا لتقييم مقاومة تآكل طلاءات السبائك عالية الإنتروبيا؟
- ما هي الأحجام الشائعة لخلية التحليل الكهربائي ثلاثية الأقطاب؟ اختر الحجم المناسب لتجربتك
- من أي مادة صُنِعَ خزان التحليل الكهربائي ذو الخمسة منافذ؟ شرح للزجاج البورسليكاتي العالي و PTFE
- كيف يجب تنظيف خلية التحليل الكهربائي الجديدة قبل الاستخدام الأول؟ ضمان نتائج دقيقة وقابلة للتكرار
- ما هي احتياطات السلامة اللازمة للتحكم في درجة الحرارة عند استخدام خلية تحليل كهربائي بحوض مائي مزدوج الطبقات؟ ضمان تجارب آمنة ودقيقة
- ما هي إرشادات التعقيم بدرجة حرارة عالية للخلية الإلكتروليتية متعددة الوظائف؟ تجنب التلف الدائم لغطاء PTFE الخاص بك
- ما هي مزايا استخدام زجاج الكوارتز كمادة لخلية مفاعل الأكسدة الكهروكيميائية؟
- ما هي نصيحة التعامل العامة للخلية التحليلية الزجاجية؟ احمِ استثمارك واضمن نتائج موثوقة















