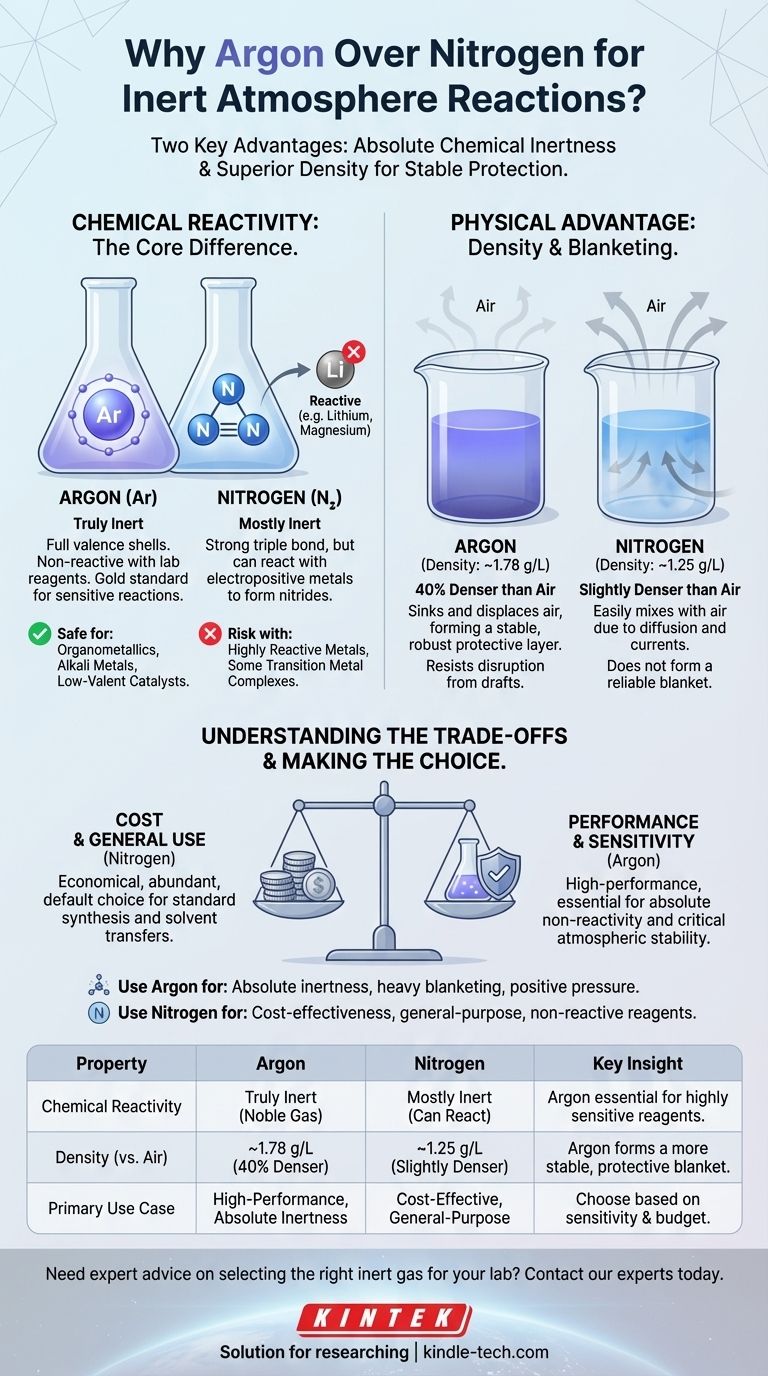
في الممارسة العملية، غالبًا ما يُعتبر الأرجون "أفضل" من النيتروجين لتفاعلات الجو الخامل بسبب خاصيتين رئيسيتين. الأرجون هو غاز نبيل خامل حقًا، وغير قادر على التفاعل مع كواشف المختبر، بينما يمكن للنيتروجين أن يتفاعل في ظل ظروف معينة. علاوة على ذلك، تسمح كثافة الأرجون الأعلى له بتكوين "غطاء" أكثر استقرارًا وحماية فوق التفاعل، مما يزيح الهواء بشكل أكثر فعالية.
الاختيار بين الأرجون والنيتروجين لا يتعلق بمن هو الأفضل عالميًا، بل بمن هو الأنسب لمهمة معينة. النيتروجين هو الخيار الاقتصادي للتعطيل العام، بينما الأرجون هو الخيار عالي الأداء للتفاعلات التي تتطلب عدم تفاعل مطلق واستقرارًا جويًا.

الفرق الجوهري: النشاط الكيميائي
السبب الأكثر جوهرية لاختيار غاز على الآخر يعود إلى قدرتهما على المشاركة في تفاعلك.
الأرجون: تعريف الخمول
الأرجون هو غاز نبيل. أغلفة إلكتروناته التكافؤية ممتلئة تمامًا، مما يجعله مستقرًا بشكل استثنائي وغير متفاعل في جميع ظروف المختبر تقريبًا.
بالنسبة للكيميائي، هذا هو المعيار الذهبي. يمكنك أن تكون واثقًا من أن الأرجون لن يتداخل مع تفاعلك، بغض النظر عن مدى حساسية الكواشف.
النيتروجين: "خامل في الغالب"
يتكون غاز النيتروجين (N₂) من ذرتي نيتروجين مرتبطتين برابطة ثلاثية قوية جدًا. تتطلب هذه الرابطة قدرًا كبيرًا من الطاقة لكسرها، ولهذا السبب يعتبر N₂ خاملًا في الغالب ويخدم جيدًا في العديد من التطبيقات.
ومع ذلك، فهو ليس غير متفاعل تمامًا. يمكن للكواشف شديدة التفاعل، وخاصة الفلزات الكهروإيجابية مثل الليثيوم والمغنيسيوم وبعض معقدات الفلزات الانتقالية، أن تتفاعل مع N₂ لتكوين نتريدات الفلزات. يمكن أن يقلل هذا التفاعل الجانبي غير المرغوب فيه من محصولك أو يدخل شوائب.
الميزة الفيزيائية: الكثافة
بالإضافة إلى النشاط الكيميائي، يعتبر السلوك الفيزيائي للغاز في المختبر عاملاً حاسمًا. الهواء هو خليط من الغازات، ولكن له كثافة متوسطة يمكننا مقارنتها.
- كثافة الأرجون: ~1.78 جم/لتر
- كثافة الهواء: ~1.23 جم/لتر
- كثافة النيتروجين: ~1.25 جم/لتر
كيف تخلق الكثافة "غطاءً" واقيًا
الأرجون أكثر كثافة من الهواء بنسبة 40% تقريبًا. عندما تقوم بتطهير دورق بالأرجون، فإنه يغوص بفعالية ويزيح الهواء الأخف، دافعًا إياه للأعلى والخارج. ثم يستقر فوق خليط التفاعل الخاص بك، مكونًا غطاءً مستقرًا وثقيلًا يقاوم الاضطراب.
النيتروجين، على النقيض من ذلك، أكثر كثافة بقليل من الهواء فقط. إنه أكثر عرضة للاختلاط بالهواء بسبب الانتشار والتيارات الهوائية الطفيفة أو تيارات الحمل الحراري في الغرفة. لا يشكل نفس الطبقة الواقية القوية.
الآثار العملية لإعدادات المختبر
يؤدي هذا الاختلاف في الكثافة إلى عواقب واقعية. في صندوق القفازات أو على خط شلينك، يوفر الضغط الإيجابي للأرجون جوًا أكثر تسامحًا. إذا حدث تسرب بسيط، فإن الأرجون الكثيف سيتدفق إلى الخارج بشكل تفضيلي، مما يمنع الهواء الأخف من التدفق إلى الداخل.
بالنسبة للتقنيات التي تعتمد على تغطية وعاء مفتوح، كما هو الحال في العديد من التجارب الكهروكيميائية، يعتبر الأرجون متفوقًا بشكل كبير لأنه سيبقى مستقرًا فوق المحلول. سيختلط النيتروجين ببساطة مع الهواء المحيط على الفور تقريبًا.
فهم المقايضات
يتطلب اختيار الغاز المثالي الموازنة بين الأداء والقيود العملية.
التكلفة: العامل الحاسم للكثيرين
يشكل النيتروجين حوالي 78% من الغلاف الجوي للأرض، بينما يشكل الأرجون أقل من 1%. هذا الاختلاف في الوفرة يجعل النيتروجين أرخص بكثير في الإنتاج والشراء.
بالنسبة للعمليات الصناعية واسعة النطاق أو إجراءات المختبر الروتينية حيث لا تكون الخمول الشديد مطلوبًا، فإن وفورات التكلفة الناتجة عن استخدام النيتروجين كبيرة وغالبًا ما تجعله الخيار الافتراضي.
النشاط: عندما يكون "خامل في الغالب" جيدًا بما فيه الكفاية
النشاط المحتمل للنيتروجين يهم فقط إذا كان نظامك الكيميائي قادرًا على كسر الرابطة الثلاثية N≡N.
بالنسبة للغالبية العظمى من التفاعلات العضوية، والتنقيات، ونقل المذيبات، فإن النيتروجين كافٍ تمامًا. الكواشف ببساطة ليست نشطة بما يكفي لتكوين النتريدات، مما يجعل الأرجون نفقات غير ضرورية.
اتخاذ القرار الصحيح لتفاعلك
استند في قرارك إلى المتطلبات المحددة لإجراءك الكيميائي والواقع العملي لمختبرك.
- إذا كان تركيزك الأساسي هو الخمول المطلق للكواشف الحساسة: استخدم الأرجون عند العمل مع المركبات العضوية المعدنية (خاصة تلك التي تحتوي على Li, Mg)، الفلزات القلوية، محفزات الفلزات الانتقالية ذات التكافؤ المنخفض، أو أي نظام يكون فيه تكوين النتريد خطرًا معروفًا.
- إذا كان تركيزك الأساسي هو الفعالية من حيث التكلفة والاستخدام العام: استخدم النيتروجين لمعظم التخليقات العضوية القياسية، أجهزة تقطير المذيبات، إعادة البلورة، والإجراءات الأخرى التي لا تتضمن أنواعًا نشطة بشكل استثنائي.
- إذا كان تركيزك الأساسي هو الحفاظ على جو مستقر: استخدم الأرجون للتقنيات التي تتطلب غطاءً ثقيلًا من الغاز، مثل الكيمياء الكهربائية، أو في الإعدادات التي يكون فيها الحفاظ على ضغط إيجابي ضد التسربات المحتملة أمرًا بالغ الأهمية.
في النهاية، فإن فهم الخصائص الكيميائية والفيزيائية المميزة لكل غاز يمكّنك من اتخاذ الخيار الأكثر استنارة واقتصادية لتجربتك.
جدول الملخص:
| الخاصية | الأرجون | النيتروجين | الرؤية الرئيسية |
|---|---|---|---|
| النشاط الكيميائي | خامل حقًا (غاز نبيل) | خامل في الغالب، ولكنه يمكن أن يتفاعل مع الفلزات الكهروإيجابية | الأرجون ضروري للكواشف شديدة الحساسية. |
| الكثافة (مقابل الهواء) | ~1.78 جم/لتر (أكثر كثافة بنسبة 40%) | ~1.25 جم/لتر (أكثر كثافة بقليل) | يشكل الأرجون غطاءً واقيًا أكثر استقرارًا. |
| حالة الاستخدام الأساسية | تفاعلات عالية الأداء تتطلب خمولًا مطلقًا | حل فعال من حيث التكلفة للتعطيل العام | اختر بناءً على حساسية تفاعلك وميزانيتك. |
هل تحتاج إلى مشورة الخبراء بشأن اختيار الغاز الخامل المناسب لتطبيقك المختبري المحدد؟
تتخصص KINTEK في توفير غازات ومعدات مختبرية عالية النقاء، بما في ذلك أنظمة الأرجون والنيتروجين، لضمان حماية تفاعلاتك الحساسة بشكل مثالي. يمكن لفريقنا مساعدتك في تحسين إعداداتك لتحقيق أقصى قدر من الإنتاجية والسلامة.
اتصل بخبرائنا اليوم لمناقشة احتياجاتك من الجو الخامل والعثور على الحل الأكثر كفاءة لمختبرك.
دليل مرئي
المنتجات ذات الصلة
- فرن جو متحكم فيه بدرجة حرارة 1400 درجة مئوية مع غاز النيتروجين والجو الخامل
- فرن جو متحكم فيه بدرجة حرارة 1200 درجة مئوية فرن جو خامل بالنيتروجين
- فرن جو متحكم فيه بدرجة حرارة 1700 درجة مئوية فرن جو خامل نيتروجين
- فرن غاز خامل بالنيتروجين المتحكم فيه
- فرن أنبوبي مختبري بدرجة حرارة عالية 1400 درجة مئوية مع أنبوب ألومينا
يسأل الناس أيضًا
- كيف يؤثر نظام التحكم في الغلاف الجوي بالهيدروجين على تكوين المسام في الأنابيب الدقيقة النحاسية والنيكلية؟ رؤى الخبراء
- ما هما النوعان من الأجواء الطاردة للحرارة وتطبيقاتهما؟ شرح الأجواء الغنية مقابل الأجواء الخفيفة
- ما هي وظيفة فرن الغلاف الجوي عالي الحرارة في تفحم الكتلة الحيوية؟ قم بتحسين أبحاث الكربون الخاصة بك
- ما هي وظيفة فرن الغلاف الجوي المتحكم فيه عالي الدقة لسبائك 617؟ محاكاة ظروف VHTR القصوى
- ما هو الدور الذي يلعبه تدفق الغاز في الحفاظ على أجواء الأفران؟ التحكم الرئيسي للجودة والكفاءة
- ما هي أجواء فرن التلبيد؟ المفتاح لهندسة المواد بدقة
- ما الذي يستخدم كجو خامل للمستحضرات الصيدلانية؟ احمِ أدويتك بتغطية النيتروجين
- كيف يؤثر الاختزال الكيميائي للسيليكا أثناء التلبيد بالهيدروجين على المواد الحرارية للفرن؟ ضمان طول العمر مع البطانة المناسبة



















