التعريف والوظائف الأساسية للخلية التحليلية
جدول المحتويات
فهم دور الطاقة الكهربائية والطاقة الكيميائية في خلية التحليل الكهربائي
الخلية الكهروكيميائية الخلية الكهروكيميائية هي جهاز قادر إما على توليد الطاقة الكهربائية من التفاعلات الكيميائية أو تسهيل التفاعلات الكيميائية من خلال إدخال الطاقة الكهربائية.
تعريف الكيمياء الكهربية الكيمياء الكهربية هي دراسة العمليات الكيميائية التي تسبب حركة الإلكترونات. ويتناول التفاعل بين الطاقة الكهربائية والتغير الكيميائي.
مثال: دراسة الخلايا الكهروكيميائية تأتي في الكيمياء الكهربائية. ويتعامل مع الخلايا التي تحول الطاقة الكيميائية إلى طاقة كهربائية.
أهمية الكيمياء الكهربية تتعامل الكيمياء الكهربية مع العلاقات بين الظواهر الكهربائية والكيميائية. تستخدم العمليات الكهروكيميائية في مختلف فروع الصناعة. إنها العملية الأكثر أهمية لإنتاج العديد من المواد الكيميائية. يعتمد إنتاج المعادن المختلفة على الطريقة الكهروكيميائية. يتم تصنيع الهيدروجين عن طريق التحليل الكهربائي للماء. كما أنها تلعب دورًا رئيسيًا في تطوير السيارات الكهربائية.
وصف مكونات خلية التحليل الكهربائي بما في ذلك الأقطاب الكهربائية والكهارل
تتكون الخلايا الالكتروليتية من 3 مكونات أساسية.

الأنود هو القطب السالب أو المختزل الذي يطلق الإلكترونات إلى الدائرة الخارجية ويتأكسد أثناء التفاعل الكهروكيميائي.
الكاثود هو القطب الموجب أو المؤكسد الذي يكتسب الإلكترونات من الدائرة الخارجية ويتم تقليله أثناء التفاعل الكهروكيميائي.
المنحل بالكهرباء هو الوسيط الذي يوفر آلية النقل الأيوني بين الكاثود والأنود في الخلية. غالبًا ما يُنظر إلى الإلكتروليتات على أنها سوائل، مثل الماء أو المذيبات الأخرى، مع أملاح أو أحماض أو قلويات ذائبة مطلوبة للتوصيل الأيوني. ومع ذلك، تجدر الإشارة إلى أن العديد من البطاريات بما في ذلك البطاريات التقليدية (AA/AAA/D) تحتوي على إلكتروليتات صلبة تعمل كموصلات أيونية في درجة حرارة الغرفة.
اعتبارات في اختيار الكاثود والأنود والكهارل
الخصائص المرغوبة للمواد الأنود والكاثود والكهارل مذكورة أدناه.
شرح عملية انتقال الشحنات بين الأقطاب الكهربائية والأيونات
الخلية التحليلية، أي جهاز يتم من خلاله تحويل الطاقة الكهربائية إلى طاقة كيميائية، أو العكس. تتكون هذه الخلية عادةً من موصلين معدنيين أو إلكترونيين (أقطاب كهربائية) منفصلين عن بعضهما البعض وعلى اتصال مع المنحل بالكهرباء (qv)، وهو عادة مركب أيوني مذاب أو منصهر. توصيل الأقطاب الكهربائية بمصدر للتيار الكهربائي المباشر يجعل أحدهما سالبًا والآخر موجبًا. تهاجر الأيونات الموجبة الموجودة في الإلكتروليت إلى القطب السالب (الكاثود) وهناك تتحد مع إلكترون واحد أو أكثر، وتفقد جزءًا أو كل شحنتها وتصبح أيونات جديدة ذات شحنة أقل أو ذرات أو جزيئات محايدة؛ وفي الوقت نفسه، تهاجر الأيونات السالبة إلى القطب الموجب (الأنود) وتنقل إليه إلكترونًا واحدًا أو أكثر، لتصبح أيضًا أيونات جديدة أو جسيمات محايدة. التأثير الإجمالي للعمليتين هو نقل الإلكترونات من الأيونات السالبة إلى الأيونات الموجبة، وهو تفاعل كيميائي (انظر تفاعل الأكسدة والاختزال). ومن الأمثلة على ذلك التحليل الكهربائي لكلوريد الصوديوم (الملح العادي)، وتشكيل معدن الصوديوم وغاز الكلور؛ يتم توفير الطاقة اللازمة لمواصلة التفاعل عن طريق التيار الكهربائي. تشمل التطبيقات الشائعة الأخرى للتحليل الكهربائي الترسيب الكهربي لتكرير أو طلاء المعادن وإنتاج الصودا الكاوية.
ما هي خلية التحليل الكهربائي؟ يمكن تعريف الخلية الإلكتروليتية بأنها جهاز كهروكيميائي يستخدم الطاقة الكهربائية لتسهيل تفاعل الأكسدة والاختزال غير التلقائي. الخلايا التحليلية هي خلايا كهروكيميائية يمكن استخدامها للتحليل الكهربائي لبعض المركبات. على سبيل المثال، يمكن إخضاع الماء للتحليل الكهربائي (بمساعدة خلية التحليل الكهربائي) لتكوين الأكسجين الغازي والهيدروجين الغازي. ويتم ذلك عن طريق استخدام تدفق الإلكترونات (في بيئة التفاعل) للتغلب على حاجز طاقة التنشيط لتفاعل الأكسدة والاختزال غير التلقائي.


المكونات الثلاثة الأساسية للخلايا الإلكتروليتية هي: الكاثود (الذي يكون مشحونًا سلبًا للخلايا الإلكتروليتية) الأنود (الذي يكون مشحونًا بشكل إيجابي للخلايا الإلكتروليتية) المنحل بالكهرباء يوفر الإلكتروليت الوسط لتبادل الإلكترونات بين الكاثود والأنود. تشمل الإلكتروليتات شائعة الاستخدام في الخلايا الإلكتروليتية الماء (الذي يحتوي على أيونات مذابة) وكلوريد الصوديوم المنصهر.
الخلايا الكهربية لتعريف الخلايا الكهربية، نحتاج أولًا إلى فهم التحليل الكهربي. التحليل الكهربائي هو طريقة تنطوي على تمرير تيار كهربائي عبر سائل يحتوي على أيونات، مما يؤدي إلى تفكك المركبات الموجودة بداخله. يُستخدم هذا لعزل المعدن عن العناصر المعدنية، وفصل المواد الكيميائية الأخرى (مثل الماء) والمعادن المسطحة بالكهرباء، وإعادة شحن البطاريات. الدائرة الكاملة ضرورية للحفاظ على عملية التحليل الكهربائي. نحن بحاجة إلى أن نكون قادرين على سحب الكهرباء من الخلية باستمرار.
يتم توصيل الكاثود والأنود في الخلية الإلكتروليتية بمصدر طاقة. تم العثور على هذين القطبين المستقرين ومحلول إلكتروليت سائل في كل خلية إلكتروليتية. يوصل محلول الإلكتروليت الكهرباء لأن الأيونات الذائبة يمكن أن تتحرك بحرية في المحلول.
الخلية الإلكتروليتية ومكوناتها تتكون الخلية الإلكتروليتية من ثلاثة مكونات رئيسية – البطارية والأقطاب الكهربائية والإلكتروليت. البطارية تعمل البطارية كمصدر للطاقة. فهو يوفر الطاقة الكهربائية اللازمة لإحداث التغير الكيميائي، أي تحلل المركب الأيوني. الأقطاب الكهربائية هي نقاط اتصال كهربائية تعمل على إغلاق أو إكمال الدائرة الكهربائية بين الأسلاك والكهارل. تشمل أمثلة الأقطاب الكهربائية قضبان الكربون (الجرافيت) والألواح المعدنية. القطب الموجود على اليسار (راجع الصورة أعلاه) المتصل بالطرف الموجب للبطارية هو القطب الموجب أو الأنود. القطب الموجود على اليمين المتصل بالطرف السالب للبطارية هو القطب السالب أو الكاثود. المنحل بالكهرباء الإلكتروليت هو مادة تحتوي على أيونات متنقلة عند صهرها أو في محلول مائي لتوصيل الكهرباء. تشمل أمثلة الإلكتروليتات كلوريد الصوديوم المنصهر، ومحلول كبريتات النحاس (II) والأحماض، مثل حمض الهيدروكلوريك المخفف. تشمل أمثلة غير الإلكتروليتات محلول السكر، والإيثانول، والكبريت (المصهور)، حيث إنها سوائل أو محاليل لا تحتوي على أيونات متحركة لتوصيل الكهرباء.

التطبيقات غالبًا ما تُستخدم الخلايا التحليلية لتحليل المركبات الكيميائية، في عملية تسمى التحليل الكهربائي - حيث تعني كلمة "كهرباء" كهرباء، وتعني الكلمة اليونانية "تحلل" التفتيت. ومن الأمثلة المهمة على التحليل الكهربائي تحلل الماء إلى هيدروجين وأكسجين، والبوكسيت إلى ألومنيوم ومواد كيميائية أخرى. يتم إجراء الطلاء الكهربائي (على سبيل المثال، النحاس أو الفضة أو النيكل أو الكروم) باستخدام خلية التحليل الكهربائي. التحليل الكهربائي هو تقنية تستخدم التيار الكهربائي المباشر (DC).
تجاريًا، تُستخدم الخلايا الإلكتروليتية في التنقية الكهربائية والاستخلاص الكهربي للعديد من المعادن غير الحديدية. يتم إنتاج معظم الألومنيوم والنحاس والزنك والرصاص عالي النقاء صناعيًا في خلايا التحليل الكهربائي.
خلية إلكتروليتية المكونات الثلاثة للخلايا الإلكتروليتية هي إلكتروليت وقطبين كهربائيين.
الإلكتروليتات الإلكتروليتات هي المواد التي تعطي محلولًا موصلًا للكهرباء عند إذابتها في المذيبات القطبية، مثل الماء. وذلك لأنه عندما يذوب الإلكتروليت في المذيبات القطبية، فإنه ينقسم إلى كاتيونات وأنيونات ويتم توزيعه بشكل موحد في جميع أنحاء المحلول. تنتقل هذه الكاتيونات والأنيونات تحت جهد كهربائي في المحلول إلى القطب مع وفرة من الإلكترونات ونقص في الإلكترونات، على التوالي. إن حركة الكاتيونات والأنيونات في الاتجاه المعاكس لبعضها البعض تولد تيارًا وتشكل الخلايا الإلكتروليتية.
في حين أن الأملاح والأحماض والقواعد تشكل إلكتروليتًا، إلا أن القليل من الغازات في ظل ظروف معينة يمكن أن تتصرف أيضًا مثل المنحل بالكهرباء، مثل كلوريد الهيدروجين عند درجة حرارة عالية وضغط منخفض.
التفاعلات الكيميائية في خلية التحليل الكهربائي
شرح تفاعل الأكسدة والاختزال في خلية التحليل الكهربائي
في الخلايا الكهروكيميائية، تحدث تفاعلات الأكسدة والاختزال (الأكسدة). هناك نوعان من الخلايا الكهروكيميائية: الخلايا الجلفانية (الفولتية)، حيث تحدث التفاعلات التلقائية، والخلايا التحليلية، حيث تحدث التفاعلات غير التلقائية.
يحتوي كلا النوعين من الخلايا على أقطاب كهربائية حيث تحدث تفاعلات الأكسدة والاختزال. تحدث الأكسدة عند القطب المسمى الأنود، ويحدث الاختزال عند القطب المسمى الكاثود.
في الخلية الإلكتروليتية، يكون الأنود موجبًا والكاثود سالبًا. وذلك لأن الأنود يجذب الأنيونات من المحلول. من ناحية أخرى، في الخلية الجلفانية، يكون الأنود مشحونًا بشحنة سالبة، حيث أن الأكسدة التلقائية عند الأنود هي مصدر إلكترونات الخلية أو الشحنة السالبة. الكاثود في الخلية الجلفانية هو طرفها الموجب.
مثال على التحليل الكهربائي لكلوريد الصوديوم
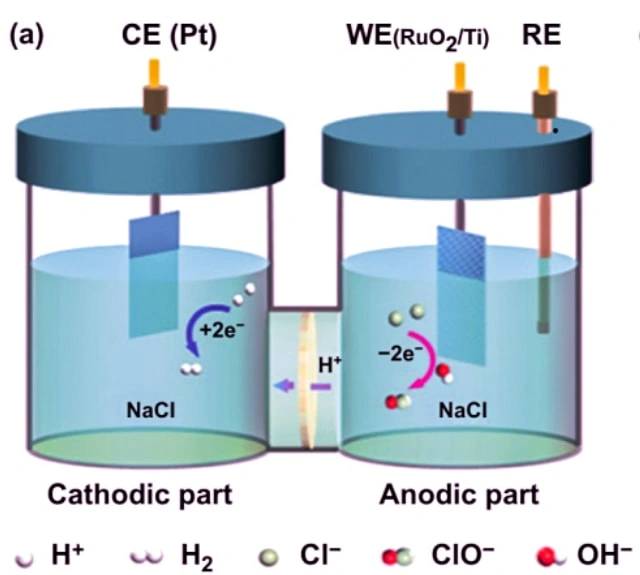
أحد الأمثلة على خلية التحليل الكهربائي هو التحليل الكهربائي لكلوريد الصوديوم. عند إذابة كلوريد الصوديوم في الماء وإخضاعه للتحليل الكهربائي تحدث التفاعلات التالية:
عند الكاثود: 2 H2O + 2 e- -> 2 OH- + H2
عند الأنود: 2 Cl- -> Cl2 + 2 e-
التفاعل الكلي: 2 NaCl + 2 H2O -> 2 Na + Cl2 + H2 + 2 OH-
في هذه الخلية الإلكتروليتية، يتم غمر قطبين كهربائيين خاملين في كلوريد الصوديوم المنصهر. عندما يمر تيار كهربائي عبر الدائرة، يصبح الكاثود غنيًا بالإلكترونات ويطور شحنة سالبة. تنجذب أيونات الصوديوم الموجبة إلى الكاثود، مما يؤدي إلى تكوين معدن الصوديوم. وفي الوقت نفسه، تنجذب ذرات الكلور إلى القطب الموجب الشحنة، مما يؤدي إلى تكوين غاز الكلور. والنتيجة الإجمالية هي إنتاج معدن الصوديوم وغاز الكلور وهيدروكسيد الصوديوم المائي.
تطبيقات الخلايا الالكتروليتية
الخلايا الالكتروليتية لها تطبيقات مختلفة:
- إنتاج غاز الأكسجين وغاز الهيدروجين من الماء.
- استخراج الألمنيوم من البوكسيت.
- الطلاء الكهربائي، والذي يتضمن تشكيل طبقة واقية رقيقة من معدن معين على سطح معدن آخر.
- المعالجة الكهربائية للمعادن غير الحديدية.
- عمليات الاسترداد كهربائيا.
- يتم الإنتاج الصناعي للنحاس عالي النقاء والزنك عالي النقاء والألومنيوم عالي النقاء دائمًا تقريبًا من خلال الخلايا التحليلية.
![تطبيق الخلايا الالكتروليتية (الزنك عالي النقاء، الألومنيوم عالي النقاء، النحاس عالي النقاء)]()
تطبيق الخلايا الالكتروليتية (الزنك عالي النقاء، الألومنيوم عالي النقاء، النحاس عالي النقاء)
تلعب الخلايا التحليلية دورًا حاسمًا في مختلف الصناعات والعمليات، مما يتيح إنتاج مواد كيميائية ومواد مهمة.
تطبيقات التحليل الكهربائي
استخدام التحليل الكهربائي في الترسيب الكهربائي لتكرير أو طلاء المعادن
يستخدم التحليل الكهربائي على نطاق واسع في عملية الترسيب الكهربائي لتكرير أو طلاء المعادن. أحد التطبيقات العملية للتحليل الكهربائي في هذا السياق هو التنظيف الكهربائي. في التنظيف الكهربائي، يتم تصنيع المادة المراد تنظيفها، مثل الزنك أو الألومنيوم، كاثود، ويتم تمرير تيار ثقيل عبر محلول إلكتروليت. يتم إنتاج الصودا الكاوية والهيدروجين عند الكاثود، مما يزيل الشحوم والشوائب بشكل فعال من سطح المادة. يمكن استخدام هذه العملية لتنقية أو طلاء المعادن، مما يوفر مظهرًا نظيفًا ولامعًا، ويحمي من التآكل، ويستبدل المواد البالية.
إنتاج الصودا الكاوية عن طريق التحليل الكهربائي
هناك تطبيق آخر مهم للتحليل الكهربائي وهو إنتاج المواد الكيميائية، بما في ذلك الصودا الكاوية (NaOH) وغاز الكلور، على نطاق واسع. في هذه العملية، يتم استخدام التحليل الكهربائي لتحطيم كلوريد الصوديوم (NaCl) إلى العناصر المكونة له، الصوديوم (Na) والكلور (Cl2). يتضمن التفاعل عند الكاثود اختزال أيونات الصوديوم (Na+) إلى الصوديوم المعدني (Na)، بينما عند الأنود، تتأكسد أيونات الكلوريد (Cl-) لتكوين غاز الكلور (Cl2). رد الفعل الكلي للخلية هو 2NaCl → 2Na + Cl2. ومن خلال هذه العملية التحليلية الكهربائية، يمكن إنتاج كميات كبيرة من الصودا الكاوية وغاز الكلور لمختلف التطبيقات الصناعية.
التحليل الكهربائي في استخراج المعادن
يلعب التحليل الكهربائي دورًا حاسمًا في استخلاص المعادن من خاماتها. هناك طريقتان أساسيتان لاستخراج المعادن باستخدام التحليل الكهربائي. في الطريقة الأولى، تتم معالجة الخام بحمض قوي للحصول على الملح، ويتم تحليل المحلول الملحي الناتج كهربائيا لتحرير المعدن. في الطريقة الثانية، يكون الخام في حالة منصهرة ويتم تحليله كهربائيًا مباشرة في الفرن.
أحد الأمثلة على استخراج المعادن باستخدام التحليل الكهربائي هو استخراج الزنك. تتم معالجة خام الزنك بحمض الكبريتيك لتكوين محلول كبريتات الزنك، والذي يتم بعد ذلك تحليله كهربيًا. في خزان التحليل الكهربائي، يتم استخدام كاثودات الألومنيوم وأنودات الرصاص. يتم ترسيب الزنك على الكاثودات، في حين يتم تجديد حمض الكبريتيك في الأنودات. تسمح هذه العملية التحليلية باستخلاص الزنك عالي النقاء.
وبالمثل، يستخدم التحليل الكهربائي أيضًا في استخلاص الألومنيوم من البوكسيت. يذوب البوكسيت، وهو خام الألومنيوم، في الكريوليت المنصهر ويخضع للتحليل الكهربائي. يتم تقليل أيونات الألومنيوم عند الكاثود، لتكوين الألومنيوم المعدني، بينما يتم إنتاج غاز الأكسجين عند القطب الموجب. تتيح هذه العملية إنتاج الألومنيوم عالي النقاء.

وبشكل عام، يجد التحليل الكهربائي تطبيقات عملية في مختلف الصناعات لاستخراج المعادن وتكريرها وطلاءها، وكذلك إنتاج المواد الكيميائية مثل الصودا الكاوية. ومن خلال تسخير قوة التحليل الكهربائي، يمكن للشركات تحقيق نتائج عالية الجودة وتلبية متطلبات الصناعات الخاصة بها.
تحويل الطاقة الكيميائية إلى كهرباء
شرح توليد الطاقة في التفاعلات التي تتضمن مواد تولد الطاقة
في الخلايا الكهروكيميائية، يتم تحويل الطاقة الكيميائية إلى طاقة كهربائية من خلال عملية تسمى التحليل الكهربائي. التحليل الكهربائي هو تفاعل الأكسدة والاختزال الذي يحدث في الخلية الكهروكيميائية، حيث تتحلل المواد الكيميائية في الأقطاب الكهربائية. تعتمد منتجات التحليل الكهربائي على نوع القطب الكهربائي والكهارل المستخدم في الخلية. هذه العملية هي الأساس لمختلف التطبيقات في الكيمياء الكهربائية.
يتضمن مجال الكيمياء الكهربية إنتاج الكهرباء من الطاقة المنطلقة أثناء التفاعلات الكيميائية التلقائية، بالإضافة إلى استخدام الطاقة الكهربائية لتحفيز التغيرات الكيميائية غير التلقائية. وتفاعلات الأكسدة والاختزال، التي تنطوي على نقل الإلكترونات بين الأنواع، هي جوهر هذه العمليات. العديد من التفاعلات الكيميائية والبيولوجية هي تفاعلات الأكسدة والاختزال، وتلعب دورًا حاسمًا في الحصول على الطاقة للأغراض المنزلية أو النقل أو الصناعية.
وتستخدم الطاقة المتولدة في هذه التفاعلات في نطاق واسع من التطبيقات، بما في ذلك حرق الوقود لهضم الطعام لدى الحيوانات، والعمليات الصناعية، والتمثيل الضوئي، واستخلاص المعادن من الخامات، وتصنيع المواد الكيميائية المهمة، وتشغيل البطاريات وخلايا الوقود.
مثال على بطارية تخزين الرصاص الحمضية
أحد الأمثلة على تحويل الطاقة الكيميائية إلى كهرباء هو بطارية تخزين الرصاص الحمضية. يُستخدم هذا النوع من البطاريات بشكل شائع كمصدر للطاقة في المركبات. وتتكون من خلايا كهروكيميائية متعددة متصلة ببعضها البعض.

تعمل بطارية الرصاص الحمضية كخلية إلكتروليتية وخلية كلفانية. عند التفريغ، تعمل كخلية كلفانية، حيث تحول الطاقة الكيميائية إلى طاقة كهربائية. أثناء عملية التفريغ، يتفاعل ثاني أكسيد الرصاص ومعدن الرصاص وحمض الكبريتيك لتكوين كبريتات الرصاص والماء. تحدث أكسدة الرصاص إلى كبريتات الرصاص عند أحد القطبين، بينما يحدث اختزال ثاني أكسيد الرصاص إلى كبريتات الرصاص عند القطب الآخر. يتم نقل الشحنة الكهربائية من خلال المنحل بالكهرباء عن طريق هجرة أيونات الهيدروجين.
يؤدي هذا الفصل بين عمليتي الأكسدة والاختزال إلى إنشاء قوة دافعة، أو جهد كهربائي، يتسبب في تدفق الكهرباء عبر دائرة خارجية تربط القطبين الكهربائيين. تم استخدام العديد من التركيبات الكيميائية الأخرى في الخلايا والبطاريات، ولكل منها تفاعلاتها وخصائصها الخاصة.
خلايا الوقود
خلايا الوقود هي نوع آخر من الخلايا الكهروكيميائية التي تحول الطاقة الكيميائية للوقود إلى كهرباء. تعمل هذه الخلايا من خلال تفاعل كهروكيميائي بين وقود الهيدروجين وعامل مؤكسد، عادة الأكسجين. على عكس البطاريات، التي تولد الطاقة من المواد الكيميائية المملوءة بالفعل داخلها، تتطلب خلايا الوقود تدفقًا مستمرًا للأكسجين وإمدادات من الوقود لتوليد الكهرباء.
تم استخدام خلايا الوقود تجاريًا من قبل وكالة ناسا لتوليد الطاقة للكبسولات الفضائية والأقمار الصناعية. إنها توفر مزايا من حيث الكفاءة الديناميكية الحرارية، حيث أنها تتجنب خسائر دورة كارنو. ومع ذلك، لا تزال تكنولوجيا خلايا الوقود الحالية تواجه تحديات من حيث الكفاءة والموثوقية بشكل عام. أحد القيود هو عدم القدرة على استخدام الهيدروكربونات مباشرة، الأمر الذي يتطلب خطوة معالجة لتحويل الوقود الشائع إلى هيدروجين. بالإضافة إلى ذلك، يعد تحفيز تقليل الأكسجين عملية معقدة.

باختصار، يعد تحويل الطاقة الكيميائية إلى كهرباء عملية أساسية في الكيمياء الكهربائية. ويحدث ذلك من خلال تفاعلات الأكسدة والاختزال في الخلايا الكهروكيميائية، مثل بطاريات تخزين الرصاص الحمضية وخلايا الوقود. ولهذه التقنيات تطبيقات مختلفة، بدءًا من تشغيل المركبات وحتى توليد الكهرباء لاستكشاف الفضاء.
الخلايا البديلة لتوليد الكهرباء
فهم الخلايا الشمسية ودور أشباه الموصلات وامتصاص الضوء
- السيليكون غير المتبلور (A-Si) هو مادة كهروضوئية رقيقة مهيمنة تتمتع بقدرة امتصاص خفيفة تبلغ حوالي 40 مرة ضعف السيليكون البلوري.
- تيلوريد الكادميوم (CdTe) هو مادة أخرى ذات أغشية رقيقة ذات امتصاص عالي للضوء. يمكنه امتصاص 90% من الطيف الشمسي بطبقة رقيقة يبلغ سمكها 1 مم فقط.
- إن ثنائي سيلينيد الإنديوم النحاسي (CIGS) عبارة عن مادة شبه موصلة حققت كفاءة عالية في الخلايا الكهروضوئية، حيث وصلت كفاءة الوحدات التجارية إلى 14% أو أكثر.

شرح خلايا الوقود واستخدامها للعوامل المؤكسدة وعوامل الاختزال
- خلايا الوقود هي خلايا كهروكيميائية تتفاعل مع وقود الهيدروجين مع الأكسجين أو أي عامل مؤكسد آخر لتحويل الطاقة الكيميائية إلى كهرباء.
- وهي تختلف عن البطاريات لأنها تتطلب مصدرًا مستمرًا للوقود والأكسجين للحفاظ على التفاعل الكيميائي.
- يمكن لخلايا الوقود إنتاج الكهرباء بشكل مستمر طالما يتم توفير الوقود والأكسجين.
- يتم استخدامها للطاقة الأولية والاحتياطية في مختلف التطبيقات، بما في ذلك المباني التجارية والصناعية والسكنية والمناطق النائية.
- تُستخدم خلايا الوقود أيضًا لتشغيل مركبات خلايا الوقود مثل الرافعات الشوكية والسيارات والحافلات والقوارب والدراجات النارية والغواصات.
- ومن المتوقع أن ينمو سوق خلايا الوقود العالمي بنسبة 19.9% بحلول عام 2030.
خلايا أخرى لتوليد الكهرباء
- تولد الخلايا الشمسية الكهرباء من خلال امتصاص الضوء بواسطة أشباه الموصلات.
- تستخدم خلايا الوقود الطاقة الكيميائية من الوقود لتوليد الكهرباء.
- يمكن استخدام الخلايا القابلة لإعادة الشحن عدة مرات عن طريق إعادة شحنها.
- لا يمكن إعادة استخدام الخلايا غير القابلة لإعادة الشحن ويجب التخلص منها.
- بطاريات تخزين الرصاص الحمضية/الرصاص هي خلايا ثانوية تستخدم كمصدر للطاقة في المركبات.
- توفر الخلايا ذات الأغشية الرقيقة، مثل الخلايا الشمسية ذات الأغشية الرقيقة، وترانزستورات الأغشية الرقيقة، وبطاريات الأغشية الرقيقة، كفاءة محسنة، وشحنًا أسرع، وعمرًا أطول مقارنة بالخلايا التقليدية.
إن مجال الخلايا البديلة لتوليد الكهرباء يتطور باستمرار. يواصل الباحثون تحسين كفاءة وخصائص مواد الأغشية الرقيقة، بينما يعمل خبراء الصناعة على تقليل التكاليف وزيادة الإنتاج.
إذا كنت مهتمًا بهذا المنتج، يمكنك تصفح موقع شركتنا: https://kindle-tech.com/products/h-type-electrolytic-cell-h-type-triple ، فنحن نصر دائمًا على مبدأ الجودة أولاً. أثناء عملية الإنتاج، نحن نتحكم بشكل صارم في كل خطوة من العملية، وذلك باستخدام مواد عالية الجودة وتكنولوجيا إنتاج متقدمة لضمان استقرار ومتانة منتجاتنا. للتأكد من أن أدائهم يلبي أعلى المعايير. نحن نؤمن أنه فقط من خلال تزويد العملاء بالجودة الممتازة يمكننا كسب ثقتهم وتعاونهم على المدى الطويل.
المنتجات ذات الصلة
- خلية التحليل الكهربائي من النوع H خلية كهروكيميائية ثلاثية
- خلية كهروكيميائية بالتحليل الكهربائي لتقييم الطلاء
- خلية التحليل الكهربائي الطيفي بالطبقة الرقيقة
- حمام مائي متعدد الوظائف للخلية الكهروكيميائية بطبقة واحدة أو مزدوجة
- قطب صفيحة البلاتين للتطبيقات المختبرية والصناعية

















