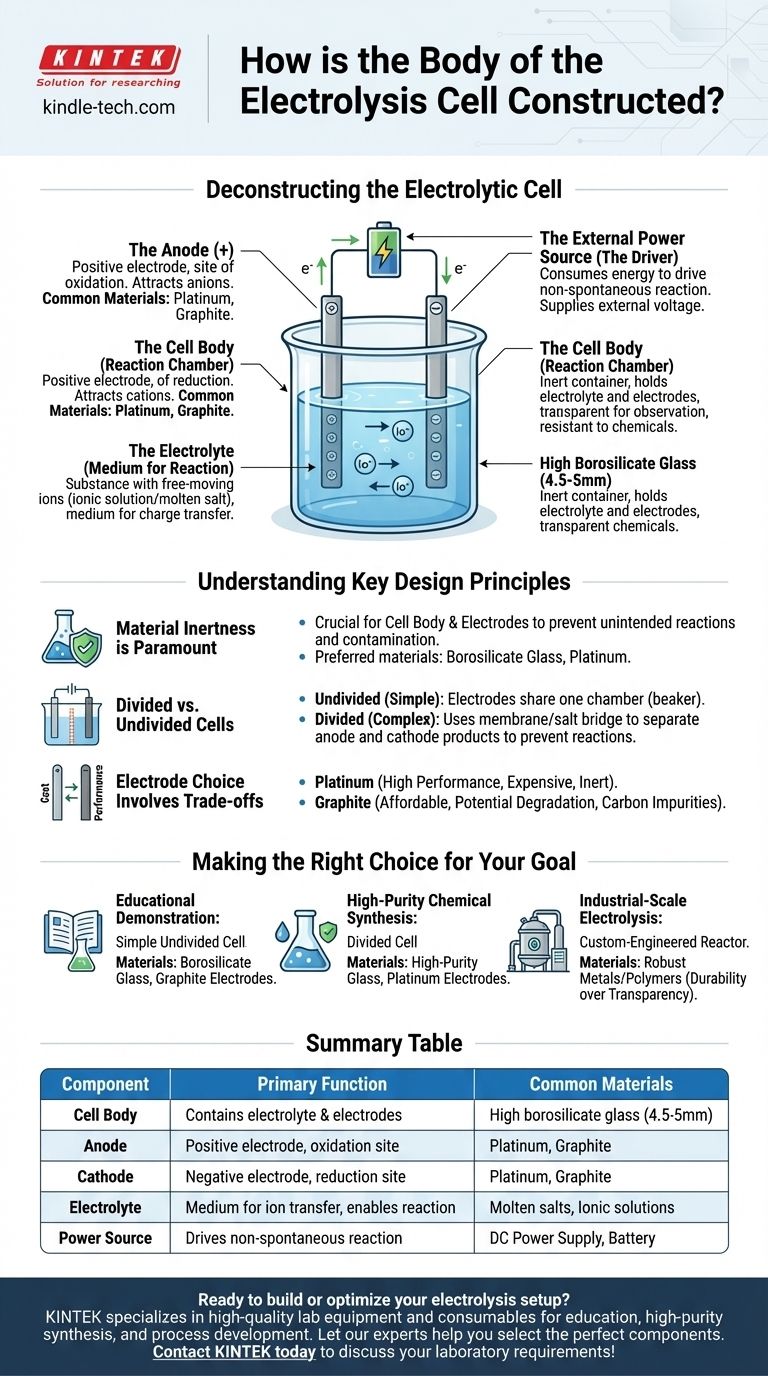
للتطبيقات المخبرية، يتم بناء جسم خلية التحليل الكهربائي عادةً من زجاج البورسليكات العالي، وغالبًا بسماكة جدار تتراوح بين 4.5 إلى 5 مم. يتم اختيار هذه المادة لخاصيتها الخاملة كيميائيًا ومقاومتها الحرارية. ومع ذلك، فإن الوعاء المادي هو مجرد جزء واحد من نظام أكبر مصمم لدفع تفاعل كيميائي باستخدام الكهرباء.
جسم الخلية هو مجرد وعاء خامل. يتم تحديد الوظيفة الحقيقية للخلية الكهروكيميائية من خلال مكوناتها الداخلية الأساسية الثلاثة: قطبان (أنود وكاثود)، وإلكتروليت يحتوي على أيونات متحركة، ومصدر طاقة خارجي لدفع التفاعل.

تفكيك الخلية الكهروكيميائية
لفهم بناء الخلية، يجب أن تنظر إلى ما وراء الوعاء المادي وتحليل المكونات الوظيفية التي يحتويها. الخلية الكهروكيميائية هي نظام متكامل يلعب فيه كل جزء دورًا حاسمًا في عملية التحليل الكهربائي.
جسم الخلية (حجرة التفاعل)
الوظيفة الأساسية للجسم هي احتواء الإلكتروليت وتثبيت الأقطاب الكهربائية في مكانها دون التدخل في التفاعل الكيميائي.
يُعد زجاج البورسليكات العالي مادة شائعة لأنه شفاف، مما يسمح بالمراقبة، ومقاوم للغاية للتآكل الناتج عن المواد الكيميائية العدوانية غالبًا ما تستخدم كإلكتروليتات. للتطبيقات المحددة، يمكن استخدام مواد خاملة أخرى مثل بعض البوليمرات.
الأقطاب الكهربائية (الأنود والكاثود)
الأقطاب الكهربائية هي الموصلات التي تدخل الطاقة الكهربائية إلى النظام. تحتوي الخلية الكهروكيميائية دائمًا على قطبين.
- الأنود هو القطب الموجب. يجذب الأيونات سالبة الشحنة (الأنيونات) وهو المكان الذي يحدث فيه الأكسدة.
- الكاثود هو القطب السالب. يجذب الأيونات موجبة الشحنة (الكاتيونات) وهو المكان الذي يحدث فيه الاختزال.
عادة ما تكون هذه مصنوعة من مواد خاملة، مثل البلاتين أو الجرافيت، والتي توصل الكهرباء جيدًا ولكنها لا تشارك بسهولة في التفاعل الكيميائي بحد ذاتها.
الإلكتروليت (وسط التفاعل)
الإلكتروليت هو المادة التي تحتوي على أيونات حرة الحركة وتملأ جسم الخلية. إنه الوسط الذي يتم من خلاله نقل الشحنة بين الأقطاب الكهربائية.
يمكن أن تكون الإلكتروليتات عبارة عن مركب أيوني مذاب في مذيب (مثل الملح في الماء) أو مركب أيوني مصهور (مثل كلوريد الصوديوم المصهور). الأيونات المحددة الموجودة داخل الإلكتروليت هي التي سيتم أكسدتها أو اختزالها أثناء التحليل الكهربائي.
مصدر الطاقة الخارجي (المُحرك)
على عكس البطارية التي تنتج الطاقة، تستهلك الخلية الكهروكيميائية الطاقة لإجبار تفاعل غير تلقائي على الحدوث.
يتم توفير هذه الطاقة بواسطة مصدر طاقة خارجي، مثل بطارية أو مصدر طاقة تيار مستمر (DC)، يتم توصيله بالأنود والكاثود. هذا الجهد الخارجي هو ما يدفع الإلكترونات عبر الدائرة ويدفع الأيونات إلى أقطابها المعنية.
فهم مبادئ التصميم الرئيسية
يسترشد بناء الخلية الكهروكيميائية بمبادئ أساسية تضمن عملها بشكل صحيح. قد يؤدي سوء فهم هذه المبادئ إلى فشل التجارب أو العمليات غير الفعالة.
الخمول المادي أمر بالغ الأهمية
المبدأ الأكثر أهمية لجسم الخلية والأقطاب الكهربائية هو الخمول الكيميائي. يجب ألا يتفاعل الوعاء والموصلات الكهربائية مع الإلكتروليت. أي تفاعل غير مقصود يمكن أن يلوث المنتجات ويعطل العملية الكهروكيميائية المطلوبة. هذا هو السبب في تفضيل المواد المتخصصة مثل زجاج البورسليكات والبلاتين على الزجاج العادي أو المعادن التفاعلية.
الخلايا المقسمة مقابل غير المقسمة
أبسط تصميم للخلية هو خلية "غير مقسمة"، حيث يتشارك كلا القطبين في إلكتروليت مشترك في حجرة واحدة، مثل كوب زجاجي.
ومع ذلك، في بعض الأحيان يمكن للمنتجات المتكونة عند الأنود والكاثود أن تتفاعل مع بعضها البعض. في هذه الحالات، يتم استخدام خلية "مقسمة". يتضمن هذا التصميم غشاءًا مساميًا أو جسرًا ملحيًا لفصل الخلية إلى نصفين متميزين، مع الحفاظ على المنتجات معزولة مع السماح للأيونات بالتدفق بين الحجرات.
اختيار القطب الكهربائي ينطوي على مفاضلات
على الرغم من أن كلاهما شائع، فإن الاختيار بين أقطاب البلاتين والجرافيت ينطوي على مفاضلة كلاسيكية بين التكلفة والأداء.
البلاتين خامل وفعال للغاية ولكنه باهظ الثمن. الجرافيت موصل أرخص بكثير ولكنه قد يتدهور أو يتفاعل في ظل ظروف معينة، خاصة عند الجهود العالية أو مع إلكتروليتات محددة، مما قد يؤدي إلى إدخال شوائب الكربون في النظام.
اتخاذ الخيار الصحيح لهدفك
يعتمد البناء الأمثل للخلية الكهروكيميائية بالكامل على تطبيقها المقصود.
- إذا كان تركيزك الأساسي هو العرض التعليمي: كوب زجاجي بسيط غير مقسم مصنوع من زجاج البورسليكات مع أقطاب جرافيت غير مكلفة كافٍ تمامًا وفعال من حيث التكلفة.
- إذا كان تركيزك الأساسي هو تخليق كيميائي عالي النقاوة: من الضروري استخدام خلية مقسمة مصنوعة من زجاج عالي النقاء مع أقطاب بلاتين خاملة ومستقرة لمنع تلوث المنتج والتفاعلات الجانبية.
- إذا كان تركيزك الأساسي هو التحليل الكهربائي على نطاق صناعي: ستكون الخلية عبارة عن مفاعل متخصص للغاية ومصمم حسب الطلب، وغالبًا ما يكون مصنوعًا من معادن أو بوليمرات قوية مصممة للمتانة والكفاءة والتشغيل المستمر بدلاً من الشفافية.
إن فهم هذه المكونات الأساسية ووظائفها يمكّنك من اختيار أو تصميم خلية تتطابق تمامًا مع هدفك.
جدول ملخص:
| المكون | الوظيفة الأساسية | المواد الشائعة |
|---|---|---|
| جسم الخلية | يحتوي على الإلكتروليت والأقطاب الكهربائية | زجاج البورسليكات العالي (4.5-5 مم) |
| الأنود | القطب الموجب؛ موقع الأكسدة | البلاتين، الجرافيت |
| الكاثود | القطب السالب؛ موقع الاختزال | البلاتين، الجرافيت |
| الإلكتروليت | وسط لنقل الأيونات؛ يُمكّن التفاعل | الأملاح المنصهرة، المحاليل الأيونية |
| مصدر الطاقة | يدفع التفاعل غير التلقائي | مصدر طاقة تيار مستمر، بطارية |
هل أنت مستعد لبناء أو تحسين إعداد التحليل الكهربائي الخاص بك؟ يعد بناء الخلية الصحيح أمرًا بالغ الأهمية لنجاح مختبرك، سواء كان ذلك للتعليم أو التخليق عالي النقاء أو تطوير العمليات. تتخصص KINTEK في توفير المعدات والمواد الاستهلاكية المخبرية عالية الجودة التي تحتاجها - بدءًا من الأواني الزجاجية المتينة من البورسليكات وحتى أقطاب البلاتين والجرافيت الخاملة. دع خبرائنا يساعدونك في اختيار المكونات المثالية لتطبيقك المحدد. اتصل بـ KINTEK اليوم لمناقشة متطلبات مختبرك!
دليل مرئي
المنتجات ذات الصلة
- خلية تحليل كهربائي مزدوجة الطبقة بخمسة منافذ وحمام مائي
- خلية كهروكيميائية كهروكيميائية كوارتز للتجارب الكهروكيميائية
- خلية التحليل الكهربائي البصري مزدوجة الطبقة من النوع H مع حمام مائي
- خلايا التحليل الكهربائي PEM قابلة للتخصيص لتطبيقات بحثية متنوعة
- خلية تحليل كهربائي مزدوجة الطبقة بحمام مائي
يسأل الناس أيضًا
- ما هو الهيكل العام لخلية التحليل الكهربائي بحوض مائي بصري مزدوج الطبقة من النوع H؟ تصميم دقيق للتجارب الخاضعة للرقابة
- ما هي الأحجام وتكوينات الفتحات النموذجية لخلية تحليل كهربائي مزدوجة الطبقة بحمام مائي؟ حسّن إعدادك الكهروكيميائي
- ما هو النظام التجريبي النموذجي المستخدم مع خلية التحليل الكهربائي ذات الحمام المائي المزدوج الطبقة؟ تحقيق تحكم كهروكيميائي دقيق
- كيف يمكن التحكم في التفاعل الكهروكيميائي عند استخدام هذه الخلية التحليلية؟ التحكم في الجهد والتيار والإلكتروليت
- ما هي الميزات الرئيسية لخلية التحليل الكهربائي ذات الحمام المائي مزدوج الطبقة؟ حقق تحكمًا دقيقًا في درجة الحرارة لتجاربك



















