في أي نظام كهروكيميائي، أهم احتياطين حاسمين هما ضمان قطبية القطب الصحيحة واختيار الإلكتروليت المناسب لتفاعلك. تحدد القطبية العملية الكيميائية التي تحدث أين، بينما يوفر الإلكتروليت الوسط الضروري لتلك العملية. أي خطأ في أحدهما يمكن أن يؤدي إلى تجارب فاشلة، أو تلف المعدات، أو مخاطر سلامة كبيرة.
تحدد قطبية أقطابك اتجاه التفاعل الكيميائي، ويحدد الإلكتروليت مدى جدواه. أي عدم تطابق بينهما سيغير العملية الكهروكيميائية المقصودة بشكل جذري، أو يثبطها، أو يفسدها بنشاط.
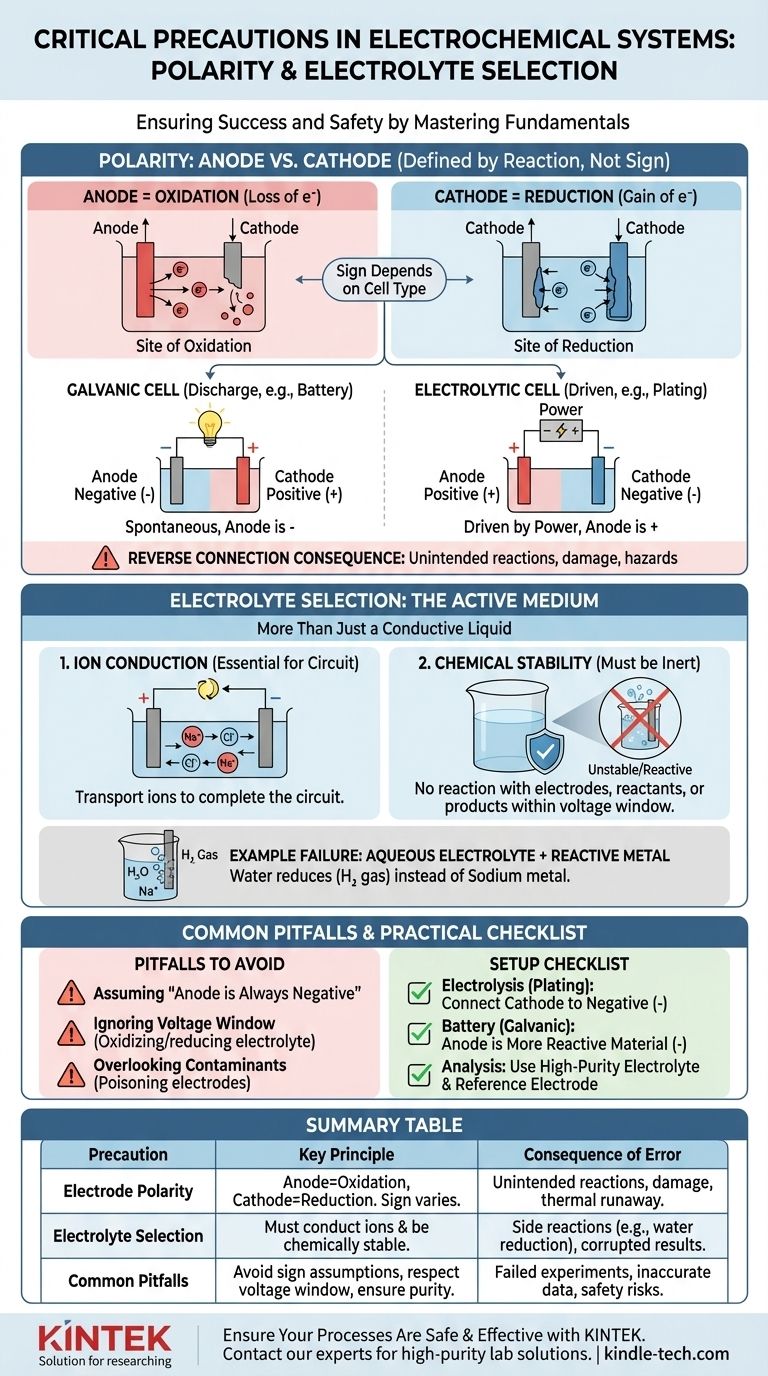
الدور الحاسم للقطبية: الأنود مقابل الكاثود
تحديد الأنود والكاثود بشكل صحيح هو الخطوة الأولى في بناء خلية كهروكيميائية وظيفية ويمكن التنبؤ بها. يتجاوز هذا مجرد تسمية الأطراف بـ "موجب" أو "سالب".
ماذا تعني "القطبية" حقًا
يتم تعريف مصطلحي الأنود والكاثود بنوع التفاعل، وليس بشحنتهما.
- الأنود هو دائمًا موقع الأكسدة (فقدان الإلكترونات).
- الكاثود هو دائمًا موقع الاختزال (اكتساب الإلكترونات).
ينشأ الارتباك لأن علامة (+ أو -) هذه الأقطاب تعتمد على نوع الخلية. في بطارية تفرغ (خلية جلفانية)، يكون الأنود هو الطرف السالب. في إعداد التحليل الكهربائي (خلية تحليل كهربائي)، يتم توصيل الأنود بالطرف الموجب لمصدر الطاقة.
نتيجة التوصيل العكسي
يؤدي توصيل الأقطاب بشكل غير صحيح إلى إجبار التفاعلات الكيميائية على السير في الاتجاه المعاكس أو بطريقة غير مقصودة.
في خلية تحليل كهربائي (مثل الطلاء الكهربائي)، يعني التوصيل العكسي أنك ستزيل المادة من القطب الذي كنت تنوي طلاءه وترسب المادة على الأنود المصدر الخاص بك، مما يدمر كلاهما.
في بطارية قابلة لإعادة الشحن، يمكن أن يتسبب الشحن بقطبية معكوسة في تلف لا رجعة فيه لهياكل الأقطاب، مما يؤدي إلى فقدان دائم للسعة، وقصر دوائر داخلية، وربما هروب حراري خطير.
اختيار الإلكتروليت: أكثر من مجرد سائل موصل
الإلكتروليت ليس مكونًا سلبيًا؛ إنه جزء نشط وحاسم من النظام الكهروكيميائي. تحدد خصائصه التفاعلات الممكنة.
الوظيفة الأساسية: توصيل الأيونات
الوظيفة الأساسية للإلكتروليت هي نقل الأيونات بين الأنود والكاثود، لإكمال الدائرة الكهربائية. بدون وسط لتدفق الأيونات، سيتوقف التفاعل بأكمله على الفور.
الوظيفة الحاسمة: الاستقرار الكيميائي
يجب أن يكون الإلكتروليت ومذيبه خاملين كيميائيًا تحت ظروف التشغيل. يجب ألا يتفاعلا مع الأقطاب، أو المواد المتفاعلة، أو نواتج تفاعلك الأساسي. هذا هو مصدر "التفاعلات الجانبية غير المرغوب فيها" المذكورة في بروتوكولات السلامة.
مثال: لماذا تفشل الإلكتروليتات المائية للمعادن النشطة
تخيل محاولة إنتاج معدن الصوديوم عن طريق التحليل الكهربائي لمحلول كلوريد الصوديوم (NaCl) في الماء.
قد تتوقع أن تتحرك أيونات الصوديوم (Na+) إلى الكاثود، وتكتسب إلكترونًا، وتشكل معدن الصوديوم. ومع ذلك، فإن الماء (H₂O) موجود أيضًا وهو أسهل بكثير في الاختزال من أيونات الصوديوم. ونتيجة لذلك، ستنتج غاز الهيدروجين عند الكاثود، ولن يتشكل معدن الصوديوم. جعل اختيار الإلكتروليت التفاعل المطلوب مستحيلًا.
فهم المفاضلات والمزالق الشائعة
يتطلب تجنب الأخطاء البسيطة فهم المبادئ الأساسية التي تحكم جميع الخلايا الكهروكيميائية.
المأزق 1: افتراض أن "الأنود سالب"
الخطأ الأكثر شيوعًا هو الخطأ في تحديد الأنود والكاثود. تذكر دائمًا تعريفهما بنوع التفاعل (الأكسدة/الاختزال)، وليس بعلامة ثابتة. حدد ما إذا كانت خليتك جلفانية (تلقائية) أو تحليلية (مدفوعة بقوة خارجية) لتعيين العلامة الصحيحة.
المأزق 2: تجاهل نافذة جهد الإلكتروليت
لكل إلكتروليت نافذة جهد استقرار. إذا قمت بتطبيق جهد يتجاوز هذه النافذة، ستبدأ في أكسدة أو اختزال الإلكتروليت نفسه، وليس هدفك المقصود. هذا يستهلك الطاقة، ويخلق شوائب، ويوقف التفاعل المطلوب.
المأزق 3: إغفال الملوثات
حتى الشوائب النزرة في الإلكتروليت يمكن أن يكون لها تأثير هائل. يمكن أن تترسب الملوثات على سطح القطب، "فتسممه" وتمنع التفاعل المقصود، أو يمكن أن تعمل كمحفزات لتفاعلات جانبية غير مرغوب فيها تفسد نتائجك.
قائمة مراجعة عملية لإعدادك
استخدم هذه الإرشادات لضمان صحة إعدادك التجريبي منذ البداية.
- إذا كان تركيزك الأساسي هو التحليل الكهربائي (مثل الطلاء، التكرير): قم بتوصيل القطب الذي تريد طلاءه (الكاثود) بالطرف السالب لمصدر الطاقة والمادة المصدر (الأنود) بالطرف الموجب.
- إذا كان تركيزك الأساسي هو بناء بطارية (خلية جلفانية): المادة الأكثر تفاعلية كيميائيًا التي تتأكسد هي الأنود الخاص بك (الطرف السالب)، والمادة الأقل تفاعلية هي الكاثود الخاص بك (الطرف الموجب).
- إذا كان تركيزك الأساسي هو التحليل الكهروكيميائي الدقيق: استخدم إلكتروليت عالي النقاء، وغالبًا ما يكون منزوع الغازات لمنع التفاعلات الجانبية، وتأكد من إعداد قطبيتك بالنسبة لمعيار معروف أو قطب مرجعي.
من خلال التعامل مع القطبية واختيار الإلكتروليت كمعايير تصميم أساسية، فإنك تنتقل من مجرد اتباع التعليمات إلى هندسة النتائج الكهروكيميائية المرغوبة حقًا.

جدول الملخص:
| الاحتياط | المبدأ الأساسي | نتيجة الخطأ |
|---|---|---|
| قطبية القطب | الأنود = موقع الأكسدة؛ الكاثود = موقع الاختزال. تعتمد العلامة على نوع الخلية (جلفانية مقابل تحليلية). | التوصيل العكسي يسبب تفاعلات غير مقصودة (مثل التجريد بدلاً من الطلاء)، وتلف المعدات، أو الهروب الحراري. |
| اختيار الإلكتروليت | يجب أن يوصل الأيونات ويظل مستقرًا كيميائيًا تحت ظروف التشغيل (نافذة الجهد). | الإلكتروليت الخاطئ يمكن التفاعلات الجانبية (مثل اختزال الماء بدلاً من ترسيب الصوديوم)، ويفسد النتائج، ويهدر الطاقة. |
| المزالق الشائعة | افتراض أن "الأنود دائمًا سالب"؛ تجاهل نافذة جهد الإلكتروليت؛ إغفال الملوثات. | تجارب فاشلة، بيانات غير دقيقة، ومخاطر سلامة بسبب عمليات كيميائية غير مقصودة. |
تأكد من أن عملياتك الكهروكيميائية آمنة وفعالة مع KINTEK
هل تقوم بإعداد مشروع تحليل كهربائي، أو طلاء، أو تطوير بطارية؟ إن قطبية الأقطاب واختيار الإلكتروليت المناسبين أمران غير قابلين للتفاوض لتحقيق نتائج دقيقة والحفاظ على السلامة. في KINTEK، نحن متخصصون في توفير معدات ومواد استهلاكية مخبرية عالية النقاء—بما في ذلك الخلايا الكهروكيميائية، والإلكتروليتات النقية، ومصادر الطاقة الموثوقة—لدعم الاحتياجات الفريدة لمختبرك.
دعنا نساعدك على تجنب الأخطاء والمخاطر المكلفة. اتصل بخبرائنا اليوم لمناقشة تطبيقك المحدد واكتشاف كيف يمكن لحلول KINTEK أن تعزز سير عملك الكهروكيميائي.
دليل مرئي
المنتجات ذات الصلة
- قطب قرص البلاتين الدوار للتطبيقات الكهروكيميائية
- قطب القرص الذهبي
- قطب مرجعي لكبريتات النحاس للاستخدام المخبري
- قطب مساعد بلاتيني للاستخدام المخبري
- ألسنة من النيكل والألومنيوم لبطاريات الليثيوم ذات العبوات اللينة
يسأل الناس أيضًا
- ما الفرق بين RDE و RRDE؟ اكتشف تحليل التفاعلات الكهروكيميائية المتقدمة
- ما هو التطبيق الشائع للقطب الكهربائي السلكي/القضيب البلاتيني؟ الدليل الأساسي للأقطاب الكهربائية الموازنة
- ما الفرق بين قطب القرص الحلقي وقطب القرص الدوار؟ اكتشف رؤى كيميائية كهربائية أعمق
- ما هو الدور الشائع لقطب القرص البلاتيني؟ دليل لاستخدامه الأساسي كقطب عمل
- كيف يجب تنظيف قطب سلك/قضيب البلاتين قبل الاستخدام؟ دليل لبيانات كيميائية كهربائية موثوقة