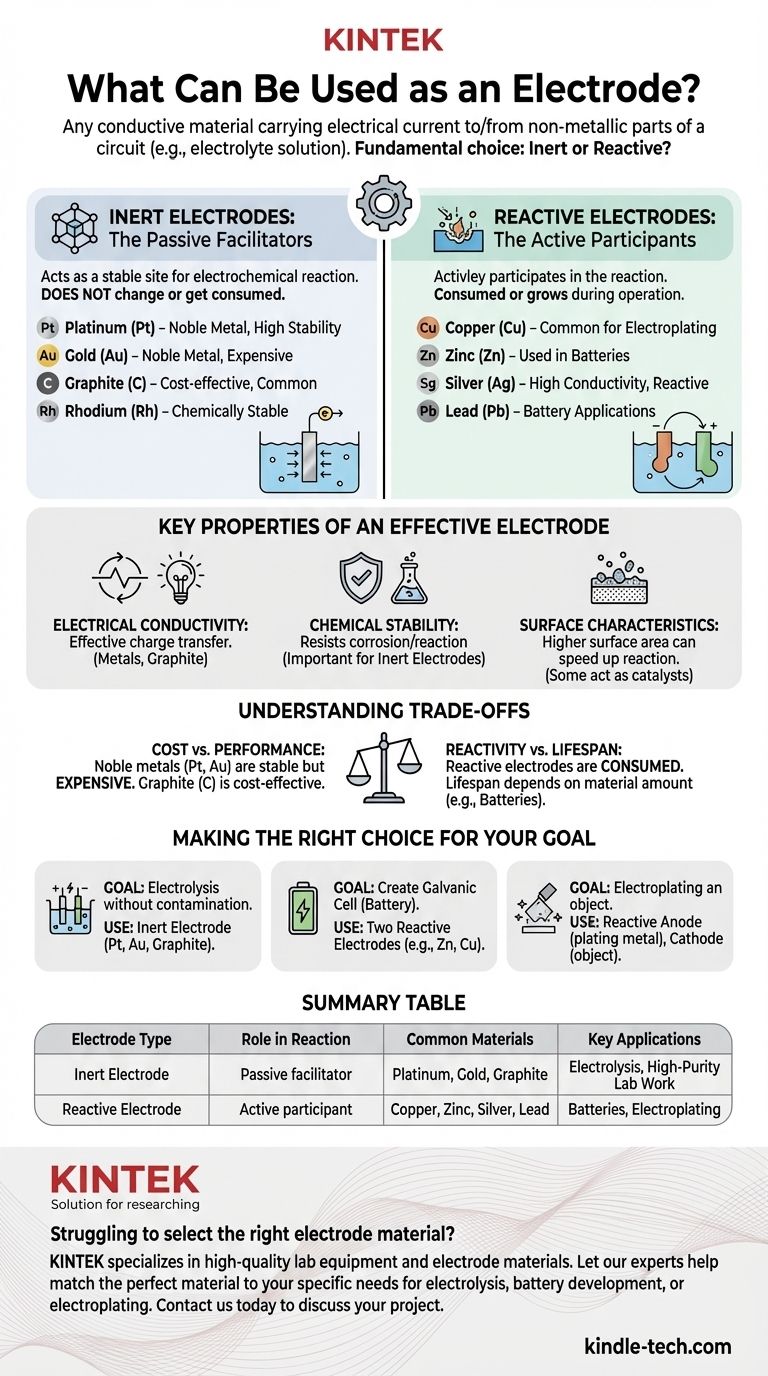
باختصار، القطب الكهربائي هو أي مادة موصلة تحمل تيارًا كهربائيًا إلى أو من جزء غير معدني من الدائرة، مثل محلول إلكتروليتي. تُصنف الأقطاب الكهربائية بشكل عام إلى فئتين: الأقطاب الكهربائية الخاملة، التي لا تشارك في التفاعل الكيميائي، والأقطاب الكهربائية التفاعلية، التي تشارك. تشمل الأمثلة الشائعة المعادن مثل البلاتين والذهب والنحاس والزنك، بالإضافة إلى المواد غير المعدنية مثل الجرافيت (الكربون).
يعد اختيار القطب الكهربائي قرارًا تصميميًا حاسمًا في أي نظام كهروكيميائي. لا يقتصر الاختيار الأساسي على "ما هي المادة التي توصل الكهرباء"، بل ما إذا كنت بحاجة إلى مادة تظل دون تغيير (خاملة) أو مادة تشارك بنشاط في التفاعل الكيميائي (تفاعلية).

النوعان الأساسيان من الأقطاب الكهربائية
أهم تمييز عند اختيار مادة القطب الكهربائي هو دورها في التفاعل الكيميائي المقصود. وهذا يفصل جميع المواد المحتملة إلى مجموعتين أساسيتين.
الأقطاب الكهربائية الخاملة: الميسرات السلبية
يعمل القطب الكهربائي الخامل كموقع مستقر وغير تفاعلي لحدوث تفاعل كهروكيميائي. وظيفته ببساطة هي توصيل الإلكترونات من أو إلى الإلكتروليت.
المادة نفسها لا تتغير أو تستهلك أو تذوب في المحلول. إنها مجرد سطح.
بسبب هذا، يجب أن تكون الأقطاب الكهربائية الخاملة مصنوعة من مواد مستقرة كيميائيًا في الإلكتروليت المحدد المستخدم. تشمل الخيارات الشائعة المعادن النبيلة والكربون.
أمثلة على الأقطاب الكهربائية الخاملة:
- البلاتين (Pt)
- الذهب (Au)
- الجرافيت (C)
- الروديوم (Rh)
الأقطاب الكهربائية التفاعلية: المشاركون النشطون
القطب الكهربائي التفاعلي هو مشارك نشط في التفاعل الكهروكيميائي. إما أن يتأكسد (يذوب في الإلكتروليت) أو يكون ناتجًا عن الاختزال (يترسب على السطح).
تُختار هذه المواد خصيصًا لقدرتها على التفاعل بطريقة مضبوطة. هذا هو المبدأ وراء البطاريات والطلاء الكهربائي.
يتم استهلاك القطب الكهربائي نفسه أو ينمو أثناء تشغيل الخلية الكهروكيميائية.
أمثلة على الأقطاب الكهربائية التفاعلية:
- النحاس (Cu)
- الزنك (Zn)
- الفضة (Ag)
- الرصاص (Pb)
الخصائص الرئيسية للقطب الكهربائي الفعال
بالإضافة إلى التصنيف الأساسي، تحدد عدة خصائص مدى كفاءة المادة كقطب كهربائي لغرض معين.
التوصيل الكهربائي
هذا هو المتطلب الأساسي. يجب أن تكون المادة موصلًا فعالًا للكهرباء لنقل الشحنة بين الدائرة الخارجية والإلكتروليت. المعادن والجرافيت خيارات ممتازة لهذا السبب.
الاستقرار الكيميائي
لكي يعتبر القطب الكهربائي خاملًا، يجب أن يقاوم التآكل أو التفاعل مع الإلكتروليت وأي مواد تنتج أثناء التفاعل. ولهذا السبب تحظى المعادن النبيلة مثل البلاتين والذهب بتقدير كبير في هذه التطبيقات.
خصائص السطح
يحدث التفاعل على سطح القطب الكهربائي. يمكن للمادة ذات مساحة السطح الأكبر أن تدعم غالبًا معدل تفاعل أسرع. علاوة على ذلك، يمكن لبعض المواد، مثل البلاتين، أن تعمل كمحفزات، مما يقلل الطاقة اللازمة لحدوث التفاعل.
فهم المفاضلات
ليس القطب الكهربائي "الأفضل" نظريًا هو دائمًا الأكثر عملية للاستخدام. تتطلب التطبيقات الواقعية الموازنة بين الأداء وعوامل أخرى.
التكلفة مقابل الأداء
تعتبر المعادن النبيلة مثل البلاتين والذهب أقطابًا كهربائية خاملة استثنائية بسبب استقرارها الشديد، لكنها باهظة الثمن.
بالنسبة للعديد من التطبيقات، يوفر الجرافيت بديلاً أكثر فعالية من حيث التكلفة بكثير. على الرغم من أنه قد يكون أقل متانة أو نشاطًا تحفيزيًا من البلاتين، إلا أن تكلفته المنخفضة تجعله الخيار السائد لعدد لا يحصى من العمليات الصناعية.
التفاعلية مقابل العمر الافتراضي
بحكم التعريف، تستهلك الأقطاب الكهربائية التفاعلية بمرور الوقت. هذه وظيفة ضرورية في تطبيقات مثل الخلايا الغلفانية (البطاريات)، حيث يؤدي استهلاك القطب الكهربائي إلى توليد التيار الكهربائي.
هذا يعني أن العمر الافتراضي للجهاز مرتبط مباشرة بكمية مادة القطب الكهربائي التفاعلية المتاحة. يحدد اختيار المادة جهد الخلية وطول عمرها.
اتخاذ القرار الصحيح لهدفك
يجب أن يكون اختيارك لمادة القطب الكهربائي مدفوعًا بالكامل بهدف خليتك الكهروكيميائية.
- إذا كان تركيزك الأساسي هو التحليل الكهربائي دون تلوث: فأنت بحاجة إلى قطب كهربائي خامل. استخدم البلاتين أو الذهب للعمل المخبري عالي النقاء، أو الجرافيت (الكربون) كبديل فعال من حيث التكلفة.
- إذا كان تركيزك الأساسي هو إنشاء خلية غلفانية (بطارية): فأنت بحاجة إلى قطبين كهربائيين تفاعليين مختلفين. استخدم مواد مثل الزنك والنحاس، حيث يؤدي اختلاف إمكاناتها الكيميائية إلى دفع التيار الكهربائي.
- إذا كان تركيزك الأساسي هو طلاء جسم بالكهرباء: يجب أن يكون الأنود (القطب الموجب) قطبًا كهربائيًا تفاعليًا مصنوعًا من المعدن الذي تريد طلاءه (مثل الفضة)، وسيكون الكاثود (القطب السالب) هو الجسم نفسه.
في النهاية، القطب الكهربائي الصحيح هو الذي تتطابق خصائصه الكيميائية والفيزيائية بدقة مع الوظيفة المحددة التي يجب أن يؤديها داخل خليتك الكهروكيميائية.
جدول ملخص:
| نوع القطب الكهربائي | الدور في التفاعل | المواد الشائعة | التطبيقات الرئيسية |
|---|---|---|---|
| القطب الكهربائي الخامل | ميسر سلبي؛ لا يتفاعل | البلاتين، الذهب، الجرافيت | التحليل الكهربائي، العمل المخبري عالي النقاء |
| القطب الكهربائي التفاعلي | مشارك نشط؛ يستهلك أو يتكون | النحاس، الزنك، الفضة، الرصاص | البطاريات، الطلاء الكهربائي |
هل تواجه صعوبة في اختيار مادة القطب الكهربائي المناسبة لتطبيقك؟ يعتمد أداء عمليتك الكهروكيميائية على هذا الاختيار الحاسم. تتخصص KINTEK في توفير معدات ومواد استهلاكية مخبرية عالية الجودة، بما في ذلك مجموعة واسعة من مواد الأقطاب الكهربائية مثل البلاتين والجرافيت والمعادن التفاعلية. يمكن لخبرائنا مساعدتك في مطابقة المادة المثالية لاحتياجاتك الخاصة—سواء كان ذلك للتحليل الكهربائي، أو تطوير البطاريات، أو الطلاء الكهربائي—مما يضمن أفضل النتائج والكفاءة. اتصل بنا اليوم لمناقشة مشروعك ودع KINTEK تكون شريكك في الدقة. تواصل معنا عبر نموذج الاتصال الخاص بنا
دليل مرئي
المنتجات ذات الصلة
- قطب صفيحة البلاتين للتطبيقات المختبرية والصناعية
- قطب قرص البلاتين الدوار للتطبيقات الكهروكيميائية
- قطب جرافيت قرصي وقضيبي ولوح جرافيت كهروكيميائي
- قطب مساعد بلاتيني للاستخدام المخبري
- قطب القرص الذهبي
يسأل الناس أيضًا
- كيف يجب معالجة قطب صفيحة البلاتين مسبقًا قبل الاستخدام؟ ضمان قياسات كيميائية كهربائية دقيقة
- ما هي المواصفات المتاحة لأقطاب البلاتين الصفائحية؟ ابحث عن المقاس المثالي لاحتياجاتك الكهروكيميائية
- ما هو العمر المتوقع لقطب صفيحة البلاتين؟ قم بزيادة العمر الافتراضي لقطبك إلى أقصى حد
- ما هي مواصفات القطب الوظيفي من البلاتين والتيتانيوم؟ تعظيم الأداء الكهروكيميائي
- ما هي خصائص الأداء الرئيسية وتطبيقات صفائح البلاتين؟ موثوقية لا مثيل لها للتطبيقات الصعبة