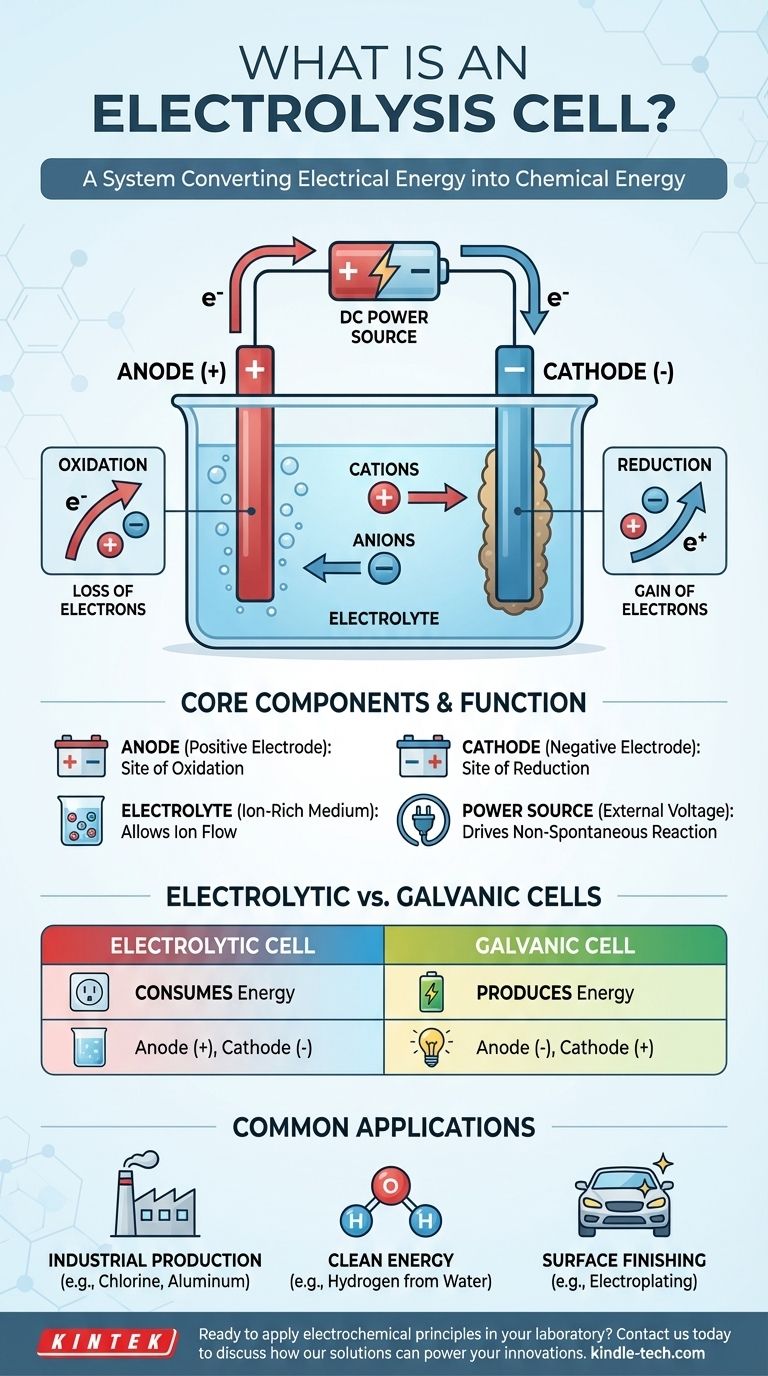
بشكل أساسي، خلية التحليل الكهربائي هي جهاز يستخدم الطاقة الكهربائية لدفع تفاعل كيميائي لن يحدث من تلقاء نفسه. إنها تعكس بشكل فعال عملية البطارية، وتستهلك الطاقة لتحليل المركبات أو تركيب مركبات جديدة. يتم تحقيق ذلك عن طريق تمرير تيار كهربائي مباشر عبر مادة تسمى الإلكتروليت، مما يجبر التغيرات الكيميائية على الحدوث عند قطبين.
يمكن فهم خلية التحليل الكهربائي بشكل أفضل كنظام لتحويل الطاقة الكهربائية إلى طاقة كيميائية. تعمل عن طريق تطبيق جهد خارجي للتغلب على الحالة الطبيعية لنظام كيميائي، مما يجبر الأيونات على التفاعل وإنشاء مواد جديدة.

كيف تعمل خلية التحليل الكهربائي
لفهم المفهوم، من الضروري فهم المكونات الأساسية الثلاثة وكيف تتفاعل عند إدخال الكهرباء. العملية عبارة عن تدفق متحكم وموجه للشحنة يؤدي إلى تحول كيميائي.
المكونات الأساسية الثلاثة
تتكون الخلية الإلكتروليتية من ثلاثة أجزاء رئيسية:
- الأنود (المصعد): القطب المتصل بالطرف الموجب لمصدر الطاقة.
- الكاثود (المهبط): القطب المتصل بالطرف السالب لمصدر الطاقة.
- الإلكتروليت: مادة تحتوي على أيونات حرة الحركة، مثل ملح منصهر أو مركب أيوني مذاب في مذيب مثل الماء.
دور الجهد الخارجي
على عكس البطارية (الخلية الغلفانية) التي تنتج الجهد تلقائيًا، تتطلب الخلية الإلكتروليتية مصدر طاقة خارجيًا. هذا الجهد المطبق ينشئ مجالًا كهربائيًا قويًا ويحدد قطبية الأقطاب، مما يجعل الأنود موجبًا والكاثود سالبًا.
تدفق الأيونات والإلكترونات
الجهد المطبق يجبر الأيونات داخل الإلكتروليت على الهجرة. تنجذب الأيونات المشحونة إيجابًا (الكاتيونات) نحو الكاثود السالب، بينما تنجذب الأيونات المشحونة سلبًا (الأنيونات) نحو الأنود الموجب. هذه الهجرة تمهد الطريق للتفاعلات الكيميائية.
الأكسدة والاختزال: الكيمياء الأساسية
يحدث التغير الكيميائي الفعلي على سطح الأقطاب. تُعرف هذه التفاعلات باسم تفاعلات "الأكسدة والاختزال" (redox)، وهي اختصار للأكسدة والاختزال.
الأنود: موقع الأكسدة
يُعرّف الأنود بأنه موقع الأكسدة. هنا، تفقد الأنيونات التي هاجرت إلى القطب الموجب إلكتروناتها الزائدة. هذا الفقد للإلكترونات هو تعريف الأكسدة.
الكاثود: موقع الاختزال
يُعرّف الكاثود بأنه موقع الاختزال. تقبل الكاتيونات المنجذبة إلى هذا القطب السالب الإلكترونات من الدائرة. هذا الكسب للإلكترونات هو تعريف الاختزال، وغالبًا ما يؤدي إلى ترسب عنصر محايد (مثل معدن) على الكاثود.
فهم التمييز الرئيسي: الخلايا الإلكتروليتية مقابل الخلايا الغلفانية
نقطة الالتباس الشائعة هي الفرق بين الخلية الإلكتروليتية والخلية الغلفانية (مثل البطارية الشائعة). فهم وظائفهما المتعارضة أمر بالغ الأهمية.
استهلاك الطاقة مقابل إنتاج الطاقة
الفرق الأكثر أهمية هو تدفق الطاقة. تستهلك الخلية الإلكتروليتية الطاقة لدفع تفاعل غير تلقائي. تطلق الخلية الغلفانية الطاقة من تفاعل تلقائي.
قطبية القطب
يؤدي هذا الاختلاف في الوظيفة إلى اتفاقية إشارة معاكسة للأقطاب.
- في الخلية الإلكتروليتية، يكون الأنود موجبًا والكاثود سالبًا.
- في الخلية الغلفانية، يكون الأنود سالبًا والكاثود موجبًا.
تذكر أنه في كلا نوعي الخلايا، تحدث الأكسدة دائمًا عند الأنود ويحدث الاختزال دائمًا عند الكاثود. القطبية هي ما يتغير.
تطبيقات شائعة للتحليل الكهربائي
إن القدرة على إحداث تغيير كيميائي بالكهرباء تجعل الخلايا الإلكتروليتية مفيدة بشكل لا يصدق في العديد من الصناعات.
الإنتاج الصناعي
التحليل الكهربائي هو حجر الزاوية في صناعة الكلور القلوي، التي تنتج غاز الكلور وهيدروكسيد الصوديوم. وهو ضروري أيضًا لإنتاج معادن نقية مثل الألومنيوم والنحاس من خاماتها.
الطاقة النظيفة
أحد أكثر التطبيقات الواعدة هو التحليل الكهربائي للماء. عن طريق تمرير تيار كهربائي عبر الماء، يمكن فصله إلى مكوناته الأساسية: الهيدروجين والأكسجين. يمكن استخدام الهيدروجين الناتج كوقود نظيف.
التشطيب السطحي
الطلاء الكهربائي هو عملية شائعة حيث تُستخدم خلية التحليل الكهربائي لترسيب طبقة رقيقة من معدن واحد (مثل الذهب أو الكروم) على سطح جسم آخر، والذي يعمل ككاثود.
اتخاذ الخيار الصحيح لهدفك
يتيح لك فهم مبدأ التحليل الكهربائي تطبيقه على أهداف محددة.
- إذا كان تركيزك الأساسي هو إنتاج المواد (مثل الهيدروجين): أدرك أن الخلية هي أداة لتفكيك المركبات المستقرة منخفضة الطاقة (مثل الماء) إلى منتجات عالية الطاقة وذات قيمة (مثل غاز الهيدروجين).
- إذا كان تركيزك الأساسي هو طلاء الأسطح (الطلاء الكهربائي): افهم أن الجسم المستهدف يجب أن يكون الكاثود، حيث سيتم اختزال أيونات المعادن الموجبة وترسيبها كطبقة صلبة.
- إذا كان تركيزك الأساسي هو الكيمياء الكهربائية الأساسية: فإن أهم ما يجب استخلاصه هو أن الخلية الإلكتروليتية تستخدم طاقة خارجية لعكس عملية كيميائية طبيعية، مما يجعلها محركًا قويًا للتخليق.
من خلال إتقان هذه المبادئ، يمكنك الاستفادة من التحليل الكهربائي كأداة قوية ودقيقة للتحول الكيميائي.
جدول الملخص:
| المكون | الوظيفة | الخاصية الرئيسية |
|---|---|---|
| الأنود (المصعد) | موقع الأكسدة (فقدان الإلكترونات) | متصل بالطرف الموجب لمصدر الطاقة |
| الكاثود (المهبط) | موقع الاختزال (اكتساب الإلكترونات) | متصل بالطرف السالب لمصدر الطاقة |
| الإلكتروليت | يوفر وسطًا لتدفق الأيونات | ملح منصهر أو محلول أيوني يحتوي على أيونات حرة الحركة |
| مصدر الطاقة | يدفع التفاعل غير التلقائي | يوفر الجهد الخارجي المطلوب للتحليل الكهربائي |
هل أنت مستعد لتطبيق مبادئ الكيمياء الكهربائية في مختبرك؟
سواء كان مشروعك يتضمن تركيب المواد، أو الطلاء الكهربائي، أو تطوير حلول الطاقة النظيفة، فإن امتلاك المعدات المناسبة أمر أساسي. تتخصص KINTEK في توفير معدات ومواد استهلاكية عالية الجودة للمختبرات لدعم أبحاثك وتطويرك في مجال الكيمياء الكهربائية.
اتصل بنا اليوم لمناقشة كيف يمكن لحلولنا أن تدعم ابتكاراتك وتوفر الدقة والموثوقية التي يحتاجها مختبرك.
دليل مرئي
المنتجات ذات الصلة
- خلية كهروكيميائية تحليل كهربائي بخمسة منافذ
- خلية التحليل الكهربائي من النوع H خلية كهروكيميائية ثلاثية
- خلية التحليل الكهربائي البصري مزدوجة الطبقة من النوع H مع حمام مائي
- خلية كهروكيميائية كهروكيميائية كوارتز للتجارب الكهروكيميائية
- خلية كهروكيميائية بالتحليل الكهربائي لتقييم الطلاء
يسأل الناس أيضًا
- كيف يمكن تجنب التلوث أثناء التجارب باستخدام خلية التحليل الكهربائي ذات الحمام المائي بخمسة منافذ؟ أتقن بروتوكول الأعمدة الثلاثة
- كيف يجب تشغيل الخلية الإلكتروليتية ذات الحمام المائي بخمسة منافذ أثناء التجربة؟ إتقان التحكم الدقيق للحصول على نتائج موثوقة
- كيف يمكن منع التسربات عند استخدام خلية تحليل كهربائي بحوض مائي خماسي المنافذ؟ ضمان إعداد كيميائي كهربائي موثوق وآمن
- ما الاحتياط العام الذي يجب اتخاذه عند التعامل مع الخلية الإلكتروليتية؟ ضمان نتائج معملية آمنة ودقيقة
- كيف يجب صيانة جسم الخلية الإلكتروليتية لضمان طول عمرها؟ إطالة عمر معداتك



















