في جوهره، التآكل هو التدهور الطبيعي للمعدن المُكرر إلى شكل أكثر استقرارًا كيميائيًا، مثل أكسيده أو كبريتيده. ضمن الخلية الكهروكيميائية، هذه العملية ليست مجرد تفاعل سطحي، بل هي دائرة كاملة حيث يدمر المعدن نفسه ذاتيًا عن طريق إنشاء بطارية صغيرة غير مرغوب فيها على سطحه.
التآكل هو عملية كهروكيميائية لأنه يتضمن المكونات الأربعة الأساسية للبطارية: أنود (حيث يُفقد المعدن)، وكاثود، وإلكتروليت (مثل الماء)، ومسار معدني، وكلها تعمل معًا لتفكيك المعدن.
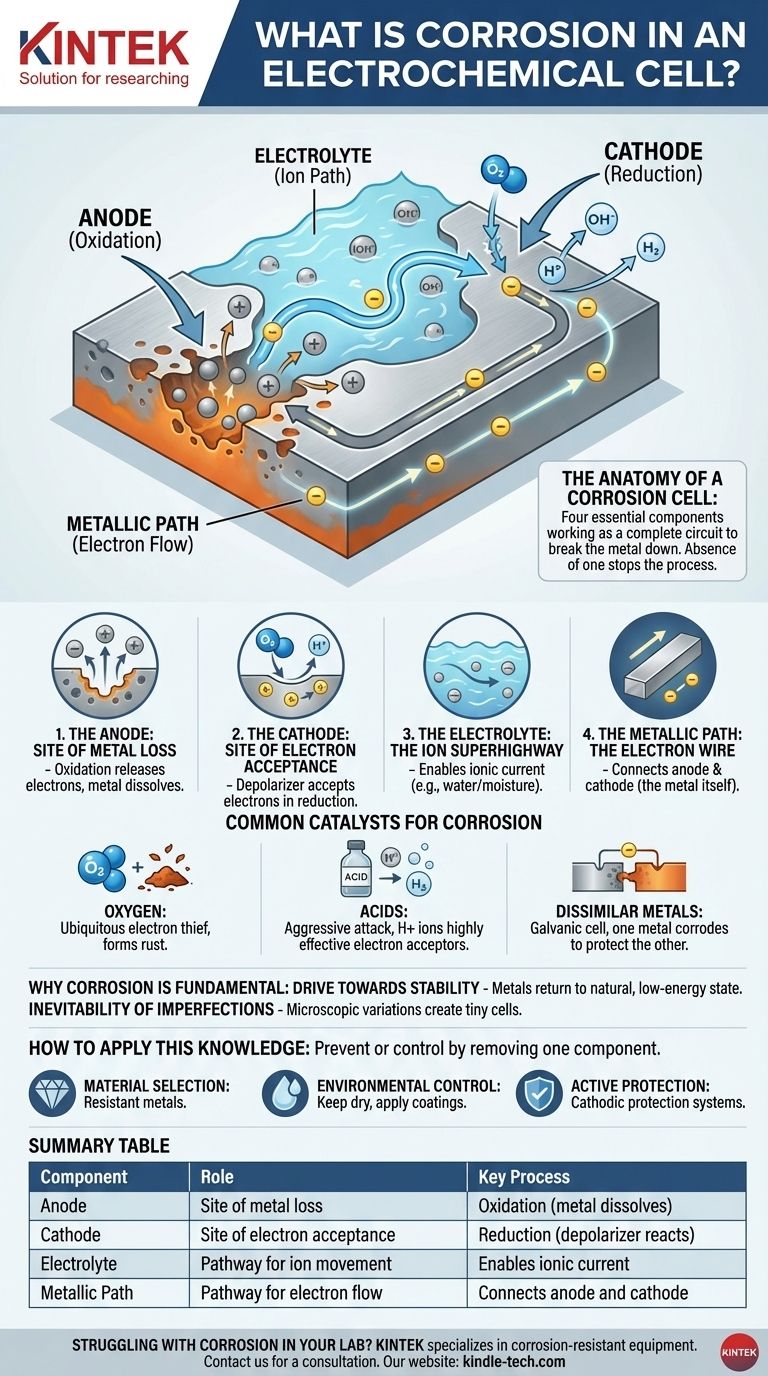
تشريح خلية التآكل
فهم التآكل يعني فهم المكونات الأربعة التي يتطلبها ليعمل. غياب أي مكون واحد من هذه المكونات سيوقف العملية تمامًا.
الأنود (المُصعَد): موقع فقدان المعدن
الموقع الأنودي هو النقطة المحددة على سطح المعدن حيث يحدث التآكل. هنا، تخضع ذرات المعدن لعملية الأكسدة، حيث تفقد الإلكترونات وتتحول إلى أيونات موجبة الشحنة تذوب في الماء أو الرطوبة المحيطة. هذا هو الفعل المادي لتآكل المعدن.
الكاثود (المُهبَط): موقع استقبال الإلكترونات
الإلكترونات المنبعثة من الأنود تنتقل عبر المعدن إلى موقع مختلف، وهو الموقع الكاثودي. هنا، تستقبل مادة في البيئة - تُعرف باسم مزيل الاستقطاب - هذه الإلكترونات في تفاعل اختزال. مزيل الاستقطاب هذا مكون حاسم.
الإلكتروليت: طريق الأيونات السريع
يعمل الماء، حتى بكميات مجهرية مثل الرطوبة، كـ إلكتروليت. إنه يوفر وسطًا للأيونات المعدنية المذابة (من الأنود) والأيونات الأخرى للسفر، مما يكمل الدائرة الكهربائية. بدون إلكتروليت، لا توجد طريقة للأيونات للحركة، وتنقطع الدائرة.
المسار المعدني: سلك الإلكترونات
جسم المعدن نفسه يعمل كمسار معدني. إنه يوفر مسارًا موصلاً لكي تنتقل الإلكترونات من الأنود إلى الكاثود. هذا هو السبب في أن المواقع الأنودية والكاثودية يمكن أن تكون متجاورة أو بعيدة عن بعضها البعض على نفس قطعة المعدن.
المحفزات الشائعة للتآكل
غالبًا ما يتحدد معدل وشدة التآكل من خلال توفر ونوع مزيل الاستقطاب (مستقبل الإلكترون) عند الكاثود.
الأكسجين: سارق الإلكترونات الشائع
في معظم البيئات الشائعة، يكون الأكسجين المذاب هو مستقبل الإلكترون الأساسي. هذا هو السبب في أن الماء والأكسجين معًا مدمران للغاية للمعادن مثل الحديد، مما يؤدي إلى تكوين الصدأ (أكسيد الحديد).
الأحماض: هجوم عدواني
تسرّع الأحماض التآكل بشكل كبير. أيونات الهيدروجين (H+) في المحلول الحمضي هي مستقبلات إلكترون فعالة للغاية، مما يخلق غاز الهيدروجين عند الكاثود. هذه العملية عادة ما تكون أسرع وأكثر عدوانية من التآكل المدفوع بالأكسجين.
المعادن المتباينة: الخلية الغلفانية
عندما يتلامس معدنان مختلفان كهربائيًا داخل إلكتروليت، فإنهما يشكلان خلية غلفانية. المعدن الأقل نبلاً والأكثر نشاطًا سيصبح الأنود ويتآكل بسرعة، بينما يصبح المعدن الأكثر نبلاً هو الكاثود ويتم حمايته. هذا هو السبب في أنك ترى أنودات الزنك التضحوية على هياكل القوارب لحماية الفولاذ.
لماذا التآكل عملية أساسية
التآكل ليس عيبًا؛ إنه عملية طبيعية وتلقائية مدفوعة بقوانين الديناميكا الحرارية الأساسية. فهم هذا الحتمية هو مفتاح إدارته.
الاندفاع نحو الاستقرار
المعادن المكررة مثل الألومنيوم والصلب هي مواد من صنع الإنسان وموجودة في حالة طاقة عالية. التآكل هو ببساطة عملية عودة هذا المعدن إلى حالته الطبيعية ذات الطاقة المنخفضة، على غرار الخام الذي استُخرج منه. المعدن يطلق طاقته المخزنة.
حتمية العيوب
لا يوجد سطح معدني موحد تمامًا. الاختلافات المجهرية في التركيب، أو الإجهاد الناتج عن التصنيع، أو حتى الاختلافات في التعرض للأكسجين تخلق مواقع أنودية وكاثودية صغيرة في جميع أنحاء السطح. هذه العيوب هي كل ما هو مطلوب لبدء آلاف الخلايا التآكلية المجهرية.
كيفية تطبيق هذه المعرفة
إن فهم أن التآكل هو خلية كهروكيميائية يمنحك إطارًا واضحًا لمنعه أو السيطرة عليه. الاستراتيجية دائمًا هي إزالة أحد المكونات الأربعة الأساسية.
- إذا كان تركيزك الأساسي هو اختيار المواد: استخدم معادن مقاومة بطبيعتها لتكوين خلية كهروكيميائية في بيئة خدمتها، أو تجنب توصيل المعادن المتباينة.
- إذا كان تركيزك الأساسي هو التحكم البيئي: تخلص من الإلكتروليت عن طريق إبقاء المعدن جافًا أو تطبيق طلاء مقاوم للماء (مثل الطلاء) لمنع الرطوبة من الوصول إلى السطح.
- إذا كان تركيزك الأساسي هو الحماية النشطة: قم بإنشاء خلية كهروكيميائية أقوى عمدًا حيث يُجبر معدنك الهيكلي على أن يكون الكاثود. هذا هو المبدأ وراء كل من الأنودات التضحوية وأنظمة الحماية الكاثودية.
من خلال النظر إلى التآكل كدائرة بسيطة، يمكنك تشخيص سببه بشكل منهجي وقطع مساره المدمر بفعالية.

جدول الملخص:
| المكون | الدور في خلية التآكل | العملية الرئيسية |
|---|---|---|
| الأنود (المُصعَد) | موقع فقدان المعدن | الأكسدة (يذوب المعدن) |
| الكاثود (المُهبَط) | موقع استقبال الإلكترونات | الاختزال (يتفاعل مزيل الاستقطاب) |
| الإلكتروليت | مسار لحركة الأيونات | يمكّن التيار الأيوني (مثل الماء) |
| المسار المعدني | مسار لتدفق الإلكترونات | يربط الأنود والكاثود (المعدن نفسه) |
هل تعاني من التآكل في معدات المختبر الخاصة بك؟
يمكن أن يعرض التآكل تجاربك للخطر، ويتلف الأجهزة الحساسة، ويؤدي إلى توقف مكلف عن العمل. تتخصص KINTEK في المعدات والمواد الاستهلاكية للمختبرات المقاومة للتآكل، مما يساعدك على حماية استثماراتك وضمان سلامة أبحاثك.
يمكن لخبرائنا مساعدتك في اختيار المواد والحلول المناسبة لقطع دائرة التآكل في بيئة المختبر الخاصة بك.
اتصل بـ KINTEK اليوم للحصول على استشارة واكتشف كيف يمكننا مساعدتك في مكافحة التآكل وتعزيز أداء مختبرك.
دليل مرئي
المنتجات ذات الصلة
- خلية كهروكيميائية بالتحليل الكهربائي لتقييم الطلاء
- خلية كهروكيميائية للتآكل المسطح
- خلية كهروكيميائية كهروكيميائية كوارتز للتجارب الكهروكيميائية
- خلية التحليل الكهربائي البصري مزدوجة الطبقة من النوع H مع حمام مائي
- خلية التحليل الكهربائي الطيفي بالطبقة الرقيقة
يسأل الناس أيضًا
- ما هو دور المفاعل الكهروكيميائي عالي الضغط المصنوع من الفولاذ المقاوم للصدأ؟ تمكين تحويل ثاني أكسيد الكربون إلى غاز التخليق
- كيف يؤثر المحرك المغناطيسي الدقيق على كفاءة التفاعل؟ تعزيز أداء التحلل الكهروكيميائي
- كيف يجب صيانة ختم وقطب الخلية الإلكتروليتية؟ ضمان الدقة وطول العمر في مختبرك
- لماذا يجب تجهيز الخلية الكهروكيميائية بغلاف مائي دائري لتقييم أقطاب التيتانيوم؟
- ما هي الوظائف الأساسية للخلية الكهروكيميائية في تقشير الجرافيت؟ إنتاج الجرافين الهندسي
- لماذا يتم تجهيز الوحدة الكهروضوئية بأنود جرافيتي أثناء عملية تنقية الملح المنصهر؟
- ما هي الأبعاد المادية لجسم خلية التحليل الطيفي الكهروكيميائي ذات الطبقة الرقيقة وفتحتها؟ المواصفات الرئيسية لمختبرك
- ما هو نوع نظام الأقطاب الكهربائية الذي صُممت خلية الطلاء الكهروكيميائية لتقييمه؟ افتح آفاق تحليل دقيق للطلاء



















