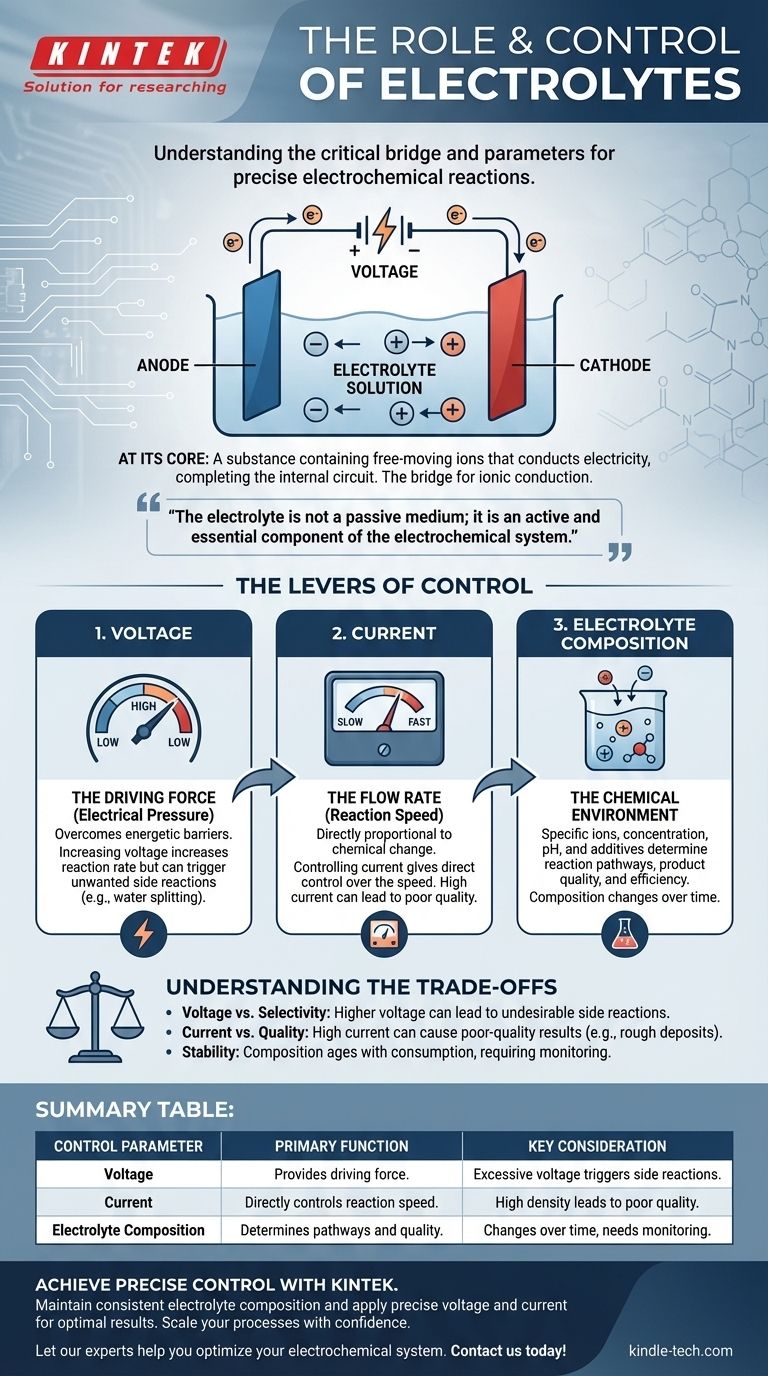
في جوهره، الإلكتروليت هو مادة تحتوي على أيونات حرة الحركة توصل الكهرباء، مما يكمل الدائرة داخل الخلية الكهروكيميائية. إنه الجسر الحاسم الذي يسمح بتشغيل التفاعل الكيميائي بواسطة مصدر طاقة خارجي. ويتم التحكم في التفاعل نفسه بدقة من خلال تعديل ثلاثة معايير رئيسية: الجهد المطبق، والتيار الناتج، والتركيب الكيميائي للإلكتروليت.
الإلكتروليت ليس وسطًا خاملًا؛ بل هو مكون نشط وضروري للنظام الكهروكيميائي. إن فهم كيفية معالجة المدخلات الكهربائية وكيمياء الإلكتروليت هو المفتاح لتحويل التفاعل من عملية قسرية إلى عملية يتم التحكم فيها بدقة.

الدور الأساسي للإلكتروليت
للتحكم في نظام ما، يجب عليك أولاً فهم مكوناته غير القابلة للتفاوض. في الكيمياء الكهربائية، الإلكتروليت هو المسار الداخلي الذي يجعل العملية برمتها ممكنة.
ما هو الإلكتروليت؟
الإلكتروليت هو عادةً محلول يحتوي على أملاح أو أحماض أو قواعد مذابة، والتي تتفكك إلى كاتيونات موجبة الشحنة وأنيونات سالبة الشحنة. في حين أنه غالبًا ما يكون محلولًا مائيًا (قائمًا على الماء)، يمكن أن يعتمد أيضًا على مذيبات عضوية أو حتى يوجد كأملاح منصهرة في درجات حرارة عالية.
الخاصية الأساسية هي وجود أيونات متحركة. بدونها، تنقطع الدائرة الداخلية، ولا يمكن أن يحدث أي تفاعل كهروكيميائي.
الجسر للتوصيل الأيوني
تحتوي الخلية الكهروكيميائية على دائرتين. الدائرة الخارجية هي الأسلاك التي تنتقل عبرها الإلكترونات من قطب كهربائي إلى آخر.
الدائرة الداخلية هي الإلكتروليت. عندما تصل الإلكترونات إلى قطب كهربائي واحد (الكاثود) وتغادر الآخر (الأنود)، يجب أن تتحرك الأيونات عبر الإلكتروليت لموازنة الشحنة. تتحرك الكاتيونات نحو الكاثود وتتحرك الأنيونات نحو الأنود، مما يكمل الدائرة الكهربائية.
أكثر من مجرد موصل
يشارك الإلكتروليت أيضًا بنشاط في التفاعل. يحدد تركيبه أنواع المواد الكيميائية المتاحة للأكسدة أو الاختزال، وما ستكون عليه نواتج التفاعل، ومدى سرعة سير التفاعل.
رافعات التحكم: كيفية إدارة التفاعل
التحكم في التفاعل الكهروكيميائي يعني معالجة معدل ونتائج التغيرات الكيميائية التي تحدث عند الأقطاب الكهربائية. ويتم تحقيق ذلك من خلال إدارة الخصائص الكهربائية والكيميائية للنظام.
التحكم في الجهد (القوة الدافعة)
يمكن اعتبار الجهد بمثابة "الضغط الكهربائي" الذي يدفع التفاعل إلى الأمام. هناك حاجة إلى حد أدنى معين من الجهد للتغلب على الحاجز الطاقي لتفاعل معين.
زيادة الجهد تزيد بشكل عام من معدل التفاعل. ومع ذلك، فإن تطبيق جهد مفرط هو أداة غليظة يمكن أن تؤدي إلى تفاعلات جانبية غير مرغوب فيها.
التحكم في التيار (معدل التدفق)
التيار هو مقياس لعدد الإلكترونات التي تتدفق عبر الدائرة لكل وحدة زمنية. وفقًا لقوانين فاراداي للتحليل الكهربائي، فإن كمية التغير الكيميائي تتناسب طرديًا مع كمية الشحنة المارة.
لذلك، يمنحك التحكم في التيار تحكمًا مباشرًا في سرعة التفاعل. يضمن التيار الثابت (التحكم الغلفاني) أن يستمر التفاعل بمعدل ثابت ويمكن التنبؤ به.
تعديل تركيز الإلكتروليت (البيئة الكيميائية)
هذا هو المستوى الأكثر دقة للتحكم. تحدد الأيونات المحددة وتركيزها والمذيب وأي إضافات بشكل أساسي بيئة التفاعل.
تشمل العوامل الرئيسية التركيز (الذي يؤثر على التوصيل وتوافر الأيونات)، والرقم الهيدروجيني (pH) (الذي يمكن أن يحدد التفاعلات الممكنة في الماء)، ووجود إضافات متخصصة يمكن أن تثبط التآكل، أو تلميع طلاء مطلي، أو تعديل النتيجة بطريقة أخرى.
فهم المفاضلات
يتطلب التحكم الدقيق وعيًا بقيود وعواقب كل تعديل. إن دفع معلمة واحدة إلى أقصاها غالبًا ما يضر بمعلمة أخرى.
مشكلة الجهد مقابل الانتقائية
في حين أن الجهد الأعلى يزيد من المعدل، فإنه يمكن أن يوفر أيضًا طاقة كافية لبدء تفاعلات غير مرغوب فيها. على سبيل المثال، في محلول مائي، يمكن أن يؤدي الجهد المفرط إلى بدء تقسيم الماء إلى هيدروجين وأكسجين، مما يستهلك الطاقة ويقلل من كفاءة هدفك الأساسي.
كثافة التيار والجودة
الدفع للحصول على تيار عالٍ جدًا (وبالتالي معدل تفاعل عالٍ) يمكن أن يؤدي إلى نتائج ذات جودة رديئة. في الطلاء الكهربائي، يمكن أن يتسبب التيار المرتفع جدًا في استنفاد الأيونات بالقرب من سطح القطب الكهربائي، مما ينتج عنه ترسيب خشن أو مسامي أو محترق. غالبًا ما تتطلب الجودة الصبر وكثافة تيار أقل.
استقرار الإلكتروليت وعمره الافتراضي
الإلكتروليت ليس ثابتًا. يتغير تركيبه أثناء التفاعل حيث يتم استهلاك الأيونات وإدخال الملوثات. يمكن أن تتبخر المذيبات، ويمكن استهلاك الإضافات. هذا "شيخوخة" الإلكتروليت هو المصدر الرئيسي لعدم الاتساق في العمليات الصناعية طويلة الأمد ويتطلب المراقبة والصيانة.
اتخاذ الخيار الصحيح لهدفك
تعتمد استراتيجيتك للتحكم بالكامل على ما تريد تحقيقه. استخدم هذه المبادئ لتوجيه نهجك.
- إذا كان تركيزك الأساسي هو زيادة سرعة التفاعل إلى أقصى حد: استخدم تيارًا أعلى وتأكد من أن تركيز الإلكتروليت مرتفع بما يكفي لدعم هذا المعدل دون استنفاد كبير للأيونات بالقرب من الأقطاب الكهربائية.
- إذا كان تركيزك الأساسي هو تحقيق دقة أو جودة عالية: استخدم كثافة تيار منخفضة ومُتحكم فيها بعناية أو طبق جهدًا محددًا (تحكم جهد ثابت) لضمان سير التفاعل بسلاسة وانتقائية.
- إذا كان تركيزك الأساسي هو استكشاف أخطاء عملية غير متسقة: ابدأ بتحليل الإلكتروليت. يعد تركيبه وتركيزه والتلوث المحتمل من أكثر مصادر تباين العملية شيوعًا.
إتقان هذه المبادئ يحول العملية الكهروكيميائية من صندوق أسود إلى نظام يمكن ضبطه بدقة.
جدول الملخص:
| معيار التحكم | الوظيفة الأساسية | الاعتبار الرئيسي |
|---|---|---|
| الجهد | يوفر القوة الدافعة للتفاعل. | يمكن أن يؤدي الجهد المفرط إلى إثارة تفاعلات جانبية غير مرغوب فيها. |
| التيار | يتحكم مباشرة في سرعة التفاعل. | يمكن أن تؤدي كثافة التيار العالية إلى نتائج ذات جودة رديئة. |
| تركيب الإلكتروليت | يحدد مسارات التفاعل وجودة المنتج. | يتغير التركيب بمرور الوقت، مما يتطلب المراقبة. |
هل أنت مستعد لتحقيق تحكم دقيق في عملياتك الكهروكيميائية؟
في KINTEK، نحن متخصصون في توفير المعدات والمواد الاستهلاكية المخبرية عالية الجودة التي تحتاجها لإتقان تفاعلاتك. سواء كنت تقوم بتطوير مواد جديدة، أو إجراء طلاء كهربائي، أو إجراء أبحاث، فإن حلولنا تساعدك على:
- الحفاظ على تركيبة إلكتروليت متسقة للحصول على نتائج موثوقة.
- تطبيق تحكم دقيق في الجهد والتيار لتحقيق الانتقائية والجودة المثلى.
- توسيع نطاق عملياتك من طاولة المختبر إلى الإنتاج بثقة.
دع خبرائنا يساعدونك في تحسين نظامك الكهروكيميائي. اتصل بنا اليوم لمناقشة تطبيقك وتحدياتك المحددة!
دليل مرئي
المنتجات ذات الصلة
- خلية غاز الانتشار الكهروكيميائية التحليلية خلية تفاعل سائل
- خلية التحليل الكهربائي البصري مزدوجة الطبقة من النوع H مع حمام مائي
- خلية كهروكيميائية كهروكيميائية كوارتز للتجارب الكهروكيميائية
- خلية التحليل الكهربائي من PTFE خلية كهروكيميائية مقاومة للتآكل مختومة وغير مختومة
- خلية كهروكيميائية بالتحليل الكهربائي لتقييم الطلاء
يسأل الناس أيضًا
- ما هي الاحتياطات التي يجب اتخاذها فيما يتعلق بدرجة الحرارة عند استخدام خلية تحليل كهربائي مصنوعة بالكامل من مادة PTFE؟ ضمان تجارب آمنة ودقيقة
- ما هي وظائف الخلايا الإلكتروليتية في تقسيم المياه الكهروكيميائي الضوئي؟ قم بتحسين بحثك الكهروكيميائي الضوئي
- ما هو الغرض من الهيكل مزدوج الطبقات في خلية التحليل الكهربائي من النوع H؟ تحقيق تحكم دقيق في درجة الحرارة
- ما هي الوظائف الأساسية للخلية الإلكتروليتية عالية الأداء في عملية اختزال ثاني أكسيد الكربون الكهروكيميائي (eCO2R)؟ حسّن نتائج مختبرك
- ما هو الغرض من استخدام أنبوب زجاجي مسامي في خلية ثلاثية الأقطاب؟ تعزيز دقة اختبار الفاناديوم الأكسدة والاختزال



















