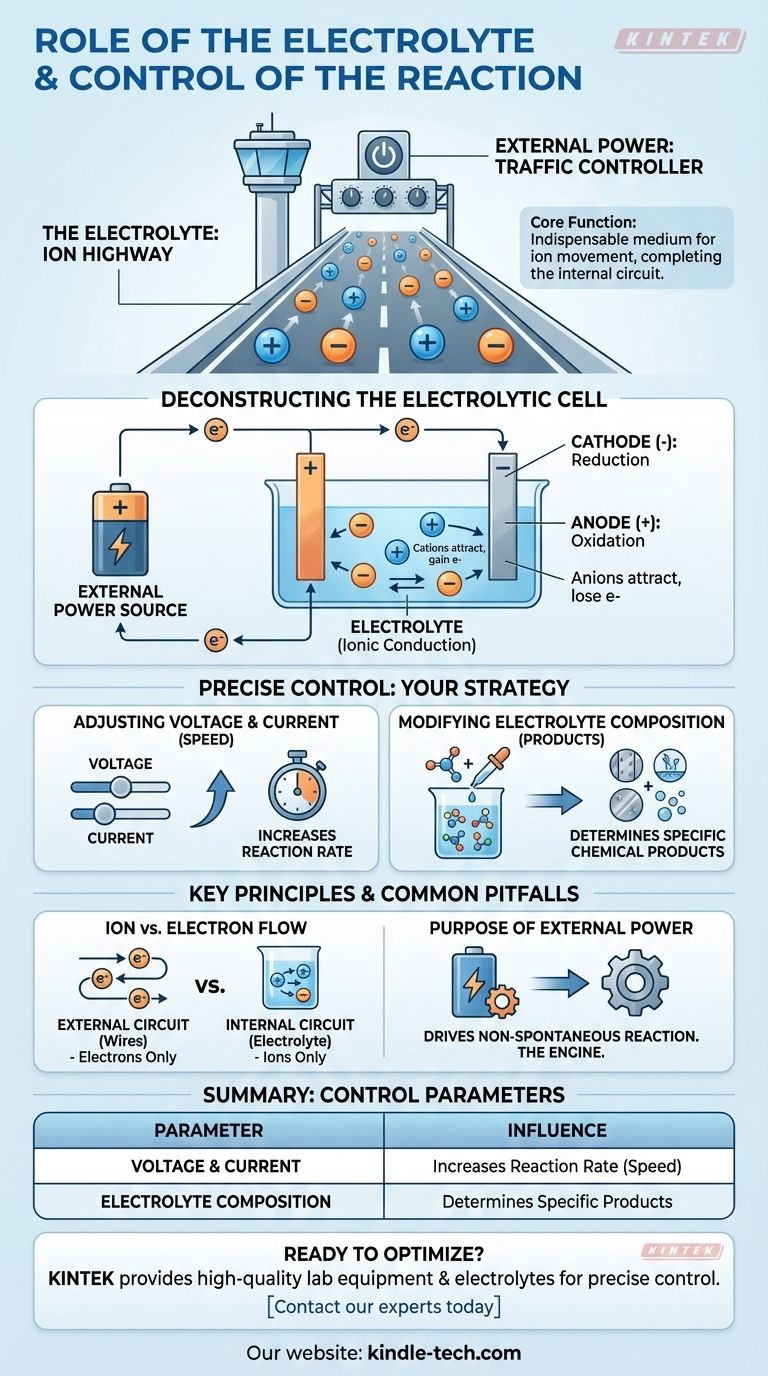
في جوهره، يعتبر الإلكتروليت هو الوسط الذي لا غنى عنه لحركة الأيونات داخل الخلية، مما يكمل الدائرة الكهربائية التي تسمح بحدوث تفاعل كيميائي. يتم التحكم في التفاعل نفسه بدقة من خلال التلاعب بالمدخلات الكهربائية الخارجية – وتحديداً الفولتية والتيار – ومن خلال تغيير التركيب الكيميائي لمحلول الإلكتروليت.
يعمل الإلكتروليت بمثابة "طريق سريع للأيونات"، مما يسمح للجسيمات المشحونة بالانتقال بين الأقطاب الكهربائية داخل الخلية. ويعمل مصدر الطاقة الخارجي بمثابة "مراقب حركة المرور"، حيث يحدد سرعة واتجاه التفاعل الكيميائي من خلال إدارة تدفق الإلكترونات.

الدور الأساسي للإلكتروليت
يتطلب التفاعل الكهروكيميائي دائرة كاملة. الإلكتروليت مسؤول عن النصف الداخلي لتلك الدائرة، وهو دور يختلف جوهريًا عن الأسلاك المتصلة خارجيًا.
ما هو الإلكتروليت؟
الإلكتروليت هو محلول، عادة ما يكون مائيًا أو عضويًا، يحتوي على أيونات متفككة.
هذه الأيونات الموجبة والسالبة الحرة هي ما يجعل المحلول موصلاً للكهرباء.
تمكين التوصيل الأيوني
الوظيفة الأساسية للإلكتروليت هي التوصيل الأيوني.
بينما تتدفق الإلكترونات عبر الأسلاك الخارجية، يجب أن تتدفق الأيونات عبر المحلول بين القطبين. هذه الحركة للأيونات المشحونة تكمل الدائرة، مما يسمح باستمرار التفاعل.
تفكيك الخلية الإلكتروليتية
في الخلية الإلكتروليتية، يدفع مصدر طاقة خارجي تفاعلًا كيميائيًا لن يحدث من تلقاء نفسه. وإليك كيفية عمل المكونات معًا.
مصدر الطاقة الخارجي
تبدأ العملية بمصدر طاقة خارجي، مثل بطارية أو مزود طاقة.
تضخ هذه المصادر الإلكترونات بنشاط، مما يخلق فرقًا في الشحنة بين القطبين مما يجبر التفاعل على المضي قدمًا.
المهبط (موقع الاختزال)
يدفع المصدر الخارجي الإلكترونات إلى المهبط، مما يمنحه شحنة سالبة.
تجذب هذه الشحنة السالبة الأيونات الموجبة الشحنة (الكاتيونات) من الإلكتروليت. عندما تصل هذه الأيونات إلى المهبط، فإنها تكتسب إلكترونات في عملية تسمى الاختزال.
المصعد (موقع الأكسدة)
في الوقت نفسه، يسحب المصدر الخارجي الإلكترونات بعيدًا عن المصعد، مما يمنحه شحنة موجبة.
تجذب هذه الشحنة الموجبة الأيونات السالبة الشحنة (الأنيونات) من الإلكتروليت. عند المصعد، تفقد هذه الأيونات الإلكترونات في عملية تعرف باسم الأكسدة.
كيف يتم التحكم في التفاعل بدقة
لديك تحكم مباشر في نتيجة ومعدل التفاعل الكهروكيميائي عن طريق تعديل ثلاثة معايير رئيسية.
تعديل الفولتية والتيار
يمكن اعتبار الفولتية بمثابة "الضغط" الكهربائي الذي يدفع التفاعل، بينما التيار هو معدل تدفق الإلكترونات.
ستؤدي زيادة الفولتية والتيار بشكل عام إلى زيادة معدل حدوث التفاعل الكيميائي. وهذا يمنحك تحكمًا مباشرًا وفي الوقت الفعلي في سرعة العملية.
تعديل تركيب الإلكتروليت
يتم تحديد التفاعل الكيميائي المحدد الذي يحدث بواسطة الأيونات المتاحة في الإلكتروليت.
عن طريق تغيير تركيب الإلكتروليت – على سبيل المثال، باستخدام ملح أو مذيب مختلف – يمكنك تغيير المنتجات التي تتكون عند المصعد والمهبط.
المزالق الشائعة والمبادئ الأساسية
لفهم النظام حقًا، من الأهمية بمكان التمييز بين نصفي الدائرة وطبيعة الخلية.
حركة الأيونات مقابل تدفق الإلكترونات
نقطة الالتباس الشائعة هي الفرق بين ما يحدث داخل وخارج الخلية.
تتدفق الإلكترونات فقط عبر الدائرة الخارجية (الأسلاك). تتدفق الأيونات فقط عبر الدائرة الداخلية (الإلكتروليت). التفاعل على أسطح الأقطاب هو ما يربط بين هذين المسارين المتميزين.
الغرض من الطاقة الخارجية
من الأهمية بمكان أن نتذكر أن هذه العملية تصف خلية إلكتروليتية.
في هذه الخلايا، تُستخدم الطاقة الكهربائية لدفع تفاعل كيميائي غير تلقائي. مصدر الطاقة الخارجي ليس اختياريًا؛ إنه المحرك الذي يجعل العملية برمتها ممكنة.
اتخاذ القرار الصحيح لهدفك
تعتمد استراتيجية التحكم الخاصة بك كليًا على ما تريد تحقيقه من التفاعل.
- إذا كان تركيزك الأساسي هو تسريع معدل التفاعل: قم بزيادة الفولتية والتيار المطبقين لدفع تدفق الإلكترونات والأيونات بشكل أسرع.
- إذا كان تركيزك الأساسي هو إنشاء منتج كيميائي محدد: اختر بعناية تركيب الإلكتروليت وتحكم فيه لضمان توفر الأيونات المطلوبة للتفاعل.
- إذا كان تركيزك الأساسي هو فهم كفاءة النظام: يجب عليك مراقبة كل من تدفق الإلكترونات (التيار) في الدائرة الخارجية والتغير الكيميائي الناتج (تحويل الأيونات) عند الأقطاب الكهربائية.
في النهاية، إتقان العملية الكهروكيميائية يعني فهم أن الإلكتروليت والدائرة الخارجية هما نصفان لنظام واحد يمكن التحكم فيه.
جدول الملخص:
| معامل التحكم | كيف يؤثر على التفاعل |
|---|---|
| الفولتية والتيار | يزيد من معدل (سرعة) التفاعل الكيميائي. |
| تركيب الإلكتروليت | يحدد المنتجات الكيميائية المحددة المتكونة. |
هل أنت مستعد لتحسين عمليتك الكهروكيميائية؟
سواء كنت تقوم بتطوير مواد جديدة، أو بالطلاء الكهربائي، أو بإجراء اختبارات تحليلية دقيقة، فإن التحكم في تفاعلك الكهروكيميائي أمر بالغ الأهمية. تتخصص KINTEK في توفير معدات ومواد استهلاكية مخبرية عالية الجودة لجميع احتياجات مختبرك، بما في ذلك مصادر الطاقة الموثوقة والإلكتروليتات النقية.
اتصل بخبرائنا اليوم لمناقشة كيف يمكننا مساعدتك في تحقيق تحكم دقيق ونتائج ممتازة في مختبرك.
دليل مرئي
المنتجات ذات الصلة
- خلية التحليل الكهربائي البصري مزدوجة الطبقة من النوع H مع حمام مائي
- خلية التحليل الكهربائي من النوع H خلية كهروكيميائية ثلاثية
- خلية تحليل كهربائي مزدوجة الطبقة بخمسة منافذ وحمام مائي
- خلية كهروكيميائية كهروكيميائية كوارتز للتجارب الكهروكيميائية
- خلية كهروكيميائية بالتحليل الكهربائي لتقييم الطلاء
يسأل الناس أيضًا
- ما هو هيكل خلية التحليل الكهربائي ذات الغشاء القابل للتبديل من النوع H؟ دليل للفصل الكهروكيميائي الدقيق
- ما هي الميزات الرئيسية لخلية التحليل الكهربائي ذات الحمام المائي مزدوج الطبقة؟ حقق تحكمًا دقيقًا في درجة الحرارة لتجاربك
- ما هو الغرض من الهيكل مزدوج الطبقات في خلية التحليل الكهربائي من النوع H؟ تحقيق تحكم دقيق في درجة الحرارة
- ما هي الأحجام وتكوينات الفتحات النموذجية لخلية تحليل كهربائي مزدوجة الطبقة بحمام مائي؟ حسّن إعدادك الكهروكيميائي
- ما هو النظام التجريبي النموذجي المستخدم مع خلية التحليل الكهربائي ذات الحمام المائي المزدوج الطبقة؟ تحقيق تحكم كهروكيميائي دقيق



















