جدول المحتويات
مقدمة في الخلايا الكهروكيميائية
الخلايا الكهروكيميائية تقع في قلب عملية تخزين الطاقة وتحويلها. فهي تسخّر التفاعلات الكيميائية لتوليد الكهرباء أو الاستفادة من الكهرباء لدفع التفاعلات الكيميائية. تُعد هذه الخلايا مكونات أساسية في مختلف الأنظمة الكهروكيميائية، بما في ذلك البطاريات وخلايا الوقود والطلاء الكهربائي، وهي ضرورية للتقدم في تقنيات الطاقة والمركبات الكهربائية والهندسة الكهروكيميائية.
أنواع الخلايا الكهروكيميائية
الخلايا الكهروكيميائية هي أجهزة تقوم بتحويل الطاقة الكيميائية إلى طاقة كهربائية (الخلايا الفولتية) أو العكس (الخلايا الإلكتروليتية). وهي تتكون من قطبين كهربائيين، مهبط وأنود، مغمورين في محلول إلكتروليت.
الخلايا الفولتية
تُعرف أيضاً بالخلايا الجلفانية، تولد الخلايا الفولتية الكهرباء من التفاعلات الكيميائية التلقائية. في الخلية الفولتية، يكون المصعد هو القطب السالب حيث تحدث الأكسدة في الخلية الفولتية، ويطلق إلكترونات. تتدفق هذه الإلكترونات عبر دائرة خارجية إلى المهبط، وهو القطب الموجب، حيث يحدث الاختزال. تدفع الطبيعة التلقائية للتفاعل تدفق الإلكترونات وتولد تياراً كهربائياً.
الخلايا الإلكتروليتية
من ناحية أخرى، تستخدم الخلايا الإلكتروليتية الكهرباء لدفع التفاعلات الكيميائية غير التلقائية. في الخلية الإلكتروليتية، يكون المهبط هو القطب السالب حيث يحدث الاختزال، ويكون المصعد هو القطب الموجب حيث تحدث الأكسدة. ويوفر مصدر طاقة خارجي الطاقة الكهربائية اللازمة لإجبار التفاعل غير التلقائي على الاستمرار.
الاختلافات الرئيسية
تتمثل الاختلافات الرئيسية بين الخلايا الفولتية والخلايا الإلكتروليتية في:
- العفوية: تولد الخلايا الفولتية الكهرباء من التفاعلات التلقائية، بينما تتطلب الخلايا الإلكتروليتية طاقة خارجية لدفع التفاعلات غير التلقائية.
- اتجاه تدفق الإلكترونات: في الخلايا الفولتية، تتدفق الإلكترونات من المصعد إلى المهبط عبر الدائرة الخارجية. في الخلايا الإلكتروليتية، تتدفق الإلكترونات من المهبط إلى القطب السالب إلى القطب الموجب عبر الدائرة الخارجية.
- التطبيقات: تستخدم الخلايا الفولتية في البطاريات والخلايا الشمسية وغيرها من الأجهزة التي تولد الكهرباء. تُستخدَم الخلايا الإلكتروليتية في الطلاء الكهربائي وتكرير المعادن والعمليات الصناعية الأخرى.
مكوِّنات الخلايا الكهروكيميائية
تتكون الخلايا الكهروكيميائية عادةً من المكونات التالية:
- الأقطاب الكهربائية: المهبط والأنود، مصنوعان من مواد موصلة (مثل المعادن والجرافيت).
- المنحل بالكهرباء: المحلول أو الملح المنصهر الذي يوصل الأيونات، مما يسمح بتدفق التيار بين الأقطاب الكهربائية.
- فاصل: حاجز مسامي يمنع الأقطاب الكهربائية من التلامس المباشر ولكنه يسمح بمرور الأيونات.
معلومات إضافية
- جهد الخلية، أو جهد الخلية، لخلية كهروكيميائية هو مقياس للقوة الدافعة للتفاعل. في الخلايا الفولتية، يكون جهد الخلية موجبًا، مما يشير إلى تفاعل تلقائي. في الخلايا الكهروكيميائية، يكون جهد الخلية سالبًا، ما يشير إلى تفاعل غير تلقائي.
- تتحدد كفاءة الخلية الكهروكيميائية بعوامل مثل مواد القطب وتركيز الإلكتروليت ودرجة الحرارة.
- وتؤدي الخلايا الكهروكيميائية دورًا حاسمًا في العديد من التطبيقات التكنولوجية، بما في ذلك تخزين الطاقة والتخليق الكيميائي والمعالجة البيئية.
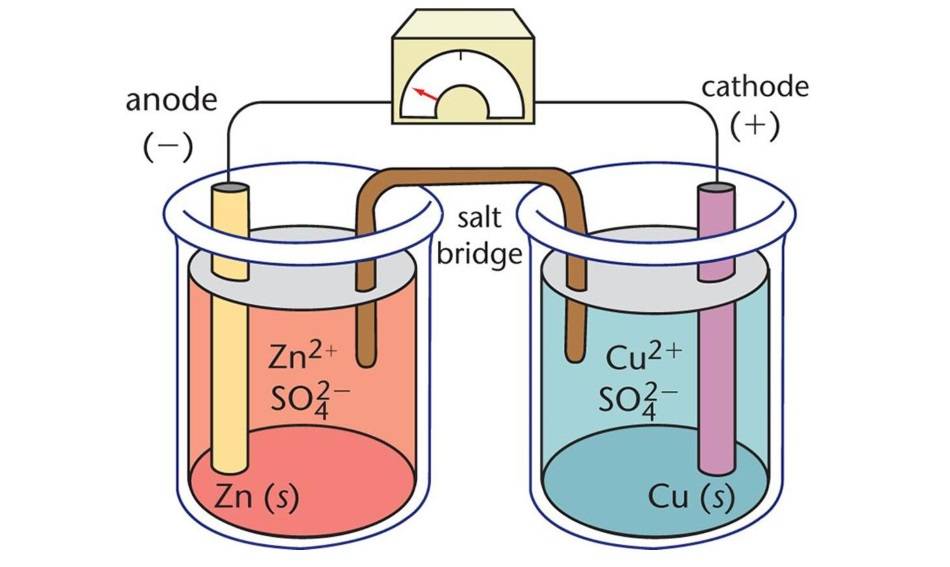
مكونات الخلايا الإلكتروليتية
الخلايا الكهروكيميائية، وهي نوع من الخلايا الكهروكيميائية، هي أجهزة تستخدم الطاقة الكهربائية لدفع التفاعلات الكيميائية غير التلقائية. وتتكون من ثلاثة مكونات أساسية: الأنود والكاثود والإلكتروليت.
الأنود
يعمل المصعد بمثابة القطب السالب في الخلية الإلكتروليتية. أثناء التفاعل الكهروكيميائي، يطلق الأنود الإلكترونات إلى الدائرة الخارجية ويخضع للأكسدة. بعبارة أخرى، الأنود هو المكان الذي يحدث فيه فقدان الإلكترونات والأكسدة.
الكاثود
يعمل المهبط، من ناحية أخرى، بمثابة القطب الموجب. يكتسب الإلكترونات من الدائرة الخارجية ويتم اختزاله أثناء التفاعل الكهروكيميائي. وبالتالي، فإن المهبط هو المكان الذي يحدث فيه اكتساب الإلكترونات والاختزال.
الإلكتروليت
الإلكتروليت هو مادة تحتوي على أيونات متحركة عند إذابتها في مذيب أو ذوبانها. في الخلايا الإلكتروليتية، يوفر الإلكتروليت وسيطًا لتدفق الأيونات بين المصعد والكاثود، مما يكمل الدائرة الكهربائية. تشمل الإلكتروليتات الشائعة المحاليل المائية للأملاح والأملاح المنصهرة.
الاختلافات الرئيسية عن الخلايا الجلفانية
تختلف الخلايا الإلكتروليتية عن الخلايا الجلفانية في عدة جوانب رئيسية:
- تفاعلات الخلية: تتطلب الخلايا الإلكتروليتية مصدرًا خارجيًا للطاقة الكهربائية لتشغيل التفاعلات غير التلقائية، بينما تولد الخلايا الجلفانية طاقة كهربائية من التفاعلات التلقائية.
- تدفق الطاقة: تستهلك الخلايا الإلكتروليتية طاقة كهربائية لتحفيز التفاعلات غير التلقائية، بينما تحول الخلايا الجلفانية الطاقة الكيميائية إلى طاقة كهربائية.
- شحنات الأقطاب الكهربائية: في الخلايا الإلكتروليتية، يكون القطب الموجب سالبًا والكاثود موجبًا، بينما في الخلايا الجلفانية يكون القطب الموجب موجبًا والكاثود سالبًا.
عمل الخلية الإلكتروليتية
يتضمن تشغيل الخلية الإلكتروليتية الخطوات التالية:
- يتم توصيل مصدر طاقة خارجي (مثل البطارية) بأقطاب الخلية الإلكتروليتية.
- يوفر مصدر الطاقة الطاقة الطاقة الكهربائية، التي تدفع التفاعل غير التلقائي.
- وعند المصعد، تحدث الأكسدة عند الأنود، مما يؤدي إلى إطلاق الإلكترونات في الدائرة الخارجية.
- تتدفق الإلكترونات عبر الدائرة الخارجية إلى المهبط.
- وعند المهبط، يحدث الاختزال، مما يستهلك إلكترونات من الدائرة الخارجية.
- وتنتقل الأيونات الموجودة في الإلكتروليت للحفاظ على التعادل الكهربي، فتكتمل الدائرة.
تطبيقات الخلايا الإلكتروليتية
للخلايا الإلكتروليتية العديد من التطبيقات العملية، بما في ذلك:
- الطلاء بالكهرباء: ترسيب طبقة رقيقة من المعدن على سطح ما لأغراض التزيين أو الحماية.
- التحليل الكهربائي للماء: إنتاج الهيدروجين والأكسجين من الماء، والذي يُستخدم في خلايا الوقود والتطبيقات الأخرى.
- إنتاج المواد الكيميائية: تصنيع المواد الكيميائية المختلفة، مثل الكلور وهيدروكسيد الصوديوم والألومنيوم.
- تكرير المعادن: تنقية المعادن عن طريق إزالة الشوائب من خلال التحليل الكهربائي.

إمكانات الأقطاب الكهربائية وتفاعلات الأكسدة والاختزال
تسهل الخلايا الكهروكيميائية تفاعلات الأكسدة والاختزال (الأكسدة والاختزال). وتأتي هذه الخلايا في شكلين: الخلايا الجلفانية (الفولطائية)، حيث تحدث التفاعلات التلقائية، والخلايا الكهروكيميائية حيث تحدث التفاعلات غير التلقائية.
في الخلايا الكهروكيميائية، يحدث تفاعل الأكسدة عند المصعد (الطرف السالب)، بينما يحدث تفاعل الاختزال عند المهبط (الطرف الموجب). في الخلايا الكهروكيميائية، يجذب المصعد الأنيونات مما يجعله موجبًا، بينما في الخلايا الجلفانية، يكون المصعد سالبًا بسبب إطلاق الإلكترونات من تفاعل الأكسدة التلقائي.
يتحدد اتجاه تدفق الإلكترونات وعفوية تفاعلات الأكسدة والاختزال من خلال جهد القطب، وهو فرق الجهد بين القطبين. يُستخدم قطب الهيدروجين القياسي (SHE) كنقطة مرجعية، بجهد 0 فولت.
يوفِّر جهد الخلية، الذي يمكن التنبؤ به باستخدام جهد القطب، تقديرًا للجهد المقيس. لحساب إمكانات الخلية، يجب موازنة معادلات تفاعل نصف الخلية وتحديد فرق الجهد بين إمكانات القطبين.
يلعب المهبط والمصعد أدوارًا مختلفة في الخلايا الكهروكيميائية:
المهبط:
- إشارة موجبة بسبب استهلاك الإلكترون
- يحدث تفاعل الاختزال
- دخول الإلكترونات
الأنود:
- إشارة سالبة بسبب إطلاق الإلكترونات
- يحدث تفاعل الأكسدة
- خروج الإلكترونات
وفقًا للاصطلاح، يُمثَّل المهبط على الجانب الأيمن، بينما يُمثَّل المصعد على الجانب الأيسر عند الإشارة إلى الخلية الكهروكيميائية.
تطبيقات الخلايا الكهروكيميائية
للخلايا الكهروكيميائية مجموعة واسعة من التطبيقات في مختلف المجالات، بما في ذلك تخزين الطاقة والتحويل والعمليات الصناعية.
الطلاء بالكهرباء
الطلاء بالكهرباء هو عملية تستخدم الخلايا الكهروكيميائية لتطبيق طبقة رقيقة من المعدن على سطح معدن آخر. تعزز هذه العملية خصائص المعدن الأساسي، مثل مقاومة التآكل ومقاومة التآكل ومقاومة التآكل ومقاومة التآكل. ويستخدم الطلاء الكهربائي على نطاق واسع في الصناعات، بما في ذلك السيارات والإلكترونيات والمجوهرات، لأغراض وظيفية وجمالية على حد سواء.
البطاريات
تشكل الخلايا الكهروكيميائية أساس البطاريات، وهي مكونات أساسية في العديد من الأجهزة والأجهزة الإلكترونية. تقوم البطاريات بتخزين الطاقة الكيميائية وتحويلها إلى طاقة كهربائية عند الحاجة. وهي ضرورية لتشغيل الأجهزة المحمولة، مثل الهواتف الذكية وأجهزة الكمبيوتر المحمولة والمركبات الكهربائية.
الاستخلاص الكهربائي والتكرير الكهربائي
تُستخدم الخلايا الكهروكيميائية في عمليات الاستخلاص الكهربائي والتكرير الكهربائي لإنتاج المعادن وتنقيتها. وينطوي الاستخلاص الكهربي على استخلاص المعادن من الخامات أو المصادر الأخرى باستخدام التحليل الكهربي، بينما يعمل التكرير الكهربي على تنقية المعادن عن طريق إزالة الشوائب. وتعد هذه العمليات حاسمة في الحصول على معادن عالية النقاء، مثل النحاس والزنك والألومنيوم، وهي ضرورية لمختلف التطبيقات الصناعية.
تطبيقات أخرى
تجد الخلايا الكهروكيميائية أيضًا تطبيقات في مجالات أخرى مختلفة:
- معالجة المياه: تُستخدم في التحليل الكهربي للمياه لإنتاج غاز الهيدروجين وغاز الأكسجين، وهما ضروريان لخلايا الوقود والعمليات الصناعية الأخرى.
- خلايا الوقود: الخلايا الكهروكيميائية هي المكونات الأساسية لخلايا الوقود، التي تولد الكهرباء من خلال التفاعلات الكهروكيميائية التي تتضمن الهيدروجين والأكسجين.
- التخليق الكيميائي: يمكن استخدام الخلايا الكهروكيميائية في عمليات التخليق الكيميائي لإنتاج مواد كيميائية ومواد مختلفة.
- أجهزة الاستشعار وأجهزة الاستشعار الحيوية: تُستخدم الخلايا الكهروكيميائية في أجهزة الاستشعار وأجهزة الاستشعار الحيوية للكشف عن مواد معينة وتحليلها بناءً على خصائصها الكهروكيميائية.

الخاتمة
الخلايا الكهروكيميائيةمع قدرتها على تحويل الطاقة الكيميائية إلى طاقة كهربائية والعكس، هي أدوات لا غنى عنها في مختلف المجالات. فهي بمثابة الأساس لتخزين الطاقة وتحويلها والعديد من العمليات الصناعية. من البطاريات التي تزود أجهزتنا بالطاقة إلى خلايا الوقود التي تولد الطاقة النظيفة، تواصل الخلايا الكهروكيميائية تشكيل التطورات التكنولوجية. إن فهم مبادئها وتطبيقاتها أمر بالغ الأهمية لمزيد من الابتكارات في تقنيات الطاقة والحلول المستدامة والهندسة الكهروكيميائية.
المنتجات ذات الصلة
- خلية التحليل الكهربائي من النوع H خلية كهروكيميائية ثلاثية
- خلية غاز الانتشار الكهروكيميائية التحليلية خلية تفاعل سائل
- خلية كهروكيميائية بالتحليل الكهربائي لتقييم الطلاء
- خلية كهروكيميائية بصرية بنافذة جانبية
- خلية كهروكيميائية كهروكيميائية كوارتز للتجارب الكهروكيميائية
المقالات ذات الصلة
- تطبيقات الخلايا الالكتروليتية في التنقية والطلاء الكهربائي
- فهم خلايا الكوارتز الإلكتروليتية: التطبيقات والآليات والمزايا
- الكيمياء الكهربائية العلم وراء الخلايا الكهروكيميائية
- فن المقاومة: لماذا تحتاج خليتك الكهروكيميائية إلى مساحة للتنفس
- التغلب على التحديات من خلال تشغيل الخلايا الكهروضوئية من النوع H




















