تعريف ووظيفة القطب
جدول المحتويات
وصف القطب
القطب هو النقطة التي يدخل فيها التيار ويخرج المنحل بالكهرباء. إنه موصل يستخدم لعمل تقاطع مع جزء غير معدني من الدائرة. يمكن تصنيع الأقطاب الكهربائية من مواد مثل الذهب أو البلاتين أو الكربون أو الجرافيت أو المعدن. وهي بمثابة السطح لتفاعلات الأكسدة والاختزال في الخلايا الكهروكيميائية. هناك أنواع مختلفة من الأقطاب الكهربائية، بما في ذلك الأنود والكاثود.
دور القطب في الخلية الكهروكيميائية
الأقطاب الكهربائية هي مكونات أساسية للخلايا الكهروكيميائية. فهي تنقل الإلكترونات المنتجة في الخلية من نصف خلية إلى آخر، مما يؤدي إلى توليد شحنة كهربائية. الكاثود هو القطب الذي يخرج منه التيار من الخلية، بينما الأنود هو القطب الذي يدخل منه التيار إلى الخلية. يعمل الإلكتروليت الموجود في الخلية كقناة لتدفق الإلكترونات بين الكاثود والأنود. يتم حساب جهد الخلية بناءً على نظام قطب كهربائي قياسي مع جهد مرجعي قدره 0 فولت.

الفرق بين الأنود والكاثود
للأنود والكاثود أدوار مختلفة في الخلية الكهروكيميائية. يتم شحن الكاثود سالبًا في الخلايا الإلكتروليتية، ويحدث تفاعل اختزال عند هذا القطب. تنتقل الإلكترونات إلى الكاثود أثناء عمل الخلية. من ناحية أخرى، يتم شحن الأنود بشكل إيجابي في الخلايا الإلكتروليتية، ويحدث تفاعل أكسدة عند هذا القطب. تتحرك الإلكترونات خارج الأنود أثناء عمل الخلية. من المهم ملاحظة أن أدوار الأنود والكاثود يمكن أن تتغير اعتمادًا على اتجاه تدفق الإلكترون.
باختصار، الأقطاب الكهربائية هي موصلات تستخدم في الخلايا الكهروكيميائية لتسهيل نقل الإلكترون. إنها تلعب دورًا حاسمًا في عمل هذه الخلايا ويتم تصنيفها على أنها أنودات أو كاثودات بناءً على نوع التفاعل الكيميائي الذي يحدث. يعد فهم أدوار ووظائف الأقطاب الكهربائية أمرًا ضروريًا في دراسة الكيمياء الكهربائية.
ميكانيكا القطب
عملية الأكسدة والاختزال على سطح القطب
القطب هو سطح معدني حيث يتم إنشاء توازن الأكسدة والاختزال بين المعدن والمحلول الذي يتم وضعه فيه. يمكن أن يكون القطب إما أنودًا أو كاثودًا.
الأنود: يستقبل الأنود التيار أو الإلكترونات من خليط الإلكتروليت، مما يؤدي إلى أكسدته. عندما تقترب الذرات أو الجزيئات من سطح الأنود، يتبرع المحلول بالإلكترونات، مما يؤدي إلى تكوين أيونات موجبة.
الكاثود: من ناحية أخرى، يطلق الكاثود إلكترونات في المحلول، مما يؤدي إلى الاختزال.
يجب أن يكون القطب مستقرًا ومقاومًا للتآكل، إلا في الحالات التي يكون فيها القطب مضحيًا أو يُستخدم في عمليات محددة. يمكن أن يتسبب الإجراء الميكانيكي في تدهور الأقطاب الكهربائية، مثل إطلاق جسيمات الجرافيت، والتي قد تتطلب الترشيح. يمكن أن يكون تورم القطب أيضًا مشكلة مع بعض المواد.
دور الأنود والكاثود في هذه العمليات
تلعب الأنودات والكاثودات أدوارًا حاسمة في الأنظمة الكهروكيميائية، مثل البطاريات وخلايا الوقود والخلايا الكهروضوئية والخلايا الإلكتروليتية والثنائيات.

الأنود: يشير الأنود إلى القطب الذي تحدث فيه الأكسدة أو حيث تتدفق الإلكترونات. وهو الطرف أو الموصل الذي تخرج منه الإلكترونات من الخلية الكهروكيميائية، مما يسبب حدوث الأكسدة. في الخلايا الأولية، يكون الأنود ثابتًا ولا يمكن إعادة شحنه، بينما في الخلايا الثانوية، يمكن أن يتغير القطب الموجب حسب اتجاه التيار.
الكاثود: يشير الكاثود إلى القطب الذي يحدث فيه الاختزال أو حيث تتدفق الإلكترونات. وتدخل الإلكترونات الخلية عند الكاثود وتشارك في تفاعلات الاختزال. على غرار الأنود، يمكن للكاثود أيضًا تغيير القطبية في الخلايا الثانوية.
يمكن أن يكون التآكل في الأقطاب الكهربائية شديدًا، خاصة عندما تكون هناك إمكانات متقلبة في المنحل بالكهرباء أو عند استخدام معادن مختلفة كالأنود والكاثود. ومع ذلك، يمكن أن تساعد المثبطات وغيرها من الطرق الوقائية في تقليل هجمات الأقطاب الكهربائية.
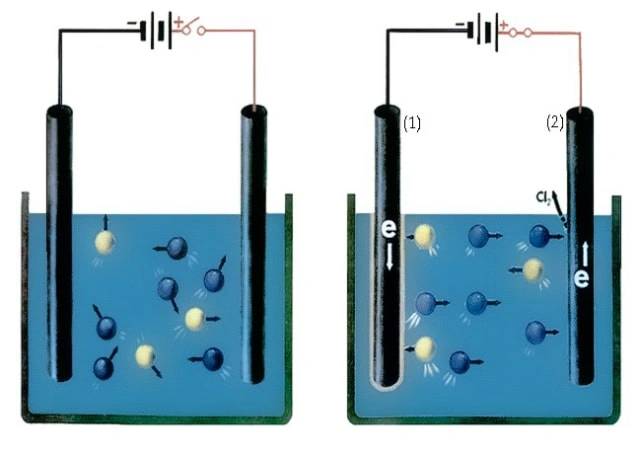
التحليل الكهربائي هو عملية تحدث في الخلايا التحليلية، حيث يتم استخدام الطاقة الكهربائية لإجراء تفاعلات كيميائية غير تلقائية. تحدث الأكسدة عند القطب الموجب (اللوحة الموجبة)، بينما يحدث الاختزال عند الكاثود (اللوحة السالبة).
إن فهم آليات القطب الكهربائي، بما في ذلك عمليات الأكسدة والاختزال، وكذلك أدوار الأنود والكاثود، أمر بالغ الأهمية في مختلف التطبيقات الكهروكيميائية.
التركيب المادي للقطب الكهربائي
متطلبات مادة القطب
يتم تحديد كفاءة الخلايا الكهروكيميائية من خلال الخواص الفيزيائية للأقطاب الكهربائية. يلعب التركيب المادي للقطب الكهربائي دورًا حاسمًا في أدائه. الشرط الرئيسي لمواد القطب هو الموصلية. يمكن استخدام أي مادة موصلة مثل المعادن أو أشباه الموصلات أو الجرافيت أو البوليمرات الموصلة كقطب كهربائي. في كثير من الحالات، تتكون الأقطاب الكهربائية من مجموعة من المواد، ولكل منها مهمة محددة. تشمل هذه المواد:
- المواد الفعالة: هذه هي الجزيئات التي تخضع للأكسدة أو الاختزال في القطب.
- العوامل الموصلة: تعمل على تحسين موصلية القطب.
- المجلدات: يتم استخدامها لاحتواء الجزيئات النشطة داخل القطب.
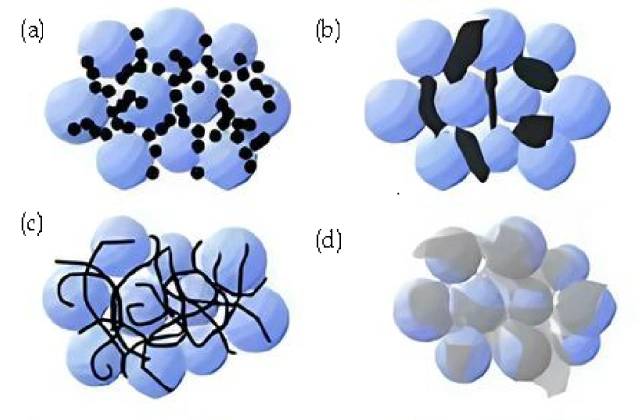
![ملخص العوامل الموصلة (أ. أسود الكربون، الجسيمات النانوية الصلبة؛ الاتصال من نقطة إلى نقطة. ب. الجرافيت الموصل، جسيمات الميكرون الصلبة؛ الاتصال من نقطة إلى نقطة. ج. أنابيب الكربون النانوية المرنة؛ الاتصال الخطي والنقطة د. الجرافيت ، ورقة مرنة؛ الاتصال السطحي والنقطة.)]()
ملخص العوامل الموصلة (أ. أسود الكربون، الجسيمات النانوية الصلبة؛ الاتصال من نقطة إلى نقطة. ب. الجرافيت الموصل، جسيمات الميكرون الصلبة؛ الاتصال من نقطة إلى نقطة. ج. أنابيب الكربون النانوية المرنة؛ الاتصال الخطي والنقطة د. الجرافيت ، ورقة مرنة؛ الاتصال السطحي والنقطة.)
بالإضافة إلى الموصلية، تشمل الخصائص الهامة الأخرى للأقطاب الكهربائية المقاومة الكهربائية، والسعة الحرارية المحددة، وإمكانات القطب، والصلابة. تعد تكلفة المادة أيضًا عاملاً مهمًا يجب مراعاته في التطبيقات التكنولوجية.
أمثلة على الأقطاب الكهربائية الخاملة والمتفاعلة
يمكن أن يكون القطب خاملًا أو متفاعلًا، اعتمادًا على مشاركته في تفاعل الأكسدة والاختزال (الأكسدة والاختزال). لا تشارك الأقطاب الكهربائية الخاملة في التفاعل وهي غير متفاعلة كيميائيًا. تشمل أمثلة الأقطاب الكهربائية الخاملة الجرافيت (الكربون)، والبلاتين، والذهب، والروديوم. تُستخدم هذه المواد عندما يكون الغرض الوحيد للقطب هو تسهيل تدفق التيار في الخلية الكهروكيميائية.
من ناحية أخرى، تشارك الأقطاب الكهربائية التفاعلية بنشاط في تفاعل الأكسدة والاختزال. أنها تخضع للأكسدة أو الاختزال جنبا إلى جنب مع المواد المتفاعلة. على سبيل المثال، يعتبر قطب المغنيسيوم قطبًا نشطًا لأنه يشارك في التفاعل. يعتمد الاختيار بين الأقطاب الكهربائية الخاملة والمتفاعلة على المتطلبات المحددة للعملية الكهروكيميائية.
دور القطب في التفاعل
يعمل القطب كمنصة لحدوث تفاعل الأكسدة والاختزال. في بعض الحالات، يتم استخدام الأشكال الصلبة من المواد المتفاعلة كأقطاب كهربائية. على سبيل المثال، في الخلية الكهروكيميائية النحاسية والفضية، يكون النحاس والفضة بمثابة المواد المتفاعلة والأقطاب الكهربائية. تسهل الأقطاب الكهربائية المتفاعلة نقل الإلكترونات والأيونات أثناء تفاعل الأكسدة والاختزال.
وبدلاً من ذلك، في التفاعلات التي تتطلب قطبًا كهربائيًا خاملًا، يتم استخدام المعدن الذي لا يشارك في التفاعل. مثال على ذلك البلاتين في تفاعل قطب الهيدروجين القياسي (SHE). يسمح القطب الخامل بتدفق التيار دون التدخل في التفاعل الكيميائي.
يعد اختيار مادة القطب أمرًا بالغ الأهمية لتحقيق الإنتاجية المثلى والانتقائية في العمليات الكهروكيميائية. تؤثر خصائص المادة على حركية وديناميكية نقل الإلكترون ويمكن أن تحدد نجاح أو فشل التحول. تلعب الاعتبارات مثل التكلفة، والاستقرار، وقابلية المعالجة في أشكال مختلفة أيضًا دورًا في اختيار مادة القطب الكهربائي المناسبة.
يعد تركيب المواد والبنية الداخلية للقطب الكهربائي من العوامل الأساسية التي تحدد أدائه. إن الجمع بين المواد الفعالة، والعوامل الموصلة، والمواد الرابطة في ملاط القطب الكهربائي يعزز توصيله ووظيفته. يتم بعد ذلك تغليف الخليط على موصل، والذي يعمل كمجمع التيار في الخلية الكهروكيميائية.
باختصار، يؤثر تركيب مادة القطب، سواء كان خاملًا أو متفاعلًا، بشكل كبير على كفاءته ووظيفته في العمليات الكهروكيميائية. ينبغي أن يعتمد اختيار مادة القطب الكهربائي على المتطلبات المحددة للتطبيق، مع الأخذ في الاعتبار عوامل مثل الموصلية والاستقرار والتكلفة.
أمثلة على الأقطاب الكهربائية
أمثلة على الأقطاب الكهربائية الخاملة والمتفاعلة شائعة الاستخدام
يمكن التمييز بين الأقطاب الكهربائية النشطة والأقطاب الكهربائية الخاملة. على سبيل المثال، عادةً ما يكون قطب المغنيسيوم قطبًا نشطًا لأنه يشارك في تفاعل الأكسدة والاختزال (الأكسدة والاختزال). عادةً ما يكون قطب البلاتين قطبًا خاملًا لأنه لا يشارك في تفاعل الأكسدة والاختزال. القطب الكهربائي الخامل غير متفاعل كيميائيًا وهو موجود فقط بحيث يمكن للتيار أن يتدفق عبر الخلية الكهروكيميائية.
أمثلة القطب في الكيمياء التحليلية
من أمثلة المواد النموذجية المستخدمة للأقطاب الكهربائية في الكيمياء التحليلية الكربون غير المتبلور والذهب والبلاتين. غالبًا ما تستخدم الأقطاب الكهربائية الزجاجية في قياسات الأس الهيدروجيني؛ في هذا التطبيق، يتم تطعيم الزجاج كيميائيًا ليكون انتقائيًا لأيونات الهيدروجين.
أمثلة القطب في البطاريات
تحتوي البطاريات على مجموعة متنوعة من الأقطاب الكهربائية، اعتمادًا على نوع البطارية.
- تعتمد بطاريات الرصاص الحمضية على أقطاب الرصاص.
- تُصنع بطاريات الزنك والكربون باستخدام أقطاب الزنك والكربون غير المتبلور.
- تحتوي بطاريات ليثيوم بوليمر على أقطاب كهربائية مصنوعة من مصفوفة بوليمر صلبة يمكن لأيونات الليثيوم من خلالها التحرك والعمل كحاملات شحن.
![بطاريات الرصاص الحمضية وبطاريات الزنك الكربونية وبطاريات الليثيوم بوليمر]()
بطاريات الرصاص الحمضية وبطاريات الزنك الكربونية وبطاريات الليثيوم بوليمر
أمثلة القطب في التحليل الكهربائي
يمكن استخدام الطاقة الكهربائية لتحويل الأملاح والخامات إلى معادن.
- في عملية هول-هيرولت لاستخلاص معدن الألومنيوم من أكسيد الألومنيوم، يتم تصنيع الأنود والكاثود من الجرافيت.
- يتم إنتاج معدن الصوديوم عن طريق التحليل الكهربائي باستخدام أنود الكربون وكاثود الحديد.
أقطاب خاملة
يُعرف المعدن الذي لا يتدخل أو يشارك في أي تفاعلات كيميائية باسم القطب الكهربائي الخامل. ومع ذلك، لا يزال يستخدم لنقل الكهرباء عن طريق تمرير الإلكترونات من خلال المحلول بدلا من تبادل الأيونات.
تشمل أمثلة الأقطاب الكهربائية الخاملة الجرافيت والبلاتين والذهب والروديوم.
الأقطاب الكهربائية في التحليل الكمي
في تحليل قياس الجهد، يستجيب قطب المؤشر للاختلافات في نشاط الحليلة أو "التركيز الفعال". هذه البساطة تجعل قياس الجهد تقنية اقتصادية مقارنة بالتحليل الطيفي الذري أو اللوني الأيوني. ويمكن تصنيف هذه الإجراءات بناءً على جوانب الخلية التي يتم التحكم فيها.
استخدامات الأقطاب الكهربائية
تُستخدم الأقطاب الكهربائية لتوفير التيار عبر الأجسام غير المعدنية لتغييرها بعدة طرق وقياس التوصيلية الكهربائية لأغراض مختلفة. بعض الأمثلة تشمل:

- أقطاب كهربائية لخلايا الوقود
- أقطاب كهربائية للأغراض الطبية، مثل EEG (لتسجيل نشاط الدماغ)، ECG (تسجيل نبضات القلب)، ECT (تحفيز الدماغ الكهربائي)، مزيل الرجفان (تسجيل وتقديم تحفيز القلب)
- أقطاب كهربائية لتقنيات الفيزيولوجيا الكهربية في البحوث الطبية الحيوية
- أقطاب كهربائية للتنفيذ بواسطة الكرسي الكهربائي
- أقطاب للطلاء الكهربائي
- أقطاب اللحام بالقوس الكهربائي
- أقطاب للحماية الكاثودية
- أقطاب للتأريض
- أقطاب للتحليل الكيميائي باستخدام الطرق الكهروكيميائية
- أقطاب نانوية لإجراء قياسات عالية الدقة في الكيمياء الكهربائية النانوية
- أقطاب خاملة للتحليل الكهربائي (مصنوعة من البلاتين)
- تجميع القطب الغشائي
- أقطاب كهربائية لسلاح الصعق الكهربائي
قطب الهيدروجين القياسي (SHE)
تعريف وأهمية SHE
قطب الهيدروجين القياسي (SHE) هو قطب كهربائي يستخدمه العلماء كمرجع لجميع التفاعلات المحتملة لنصف الخلية. قيمة جهد القطب القياسي هي صفر، مما يجعلها الأساس لحساب جهد الخلية باستخدام أقطاب كهربائية أو تركيزات مختلفة. يعد وجود قطب مرجعي مشترك مثل SHE أمرًا ضروريًا لإجراء قياسات ومقارنات دقيقة في التجارب الكهروكيميائية.
تكوين المواد وعملية التفاعل لـ SHE
يتكون SHE من محلول 1.0 M H + (aq) يحتوي على قطعة مربعة من البلاتين البلاتيني. يتم توصيل البلاتين بسلك بلاتيني، مما يسمح بتبادل الإلكترونات. داخل أنبوب زجاجي، يتم تمرير غاز الهيدروجين من خلال المحلول وإليه، مما يؤدي إلى التفاعل التالي:
2H+(aq) + 2e- ⇌ H2(g)
يحدد هذا التوازن بين أيونات الهيدروجين وغاز الهيدروجين الإمكانات المرجعية لـ SHE.

التحديات في إنشاء واستخدام SHE
قد يؤدي إنشاء واستخدام SHE إلى ظهور بعض التحديات. أحد التحديات هو ضمان استقرار القطب المرجعي مع مرور الوقت ومع تغير درجات الحرارة. يجب أن تكون مكونات SHE مستقرة وتوفر إمكانات قطب كهربائي ثابتة وقابلة للتكرار.
التحدي الآخر يكمن في بناء القطب المرجعي. يتكون SHE من سترة زجاجية ذات مدخل صغير في الأعلى ومنافذ متعددة في الأسفل. داخل الغلاف الزجاجي، يوجد أنبوب زجاجي مغلق من كلا الطرفين، يحتوي على سلك بلاتيني ولوحة بلاتينية في الطرف السفلي. يتم غمر الغلاف الزجاجي والأنبوب في وعاء يحتوي على 1 مولار من محلول حمض الهيدروكلوريك. يعد البناء السليم لهذه المكونات أمرًا ضروريًا لأداء SHE بشكل دقيق.
باختصار، يعتبر قطب الهيدروجين القياسي أداة حيوية في الكيمياء الكهربائية، ويعمل كمرجع لقياس ومقارنة إمكانات القطب. ويتطلب بنائه واستخدامه عناية دقيقة لضمان الثبات والدقة في القياسات التجريبية.
نظام ثلاثة القطب
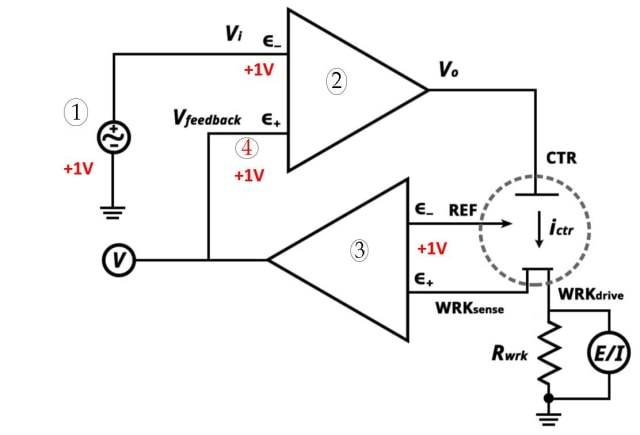
يعد نظام الأقطاب الثلاثة مكونًا أساسيًا في قياس الجهد. وهو يتألف من ثلاثة أقطاب كهربائية: القطب العامل، والقطب المرجعي، والقطب المساعد. يلعب كل قطب كهربائي دورًا محددًا في النظام.
وصف نظام الأقطاب الثلاثة
يستخدم نظام الأقطاب الثلاثة في الكيمياء التحليلية الكهربائية لإجراء تحليل الفولتميتر. يسمح بقياس ومراقبة تدفق التيار في الخلية الكهروكيميائية. يتكون النظام من الأقطاب الكهربائية التالية:
القطب العامل : القطب العامل هو المسؤول عن نقل الإلكترونات من وإلى المواد الموجودة في الخلية. فهو يسهل التفاعلات الكهروكيميائية التي تحدث أثناء قياس الجهد.
القطب المرجعي : يحتوي القطب المرجعي على إمكانات قطب كهربائي ثابتة. يمكن استخدامه كنصف خلية في خلية كهروكيميائية. من خلال مقارنة إمكانات القطب العامل مع القطب المرجعي، يمكن تحديد إمكانات القطب الكهربائي العامل.
القطب المساعد : يضمن القطب المساعد عدم مرور التيار عبر الخلية المرجعية. إنه يوازن التيار مع تيار القطب العامل. يُعرف القطب المساعد أيضًا باسم القطب المضاد.
![نظام ثلاثي الأقطاب (1. نقطة ضبط الجهد 2. مضخم تشغيلي عالي الكسب 3. مقياس كهربائي 4. قريب جدًا)]()
نظام ثلاثي الأقطاب (1. نقطة ضبط الجهد 2. مضخم تشغيلي عالي الكسب 3. مقياس كهربائي 4. قريب جدًا)
أدوار العمل، والمرجع، والأقطاب الكهربائية المساعدة
في نظام الأقطاب الثلاثة، يكون لكل قطب كهربائي دور محدد يؤديه:
يسهل القطب العامل التفاعلات الكهروكيميائية عن طريق نقل الإلكترونات من وإلى المواد الموجودة في الخلية.
يوفر القطب المرجعي إمكانات قطب كهربائي معروفة يمكن من خلالها قياس إمكانات القطب العامل. إنه بمثابة نقطة مرجعية لتحديد إمكانات القطب الكهربائي للقطب العامل.
يضمن القطب المساعد، المعروف أيضًا باسم القطب المضاد، تدفق التيار عبر الخلية الكهروكيميائية دون المرور عبر القطب المرجعي. إنه يوازن التيار مع تيار القطب العامل.
يوفر نظام الأقطاب الثلاثة مزايا متميزة مقارنة بالإعدادات ثنائية القطب. فهو يسمح بعزل القطب الكهربائي العامل، مما يتيح دراسة تفاعلات محددة بدقة وثقة. يستخدم هذا الإعداد بشكل شائع في التجارب الكهروكيميائية.
من ناحية أخرى، يتم استخدام الأجهزة ثنائية القطب في الحالات التي يكون فيها قياس جهد الخلية بأكمله مهمًا، كما هو الحال في أجهزة الطاقة الكهروكيميائية مثل البطاريات وخلايا الوقود والمكثفات الفائقة. ويمكن استخدامه أيضًا عندما يُتوقع أن تظل إمكانات القطب المضاد مستقرة طوال التجربة.
بشكل عام، يعد نظام الأقطاب الثلاثة أداة حاسمة في قياس الجهد، مما يسمح بالقياس الدقيق والتحكم في التفاعلات الكهروكيميائية.
أمثلة على الأقطاب الكهربائية المرجعية
وصف وعملية القطب الكهربائي كالوميل
يتكون قطب الكالوميل من أنبوب زجاجي مزود بذراع جانبي. يوجد في الجزء السفلي من الأنبوب زئبق نقي مع سلك من البلاتين محكم التوصيل للتوصيلات الكهربائية. ويوجد فوق الزئبق عجينة من كلوريد الزئبق (الكالوميل) الموجود في الزئبق. يتم ملء باقي الأنبوب بمحلول KCl المشبع. يتم استخدام السلاح الجانبي لغمسه في أي محلول يستخدم لربط قطب الكالوميل.

العمل: يمكن أن يعمل قطب الكالوميل كقطب سالب، ومن الممكن حدوث تفاعلين اعتمادًا على طبيعة القطب الآخر المقترن به. عند العمل كقطب سلبي، تحدث التفاعلات التالية:
- 2 زئبق(ل) → 2 زئبق+ + 2 ه–
- 2 Hg+ + 2 Cl– → Hg2Cl2(s)
تفاعل الأكسدة الصافي هو تكوين كلوريد الزئبق.
مزايا الكالوميل الكهربائي:
- أسهل نسبيًا في التصنيع والصيانة مقارنةً بقطب الهيدروجين القياسي (SHE)
- يتكون من معجون صلب وزئبق سائل، مما يجعله سهل الاستخدام
- لا يتطلب جسرًا ملحيًا منفصلاً لأنه يحتوي بالفعل على أنبوب جانبي يحتوي على محلول KCl
- لا تتغير الإمكانات بشكل ملحوظ مع مرور الوقت وتغيرات طفيفة في درجات الحرارة
مساوئ الكالوميل الكهربائي:
- يعد التعويض عن الإمكانات ضروريًا عند قياس إمكانات نصف الخلية
- لا يمكن استخدامه في قياس الإمكانات التي تتداخل فيها أيونات K+ وCl–
- تعتمد إمكانات الأكسدة على تركيز KCl، لذا فإن التغيرات في التركيز يمكن أن تؤثر على جهد القطب.
وصف وعملية قطب كلوريد الفضة والفضة
يستخدم قطب كلوريد الفضة والفضة على نطاق واسع كقطب مرجعي نظرًا لقدرته على تحمل التكاليف وانخفاض سميته مقارنةً بقطب كالوميل. يتكون هذا القطب من الفضة الصلبة وملحها المترسب AgCl. يتم تصنيعه عن طريق طلاء سلك من الفضة الصلبة بـ AgCl وغمره في أنبوب يحتوي على محلول KCl وAgCl.

العمل: يسمح قطب كلوريد الفضة والفضة بتكوين الأيونات وتدفق الإلكترونات داخل وخارج نظام القطب. يمكن أن يكون بمثابة قطب كهربائي مرجعي عندما يقترن بقطب كهربائي آخر.
مزايا قطب كلوريد الفضة والفضة:
- غير مكلفة ومتاحة على نطاق واسع
- أقل سمية مقارنة بقطب كالوميل
- من السهل اقامة وإعادة إنتاج
- مريحة وسهلة النقل
- مدمجة وأصغر حجما، وتتطلب مساحة صغيرة
- ليس هناك حاجة إلى جسر ملح منفصل لأنه يحتوي بالفعل على أنبوب جانبي بمحلول KCl
- تظل الإمكانات مستقرة نسبيًا مع مرور الوقت ومع تغيرات طفيفة في درجات الحرارة
تعتبر الأقطاب الكهربائية المرجعية ضرورية في التحليل الكهروكيميائي لأنها توفر إمكانات ثابتة وثابتة للقياسات الحسية. يعتبر قطب كالوميل وإلكترود كلوريد الفضة والفضة مثالين شائعين الاستخدام في الكيمياء الكهربائية المائية. لديهم مزاياها وعيوبها، ومدى ملاءمتها تعتمد على التطبيق والمتطلبات المحددة.
المنتجات ذات الصلة
- خلية كهروكيميائية بالتحليل الكهربائي لتقييم الطلاء
- خلية التحليل الكهربائي من النوع H خلية كهروكيميائية ثلاثية
- قطب صفيحة البلاتين للتطبيقات المختبرية والصناعية
- خلية كهروكيميائية للتآكل المسطح
- قطب ورقة الذهب الكهروكيميائي قطب الذهب
المقالات ذات الصلة
- التقنيات المتقدمة في تقييم الطلاء باستخدام الخلايا الإلكتروليتية
- القلب الزجاجي: لماذا تموت العلوم الجيدة في خلايا قذرة
- مقاييس سماكة الطلاء المحمولة باليد: القياس الدقيق للطلاء بالكهرباء والطلاءات الصناعية
- مفارقة الشفافية: إتقان فن الخلايا الإلكتروليتية الهش
- فهم الخلايا الإلكتروليتية المتآكلة المسطحة: التطبيقات والآليات وتقنيات الوقاية