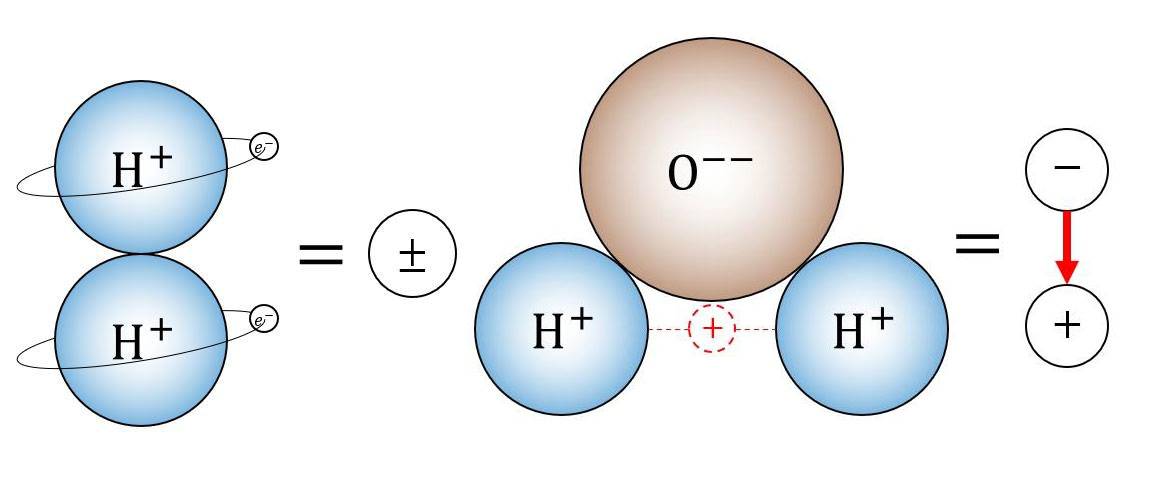
مقدمة عن الخلايا الإلكتروليتية والتآكل
تلعب الخلايا الإلكتروليتية دورًا محوريًا في مختلف العمليات الصناعية، ومع ذلك فهي لا تخلو من التحديات، خاصةً فيما يتعلق بالتآكل. تتعمق هذه المقالة في الأعمال المعقدة للخلايا الإلكتروليتية المسطحة المتآكلة كهربائيًا، وتستكشف مكوناتها الأساسية مثل الإلكتروليت والأنود والكاثود والعمليات التي تؤدي إلى التآكل. يعد فهم هذه الآليات أمرًا بالغ الأهمية لتطوير استراتيجيات فعالة للتخفيف من التآكل، وضمان طول عمر الخلايا الإلكتروليتية وكفاءتها في تطبيقات تتراوح من تنقية المعادن إلى الطلاء الكهربائي. انضم إلينا بينما نكشف عن تعقيدات الخلايا الإلكتروليتية والتدابير الحاسمة اللازمة لحماية هذه الأدوات الصناعية الأساسية.
آليات التآكل في الخلايا الإلكتروليتية
التآكل في الخلايا الإلكتروليتية هي عملية معقدة تنطوي على تفاعل عوامل مختلفة، بما في ذلك تذبذب الإمكانات والتباين بين الأقطاب المعدنية. ويُعد فهم هذه الآليات أمرًا بالغ الأهمية لتطوير استراتيجيات فعالة للتخفيف من التآكل، والذي يمكن أن يؤثر بشكل كبير على كفاءة الخلايا الإلكتروليتية وعمرها الافتراضي.
دور الإمكانات المتقلبة
يمكن أن تنشأ الإمكانات المتذبذبة في الخلايا الإلكتروليتية من عدة مصادر، بما في ذلك التقلبات في الجهد المطبق والتغيرات في تركيبة الإلكتروليت والتقلبات الحرارية. يمكن أن تؤدي هذه التقلبات إلى تآكل موضعي، حيث تتعرض مناطق معينة من القطب الكهربائي لمعدلات أكسدة أو اختزال أعلى من غيرها. ويمكن أن يؤدي هذا التآكل غير المنتظم إلى حدوث تنقر وتآكل شقوق وأشكال أخرى من التلف الموضعي.
على سبيل المثال، في الخلية الإلكتروليتية النموذجية، يخضع القطب الموجب للأكسدة، فيطلق إلكترونات، بينما يخضع القطب السالب للاختزال، فيستقبل الإلكترونات. إذا تذبذب الجهد عند الأنود، يمكن أن يؤدي ذلك إلى معدلات أكسدة غير متساوية، مما يتسبب في تآكل بعض المناطق بسرعة أكبر من غيرها. وبالمثل، يمكن أن تؤثر التقلبات المحتملة عند المهبط على عملية الاختزال، مما يؤدي إلى أنماط تآكل غير منتظمة.
التفاعل بين الأقطاب الكهربائية المعدنية المختلفة
يمكن أن يساهم استخدام أقطاب معدنية غير متشابهة في الخلية الإلكتروليتية أيضًا في التآكل. عندما يتلامس معدنان مختلفان مع بعضهما البعض في محلول إلكتروليت، يمكن أن يشكلا خلية كلفانية، حيث يعمل أحد المعدنين كأنبوب والآخر ككاثود. يتآكل المعدن ذو جهد الأكسدة الأعلى بسرعة أكبر، حيث يعمل كمصعد مضحٍّ.
على سبيل المثال، إذا تم استخدام قطب نحاسي مع قطب من الزنك في إلكتروليت حمضي، سيتآكل الزنك بسرعة أكبر بسبب جهد الأكسدة الأعلى. يمكن أن يتفاقم هذا التآكل الجلفاني بسبب التقلبات في الأس الهيدروجيني للإلكتروليت ودرجة الحرارة والتركيز الأيوني مما يؤدي إلى تسريع تدهور القطب المضحى.
استراتيجيات التخفيف
للتخفيف من التآكل في الخلايا الإلكتروليتية، يمكن استخدام عدة استراتيجيات:
-
الحماية الكاثودية: ينطوي ذلك على استخدام معدن أكثر تفاعلية كأنود مضحٍ لحماية القطب الرئيسي من التآكل. يتآكل القطب المضحّي بدلاً من القطب الأولي، وبالتالي يطيل عمره الافتراضي.
-
المثبطات: يمكن إضافة مثبطات كيميائية إلى الإلكتروليت لتقليل معدل التآكل. وتشكل هذه المثبطات طبقة واقية على سطح القطب، مما يمنع التلامس المباشر مع الأنواع المسببة للتآكل. تشمل المثبطات الشائعة المركبات العضوية التي تحتوي على ذرات النيتروجين أو الكبريت أو الأكسجين.
-
اختيار المواد: اختيار مواد مقاومة للتآكل للأقطاب الكهربائية يمكن أن يقلل بشكل كبير من معدلات التآكل. على سبيل المثال، البلاتين والذهب مقاومان للغاية للتآكل وغالبًا ما يستخدمان في التطبيقات الإلكتروليتية الصعبة.
-
تصميم القطب الكهربائي: يمكن أن يساعد أيضًا تحسين تصميم الأقطاب الكهربائية في تقليل التآكل. على سبيل المثال، يمكن أن يؤدي استخدام الأقطاب الكهربائية ثنائية القطب، التي تعمل كأنود وكاثود في خلايا مختلفة، إلى تقليل فرق الجهد بين الأقطاب الكهربائية وتقليل التآكل الجلفاني.
-
الصيانة والمراقبة: يمكن أن تساعد المراقبة المنتظمة لأداء الخلية الإلكتروليتية في تحديد العلامات المبكرة للتآكل. الصيانة الدورية، مثل تنظيف الأقطاب واستبدال الإلكتروليت، يمكن أن تمنع تراكم المنتجات الثانوية المسببة للتآكل وتضمن الأداء الأمثل.
الخاتمة
يعد التآكل في الخلايا الإلكتروليتية مشكلة متعددة الأوجه تنطوي على التفاعل بين الإمكانات المتقلبة والتفاعل بين الأقطاب المعدنية المختلفة. من خلال فهم هذه الآليات، من الممكن تطوير استراتيجيات فعالة للتخفيف من التآكل، وبالتالي تعزيز كفاءة الخلايا الإلكتروليتية وطول عمرها. ومن خلال الاختيار الدقيق للمواد، وتحسين التصميم، واستخدام التدابير الوقائية مثل المثبطات والحماية الكاثودية، يمكن الحد بشكل كبير من تأثير التآكل على أنظمة التحليل الكهربائي.
التطبيقات الصناعية للخلايا الإلكتروليتية
تلعب الخلايا الإلكتروليتية دوراً حاسماً في مختلف العمليات الصناعية، من تنقية المعادن إلى الإنتاج الكيميائي. وتستخدم هذه الخلايا مبادئ التحليل الكهربائي، حيث يتم تمرير تيار كهربائي عبر سائل أو محلول يحتوي على أيونات لدفع التفاعلات الكيميائية غير التلقائية. يتعمق هذا القسم في التطبيقات الصناعية المحددة للخلايا الإلكتروليتية، مع التركيز على تنقية النحاس والطلاء الكهربائي وإنتاج الصودا الكاوية، مع تسليط الضوء أيضًا على أهمية منع التآكل.
تنقية النحاس
أحد أهم تطبيقات الخلايا الإلكتروليتية هو تنقية النحاس. تتضمن العملية استخدام خلية إلكتروليتية حيث يكون القطب الموجب مصنوعًا من النحاس غير النقي والكاثود عبارة عن صفيحة رقيقة من النحاس النقي. والإلكتروليت عبارة عن محلول من كبريتات النحاس (CuSO4) وحمض الكبريتيك (H2SO4). عندما يتم تطبيق تيار كهربائي، تذوب أيونات النحاس (Cu2+) من الأنود في الإلكتروليت ثم تنتقل إلى الكاثود حيث تترسب على هيئة نحاس نقي. وينتج عن هذه العملية مستويات نقاء نحاس تتجاوز 99.9%.
ويتراوح استهلاك الطاقة لتكرير النحاس عن طريق عمليات التحليل الكهربائي من 150 إلى 300 كيلووات/ساعة لكل طن من النحاس المكرر. وتتميز هذه الطريقة بكفاءة عالية وتضمن بقاء الشوائب مثل الحديد والزنك في الإلكتروليت، بينما تتجمع المعادن الثمينة مثل الذهب والفضة في قاع الخلية على شكل حمأة أنود، والتي يمكن استعادتها.

الطلاء بالكهرباء
الطلاء بالكهرباء هو تطبيق آخر مهم للخلايا الإلكتروليتية، حيث يتم ترسيب طبقة رقيقة من المعدن على سطح معدن آخر لتحسين مظهره أو متانته أو توفير مقاومة للتآكل. وتشمل المعادن الشائعة المستخدمة في الطلاء الكهربائي الكروم والنيكل والذهب. وتتضمن العملية غمر الجسم المراد طلاؤه (القطب السالب) وقضيب من معدن الطلاء (الأنود) في محلول إلكتروليت يحتوي على أيونات المعدن. وعندما يتم تطبيق تيار كهربائي، يتم اختزال أيونات المعدن من الإلكتروليت عند المهبط، مما يؤدي إلى تكوين طلاء موحد.
يستخدم الطلاء الكهربائي على نطاق واسع في صناعات السيارات والفضاء والإلكترونيات. على سبيل المثال، يُستخدم الطلاء بالكروم لإضفاء لمسة نهائية صلبة ولامعة على أجزاء السيارات، في حين أن الطلاء بالذهب ضروري للمكونات الإلكترونية لضمان التوصيل الكهربائي الجيد ومقاومة التآكل.
إنتاج الصودا الكاوية
إنتاج الصودا الكاوية (هيدروكسيد الصوديوم، NaOH) هو تطبيق صناعي مهم آخر للخلايا الإلكتروليتية. الصودا الكاوية مادة كيميائية مهمة في مختلف الصناعات، بما في ذلك صناعة الورق وإنتاج الصابون والمنظفات ومعالجة المياه. وتتضمن العملية التحليل الكهربي لمحلول كلوريد الصوديوم (NaCl)، المعروف باسم المحلول الملحي.
في الخلية الإلكتروليتية، ينتج غاز الكلور (Cl2) عند القطب الموجب وينتج هيدروكسيد الصوديوم عند القطب السالب. يمكن تلخيص التفاعل الكلي على النحو التالي:
[ 2NaCl + 2H2O \right 2NaOH + Cl2 + H2]
وغالباً ما يُستخدم غاز الكلور في إنتاج مواد كيميائية أخرى، مثل البولي فينيل كلوريد متعدد الفينيل (كلوريد البوليفينيل)، بينما تُستخدم الصودا الكاوية في العديد من العمليات الصناعية. وتتسم طريقة الإنتاج هذه بالكفاءة العالية ويتم تنفيذها على نطاق واسع، حيث يتم إنتاج ملايين الأطنان من الصودا الكاوية سنوياً في جميع أنحاء العالم.
منع التآكل
يعد منع التآكل جانبًا حاسمًا في العديد من التطبيقات الصناعية التي تتضمن الخلايا الإلكتروليتية. يحدث التآكل عندما يتفاعل المعدن مع بيئته، مما يؤدي إلى تدهور وفقدان خصائص المواد. يمكن استخدام الخلايا الإلكتروليتية لتطبيق الطلاءات الواقية على المعادن، مثل الزنك أو الكادميوم، والتي توفر حاجزًا ضد العوامل البيئية.
وبالإضافة إلى ذلك، تُستخدم الخلايا الإلكتروليتية في عملية الحماية الكاثودية، حيث يتم توصيل أنود مضحٍ بالهيكل المعدني المراد حمايته. يتآكل الأنود القرباني بدلاً من الهيكل المحمي، وبالتالي يطيل عمره الافتراضي. تُستخدم هذه الطريقة بشكل شائع في حماية خطوط الأنابيب والهياكل البحرية وصهاريج التخزين.
وفي الختام، لا يمكن الاستغناء عن الخلايا الإلكتروليتية في مختلف العمليات الصناعية، من تنقية المعادن والطلاء الكهربائي إلى الإنتاج الكيميائي ومنع التآكل. وتسلط هذه التطبيقات الضوء على تعدد استخدامات الخلايا الإلكتروليتية وأهميتها في الصناعة الحديثة، مما يضمن إنتاج مواد عالية الجودة والتشغيل الفعال للعمليات الصناعية.
التدابير الوقائية ضد التآكل
يعد التآكل في الخلايا الإلكتروليتية مصدر قلق كبير بسبب قدرته على تدهور أداء المعدات وعمرها الافتراضي. وقد تم تطوير تقنيات مختلفة لمنع أو تخفيف التآكل، بما في ذلك استخدام المثبطات والحماية الكاثودية وتشكيل طبقات التخميل. هذه الأساليب ضرورية للحفاظ على سلامة وكفاءة عمليات التحليل الكهربائي، والتي تستخدم على نطاق واسع في صناعات مثل الطلاء الكهربائي وتكرير المعادن ومعالجة المياه.
استخدام المثبطات
المثبطات هي مواد كيميائية يمكنها، عند إضافتها إلى الإلكتروليت، أن تقلل بشكل كبير من معدل تآكل الأقطاب الكهربائية. تعمل هذه المواد من خلال تشكيل طبقة واقية على سطح المعدن، والتي تعمل كحاجز ضد البيئة المسببة للتآكل. تعتمد فعالية المثبطات على عدة عوامل، بما في ذلك تركيزها ونوع المعدن وتكوين الإلكتروليت. على سبيل المثال، يمكن أن تكون بعض المركبات العضوية التي تحتوي على ذرات النيتروجين أو الكبريت أو الأكسجين فعالة للغاية كمثبطات بسبب قدرتها على الامتزاز على سطح المعدن وحجب المواقع النشطة التي يحدث فيها التآكل عادةً.
الحماية الكاثودية
الحماية الكاثودية هي طريقة فعالة أخرى لمنع التآكل في الخلايا الإلكتروليتية. تتضمن هذه التقنية جعل السطح المعدني مهبطاً للخلية الكهروكيميائية، وبالتالي حمايته من الأكسدة. ويوجد نوعان رئيسيان من الحماية الكاثودية: الأنودات المضحية والتيار المتأثر. في أنظمة الأنودات المضحية، يتم توصيل معدن أكثر تفاعلية (مثل الزنك أو المغنيسيوم) بالمعدن المراد حمايته. يتآكل الأنود القرباني بدلاً من المعدن المحمي. أما في أنظمة التيار المتأثر، فيتم استخدام مصدر طاقة خارجي لتزويد الكاثود بتيار مستمر، مما يمنعه من التعرض للأكسدة.
تكوين طبقات التخميل
تكوين طبقات التخميل هي عملية طبيعية حيث تتشكل طبقة رقيقة واقية رقيقة من الأكسيد أو مركبات أخرى على سطح المعدن. تعمل هذه الطبقة كحاجز يمنع المزيد من التآكل عن طريق منع الوصول إلى المعدن الأساسي. يمكن تعزيز عملية التخميل من خلال استخدام معالجات معينة، مثل الطلاء بأكسيد الألومنيوم أو الطلاء بالكروم للصلب. لا تؤدي هذه المعالجات إلى إنشاء طبقة واقية فحسب، بل تعمل أيضًا على تحسين الخواص الميكانيكية للمعدن، مما يجعله أكثر مقاومة للتآكل والتلف.
الطلاء بالكهرباء
الطلاء بالكهرباء هي عملية يتم فيها ترسيب طبقة رقيقة من المعدن على سطح معدن آخر لتوفير الحماية ضد التآكل. تنطوي هذه العملية على غمر الجزء المعدني في محلول يحتوي على المعدن المراد ترسيبه وتطبيق تيار كهربائي. يتم اختزال أيونات المعدن في المحلول عند المهبط (الجزء المعدني)، مما يشكل طبقة واقية. وتشمل المعادن الشائعة المستخدمة في الطلاء الكهربائي الكروم والنيكل والزنك. لا يوفر الطلاء بالكهرباء الحماية من التآكل فحسب، بل يعزز أيضاً مظهر الأجزاء المعدنية ومقاومتها للتآكل.
الخلايا الإلكتروليتية في الصناعة
تستخدم الخلايا الإلكتروليتية على نطاق واسع في العمليات الصناعية المختلفة، بما في ذلك إنتاج المعادن عالية النقاء مثل الألومنيوم والنحاس والزنك والرصاص. وتستخدم هذه الخلايا أيضًا في التكرير الكهربائي والاستخلاص الكهربي للمعادن، حيث يكون نقاء المنتج النهائي أمرًا بالغ الأهمية. وبالإضافة إلى ذلك، تُستخدم الخلايا الإلكتروليتية في عمليات معالجة المياه، مثل تحلل الماء إلى هيدروجين وأكسجين. ومن الضروري منع التآكل في هذه الخلايا لضمان التشغيل المستمر والفعال لهذه العمليات.
الخلاصة
إن منع التآكل في الخلايا الإلكتروليتية أمر بالغ الأهمية لطول عمر المعدات الصناعية وأدائها. تُعد تقنيات مثل استخدام المثبطات والحماية الكاثودية وتشكيل طبقات التخميل استراتيجيات فعالة للتخفيف من التآكل. ولا تقتصر هذه الأساليب على حماية الأقطاب الكهربائية فحسب، بل تضمن أيضًا التشغيل الفعال لعمليات التحليل الكهربائي، والتي تعتبر حيوية لمختلف التطبيقات الصناعية. ومن خلال تنفيذ هذه التدابير الوقائية، يمكن للصناعات تقليل تكاليف الصيانة وإطالة عمر معداتها والحفاظ على معايير إنتاج عالية الجودة.
تصميم الخلايا الإلكتروليتية وموادها
تُعد الخلايا الإلكتروليتية أساسية في مختلف العمليات الصناعية، لا سيما في التكرير الكهربائي والاستخلاص الكهربي للمعادن غير الحديدية مثل الألومنيوم والنحاس والزنك والرصاص. تم تصميم هذه الخلايا لتسهيل تحلل المركبات الكيميائية من خلال تطبيق الطاقة الكهربائية، وهي عملية لا تحدث تلقائيًا في الظروف العادية. وتعتمد كفاءة وفعالية الخلية الإلكتروليتية بشكل كبير على تصميمها والمواد المستخدمة، وخاصة اختيار الأقطاب الخاملة وطبيعة الإلكتروليت.
مكونات الخلايا الإلكتروليتية
تتكون الخلية الإلكتروليتية من ثلاثة مكونات أساسية: الإلكتروليت والكاثود والأنود.
-
الإلكتروليت: هذا عادةً ما يكون محلول من الماء أو مذيبات أخرى تذوب فيه الأيونات. ويمكن أيضاً استخدام الأملاح المنصهرة، مثل كلوريد الصوديوم، كإلكتروليت. إن دور الإلكتروليت حاسم لأنه يحتوي على الأيونات التي تشارك في تفاعلات الأكسدة والاختزال عند تطبيق جهد خارجي. تتحرك الأيونات الموجودة في الإلكتروليت نحو الأقطاب ذات الشحنة المعاكسة، مما يسهل تفاعلات نقل الشحنة.
-
الكاثود والأنود: القطب السالب هو القطب السالب حيث يحدث الاختزال، بينما القطب الموجب هو القطب الموجب حيث تحدث الأكسدة. في الخلايا الإلكتروليتية، يفضل استخدام الأقطاب الخاملة لتجنب أي تفاعلات كيميائية قد تغير الأقطاب نفسها. وتشمل المواد الشائعة لهذه الأقطاب الكهربائية الجرافيت والبلاتين، وهي مواد معروفة بثباتها وتوصيلها.

اعتبارات التصميم
يجب أن يراعي تصميم الخلية الإلكتروليتية عدة عوامل لتحسين أدائها:
-
اختيار مواد القطب الكهربائي: اختيار مادة القطب الكهربائي أمر بالغ الأهمية. وينبغي أن تكون الأنودات عوامل اختزال فعالة ذات ناتج كولومبي عالٍ، وموصلية جيدة، وثبات وسهولة التصنيع وتكلفة منخفضة. وتشمل مواد الأنود الشائعة الزنك والليثيوم. من ناحية أخرى، يجب أن تكون الأنودات الكاثودات عوامل مؤكسدة فعالة ومستقرة عند التلامس مع الإلكتروليت ولها جهد عمل مفيد. وغالباً ما تستخدم الأكاسيد المعدنية لهذا الغرض.
-
تركيبة الإلكتروليت: يجب اختيار الإلكتروليت بعناية للتأكد من أنه يدعم التفاعلات الكيميائية المرغوبة دون التسبب في آثار جانبية غير مرغوب فيها مثل تآكل أو تدهور الأقطاب الكهربائية. كما أن توصيل الإلكتروليت هو أيضا عامل رئيسي، لأنه يؤثر بشكل مباشر على كفاءة الخلية.
-
هندسة الخلية: يمكن أن يؤثر الترتيب المادي للأقطاب الكهربائية والإلكتروليت بشكل كبير على تدفق الأيونات وتوزيع التيار داخل الخلية. يمكن أن يساعد تحسين هندسة الخلية في تقليل فقد الطاقة وتحسين الكفاءة الكلية لعملية التحليل الكهربائي.
التطبيقات والتأثير
إن تصميم ومواد الخلايا الإلكتروليتية لها تأثير عميق على تطبيقاتها في الصناعة. على سبيل المثال، يعتمد إنتاج المعادن عالية النقاء مثل الألومنيوم والنحاس بشكل كبير على كفاءة هذه الخلايا. وبالإضافة إلى ذلك، تُستخدم الخلايا الإلكتروليتية في عمليات مثل تنقية المياه وتوليد غاز الهيدروجين، مما يدل على تنوعها وأهميتها في التكنولوجيا الحديثة.
في الختام، يعد تصميم الخلايا الإلكتروليتية والمواد المستخدمة فيها أمرًا بالغ الأهمية لوظيفتها وكفاءتها. ومن خلال اختيار أقطاب كهربائية خاملة بعناية وتحسين هندسة الإلكتروليت وهندسة الخلية، من الممكن تحسين أداء هذه الخلايا، مما يجعلها أكثر فعالية في مجموعة واسعة من التطبيقات الصناعية.
الخلايا الإلكتروليتية مقابل الخلايا الجلفانية
تُعد الخلايا الإلكتروليتية والجلفانية مكونات أساسية في مجال الكيمياء الكهربائية، وتخدم كل منها أغراضًا مختلفة وتعمل وفقًا لمبادئ مختلفة. فهم الاختلافات وتطبيقات هذه الخلايا أمر بالغ الأهمية لمختلف العمليات العلمية والصناعية.

الاختلافات التشغيلية
الخلايا الإلكتروليتية: تُستخدم الخلايا الإلكتروليتية لدفع التفاعلات الكيميائية غير التلقائية من خلال تطبيق الطاقة الكهربائية. وهي تتكون من قطبين كهربائيين (أنود وكاثود) مغمورين في محلول إلكتروليت. في هذه الخلايا، يدفع مصدر الطاقة الخارجي الإلكترونات إلى المهبط، مما يجعله سالبًا، ويسحب الإلكترونات من الأنود، مما يجعله موجبًا. يعكس هذا الإعداد التدفق الطبيعي للإلكترونات، مما يتيح حدوث تفاعلات غير تلقائية.
الخلايا الجلفانية: في المقابل، تولد الخلايا الجلفانية الطاقة الكهربائية من التفاعلات الكيميائية التلقائية. وهي تتكون أيضًا من قطبين كهربائيين مغمورين في إلكتروليت، ولكن على عكس الخلايا الكهرلية، فهي لا تتطلب مصدر طاقة خارجي. يكون الأنود، حيث تحدث الأكسدة، سالب الشحنة، والكاثود، حيث يحدث الاختزال، موجب الشحنة. يولد تدفق الإلكترونات من الأنود إلى المهبط عبر دائرة خارجية تيارًا كهربائيًا.
التطبيقات
الخلايا الإلكتروليتية: تُستخدم الخلايا الإلكتروليتية على نطاق واسع في العمليات الصناعية مثل التحليل الكهربي للماء لإنتاج الهيدروجين والأكسجين وطلاء المعادن بالكهرباء وتكرير النحاس. كما أنها ضرورية في إنتاج المواد الكيميائية مثل الصودا الكاوية والكلور. إن القدرة على دفع التفاعلات غير التلقائية تجعلها لا غنى عنها في مختلف عمليات التخليق والتنقية الكيميائية.
الخلايا الجلفانية: الخلايا الجلفانية هي أساس البطاريات، حيث يتم تسخير الطاقة من تفاعلات الأكسدة والاختزال التلقائية لتوفير الطاقة الكهربائية. وتشمل الأمثلة الشائعة الخلايا الأولية مثل البطاريات القلوية وبطاريات الزنك والكربون، والخلايا الثانوية مثل بطاريات الرصاص الحمضية وبطاريات الليثيوم أيون. هذه الخلايا حيوية في تشغيل الأجهزة الإلكترونية المحمولة والمركبات وأنظمة الطاقة الاحتياطية.
التأثير على معدلات التآكل واستراتيجيات الوقاية
تؤثر الاختلافات التشغيلية بين الخلايا الإلكتروليتية والجلفانية بشكل كبير على معدلات التآكل واستراتيجيات الوقاية. في التآكل الجلفاني، يشكل معدنان غير متشابهين متلامسين مع بعضهما البعض ومع محلول كهربائي خلية جلفانية، مما يؤدي إلى تسريع تآكل المعدن الأقل نبلاً. تُستغل هذه الظاهرة في أنظمة الأنود المضحّي المستخدمة لحماية المنشآت مثل السفن وخطوط الأنابيب من التآكل.
من ناحية أخرى، يمكن استخدام الخلايا الإلكتروليتية في طرق الحماية الكاثودية، حيث يتم توصيل هيكل معدني بمعدن أكثر تفاعلية (أنود مضحٍ) ومغمور في إلكتروليت. يتآكل المعدن الأكثر تفاعلية بدلاً من الهيكل المحمي، مما يمنع التآكل بشكل فعال.

الخلاصة
باختصار، بينما تنطوي كل من الخلايا الإلكتروليتية والجلفانية على تفاعلات الأكسدة والاختزال، وتحتوي على أقطاب كهربائية حيث تحدث الأكسدة والاختزال، إلا أنها تعمل بطرق متعاكسة. تستخدم الخلايا الإلكتروليتية طاقة كهربائية خارجية لدفع التفاعلات غير التلقائية، بينما تولد الخلايا الجلفانية طاقة كهربائية من التفاعلات التلقائية. ويُعد فهم هذه الاختلافات أمرًا ضروريًا للتطبيق الفعال في مختلف السياقات العلمية والصناعية والهندسية، لا سيما في إدارة التآكل والوقاية منه.
الاتجاهات والابتكارات المستقبلية في تكنولوجيا الخلايا الإلكتروليتية
يستعد مجال تكنولوجيا الخلايا الإلكتروليتية لتحقيق تطورات كبيرة، مدفوعة بالحاجة إلى أنظمة أكثر متانة وكفاءة، لا سيما في سياق تطوير البطاريات وعمليات تكرير المعادن. تهدف هذه الابتكارات إلى معالجة التحديات الحرجة مثل التآكل وكفاءة الطاقة وقابلية التوسع في عمليات التحليل الكهربائي.
تعزيز المتانة من خلال علم المواد
لا يزال التآكل يمثل مشكلة كبيرة في الخلايا الإلكتروليتية، لا سيما في البيئات ذات الإمكانات المتقلبة والمعادن غير المتشابهة. يستكشف الباحثون طرقًا مختلفة للتخفيف من التآكل، بما في ذلك استخدام مثبطات وتطوير مواد جديدة أكثر مقاومة للتآكل بطبيعتها. التثبيط الكاثودي، على سبيل المثال، هو تقنية تشكل طبقة واقية على القطب السالب، مما يقلل من معدل التآكل. هذه الطريقة لا تبطئ التفاعل الكاثودي فحسب، بل ترسب أيضًا في هذه المناطق، وبالتالي تحمي القطب من المزيد من التلف.
الابتكارات في تصميم الخلايا الإلكتروليتية
يخضع تصميم الخلايا الإلكتروليتية أيضًا لتغييرات كبيرة. تعتمد التصميمات التقليدية على دائرة كاملة مع أقطاب كهربائية مستقرة ومحلول إلكتروليت سائل. ومع ذلك، تستكشف التصاميم الناشئة استخدام الشوارد الصلبة التي يمكن أن تعمل تحت درجات حرارة قصوى، مما يوفر الاستقرار والأداء المحسن. يمكن لهذه الإلكتروليتات الصلبة أن تمكّن البطاريات ذات الكثافة العالية للطاقة من الحصول على عمر أطول بكثير، مما يجعلها مناسبة لمجموعة واسعة من التطبيقات من السيارات الكهربائية إلى تخزين الشبكة.
كفاءة الطاقة والاستدامة
تحسين كفاءة الطاقة للخلايا الإلكتروليتية هو مجال آخر من مجالات التركيز الحاسمة. وينطوي ذلك على تحسين العمليات الكهربائية والكيميائية داخل الخلية لتقليل فقد الطاقة وتحسين الأداء العام. يبحث الباحثون أيضًا في مواد وعمليات أكثر استدامة، مما يقلل من التأثير البيئي للخلايا الإلكتروليتية. على سبيل المثال، يكتسب تطوير الإلكتروليتات الحيوية وإعادة تدوير المواد المستخدمة في الخلايا الإلكتروليتية زخماً كبدائل مستدامة.
الخاتمة
مستقبل تكنولوجيا الخلايا الإلكتروليتيةتكنولوجيا الخلايا الإلكتروليتية مشرق، مع العديد من الابتكارات التي تلوح في الأفق والتي تعد بتعزيز المتانة والكفاءة والاستدامة. تمهد التطورات في تطوير الإلكتروليت، وعلوم المواد، وتصميم الخلايا، وكفاءة الطاقة الطريق لخلايا إلكتروليتية أكثر قوة وتنوعًا. ولا تعالج هذه التطورات التحديات التقنية فحسب، بل تساهم أيضًا في تحقيق أهداف بيئية أوسع نطاقًا من خلال تعزيز حلول طاقة أنظف وأكثر استدامة. ومع استمرار تطور الأبحاث، سيظهر تأثير هذه الابتكارات في مختلف الصناعات، من تخزين الطاقة إلى تكرير المعادن، مما يدفع عجلة التقدم نحو مستقبل أكثر استدامة.
المنتجات ذات الصلة
- خلية كهروكيميائية للتآكل المسطح
- خلية كهروكيميائية بالتحليل الكهربائي لتقييم الطلاء
- خلية التحليل الكهربائي الطيفي بالطبقة الرقيقة
- خلية تحليل كهربائي مزدوجة الطبقة بحمام مائي
- حمام مائي متعدد الوظائف للخلية الكهروكيميائية بطبقة واحدة أو مزدوجة
















