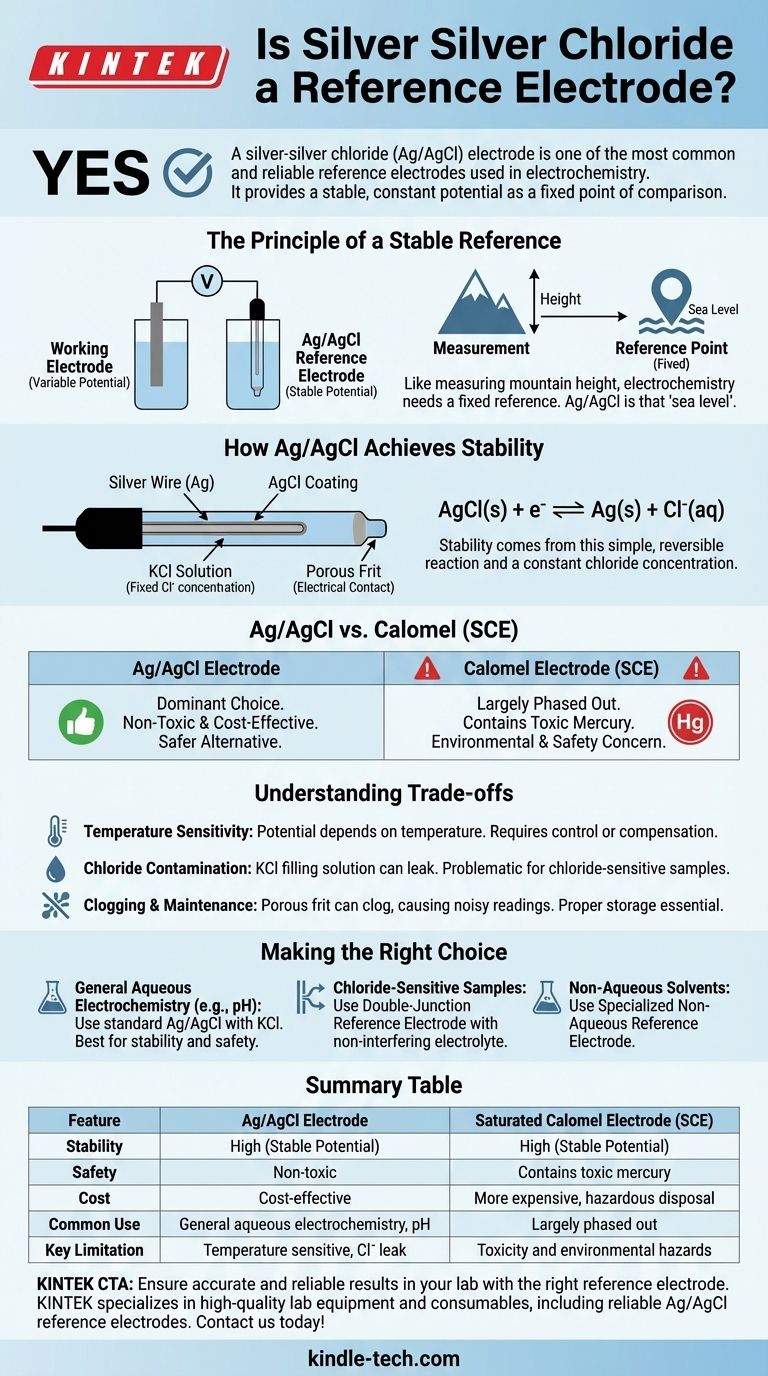
نعم، قطب الفضة/كلوريد الفضة (Ag/AgCl) هو أحد أقطاب المرجع الأكثر شيوعًا وموثوقية المستخدمة في الكيمياء الكهربائية. إنه يوفر جهدًا ثابتًا ومستقرًا يعمل كنقطة مقارنة ثابتة، مما يسمح لك بقياس جهد قطب آخر (القطب العامل) بدقة داخل خلية كهروكيميائية. هذا الاستقرار يجعله لا غنى عنه في التطبيقات التي تتراوح من قياس الأس الهيدروجيني إلى الفولتامترية الدورية.
الوظيفة الأساسية للقطب المرجعي هي توفير خط أساس جهد لا يتغير. يحقق قطب Ag/AgCl هذا من خلال توازن كيميائي محدد ومستقر، مما يجعله معيارًا موثوقًا وفعالًا من حيث التكلفة في الكيمياء الكهربائية الحديثة.

مبدأ المرجع المستقر
لفهم سبب فعالية قطب Ag/AgCl، يجب أن نفهم أولاً ما الذي يجعل المرجع جيدًا. القياس الكهروكيميائي هو دائمًا مقارنة للجهد بين نقطتين.
ما هو القطب المرجعي؟
القطب المرجعي هو نصف خلية ذات جهد قطب معروف ومستقر. وظيفته هي أن يظل ثابتًا، بغض النظر عن التغييرات التي تحدث في النصف الآخر من الخلية (القطب العامل ومحلول العينة).
فكر في الأمر مثل قياس ارتفاع جبل. أنت بحاجة إلى نقطة مرجعية ثابتة، مثل مستوى سطح البحر، للحصول على قياس ذي مغزى. في الكيمياء الكهربائية، القطب المرجعي هو مستوى سطح البحر.
كيف يحقق Ag/AgCl الاستقرار
يأتي استقرار قطب Ag/AgCl من تفاعل كيميائي بسيط وقابل للعكس. يتكون من سلك فضي مغطى بطبقة رقيقة من كلوريد الفضة (AgCl)، وكلها مغمورة في محلول بتركيز ثابت من أيونات الكلوريد (Cl⁻)، وعادة ما يكون كلوريد البوتاسيوم (KCl).
يتم تحديد الجهد من خلال التوازن بين معدن الفضة الصلب وملحه:
AgCl(s) + e⁻ ⇌ Ag(s) + Cl⁻(aq)
نظرًا لأن تركيز محلول الكلوريد داخل القطب يظل ثابتًا، يظل جهد هذا التفاعل النصفي مستقرًا بشكل استثنائي.
Ag/AgCl مقابل أقطاب المرجع الأخرى
قطب Ag/AgCl ليس الخيار الوحيد، لكن مزاياه جعلته خيارًا سائدًا على المعايير الأقدم مثل قطب الكالوميل المشبع (SCE).
صعود Ag/AgCl
السبب الرئيسي للتبني الواسع لـ Ag/AgCl هو سلامته وأداؤه. إنه غير مكلف نسبيًا في الإنتاج، والأهم من ذلك، أنه غير سام.
تراجع قطب الكالوميل (SCE)
كان قطب الكالوميل، الذي يستخدم معجونًا من الزئبق/كلوريد الزئبقوز، معيارًا شائعًا في السابق. ومع ذلك، تم التخلص منه إلى حد كبير في العديد من المختبرات.
السبب الرئيسي هو السمية. الزئبق مادة خطرة، مما يجعل استخدام وتخزين والتخلص من أقطاب الكالوميل مصدر قلق كبير للبيئة والسلامة.
فهم المفاضلات
في حين أن قطب Ag/AgCl هو خيار ممتاز للأغراض العامة، إلا أنه ليس خاليًا من القيود. يعد فهم هذه المفاضلات أمرًا بالغ الأهمية للحصول على قياسات دقيقة.
الحساسية لدرجة الحرارة
يعتمد جهد قطب Ag/AgCl على درجة الحرارة. بالنسبة للأعمال عالية الدقة، يجب التحكم في درجة حرارة الخلية والإبلاغ عنها، أو يجب استخدام مسبار يعوض درجة الحرارة.
تلوث الكلوريد
يتم ملء القطب بمحلول KCl مركز. يمكن أن يتسرب قدر صغير من هذا المحلول من الفريت المسامي عند طرف القطب إلى عينتك. إذا كانت تجربتك حساسة لأيونات الكلوريد، فقد يكون هذا مصدرًا للخطأ.
انسداد القطب والصيانة
يمكن أن يصبح الفريت المسامي الذي يسمح بالاتصال الكهربائي مع العينة مسدودًا، مما يؤدي إلى قراءات جهد صاخبة أو متغيرة. التخزين السليم (مع غمر الطرف في محلول التعبئة الخاص به) والصيانة المنتظمة ضروريان لعمر طويل ونتائج دقيقة.
اتخاذ القرار الصحيح لتطبيقك
يعد اختيار القطب المرجعي ومحلول التعبئة الصحيح أمرًا بالغ الأهمية لنجاح التجربة. يعتمد اختيارك بالكامل على كيمياء عينتك.
- إذا كنت تجري كيمياء كهربية مائية عامة (مثل معظم قياسات الأس الهيدروجيني أو الأيونات): فإن قطب Ag/AgCl مع محلول تعبئة KCl قياسي هو دائمًا الخيار الأفضل تقريبًا بسبب استقراره وسلامته.
- إذا كانت عينتك تتفاعل مع أيونات الكلوريد أو كانت حساسة لها: يجب عليك استخدام قطب مرجعي "مزدوج الوصلة"، حيث تعزل حجرة خارجية بإلكتروليت غير متداخل (مثل نترات البوتاسيوم) عنصر Ag/AgCl الداخلي عن عينتك.
- إذا كنت تعمل في مذيبات غير مائية: ستحتاج إلى قطب مرجعي متخصص غير مائي، حيث أن الأقطاب المائية القياسية لن تعمل بشكل صحيح وستلوث المذيب الخاص بك.
في نهاية المطاف، يتعلق اختيار القطب المرجعي الصحيح بضمان بقائه مراقبًا خاملًا ومستقرًا للتفاعل الكيميائي الذي ترغب في دراسته.
جدول الملخص:
| الميزة | قطب Ag/AgCl | قطب الكالوميل المشبع (SCE) |
|---|---|---|
| الاستقرار | عالية (جهد مستقر) | عالية (جهد مستقر) |
| السلامة | غير سام | يحتوي على زئبق سام |
| التكلفة | فعال من حيث التكلفة | أكثر تكلفة، والتخلص منه خطير |
| الاستخدام الشائع | الكيمياء الكهربائية المائية العامة، قياس الأس الهيدروجيني | تم التخلص منه إلى حد كبير بسبب مخاوف السلامة |
| القيود الرئيسية | حساسية لدرجة الحرارة، احتمال تلوث الكلوريد | السمية والمخاطر البيئية |
تأكد من الحصول على نتائج دقيقة وموثوقة في مختبرك باستخدام القطب المرجعي الصحيح. تتخصص KINTEK في معدات المختبرات والمواد الاستهلاكية عالية الجودة، بما في ذلك أقطاب Ag/AgCl المرجعية الموثوقة والمصممة خصيصًا لتطبيقاتك الكهروكيميائية. يمكن لخبرائنا مساعدتك في اختيار القطب المثالي للحفاظ على الاستقرار وتجنب التلوث في تجاربك. اتصل بنا اليوم لتعزيز دقة وسلامة مختبرك!
دليل مرئي
المنتجات ذات الصلة
- قطب مرجعي كالوميل كلوريد الفضة كبريتات الزئبق للاستخدام المخبري
- قطب القرص المعدني الكهربائي
- قطب القرص الذهبي
- قطب قرص البلاتين الدوار للتطبيقات الكهروكيميائية
- قطب جرافيت قرصي وقضيبي ولوح جرافيت كهروكيميائي
يسأل الناس أيضًا
- أي قطب يستخدم كقطب مرجعي؟ دليل للقياسات الكهروكيميائية الدقيقة
- لماذا وكيف يجب معايرة أقطاب الخلية الإلكتروليتية؟ ضمان نتائج موثوقة
- ما هو نوع القطب الكهربائي الذي يمكن استخدامه كنقطة مرجعية؟ اختر الخيار الصحيح لإجراء قياسات دقيقة
- ما هي خصائص قطب الكالوميل المشبع للمحاليل المتعادلة؟ فهم استقراره وقيوده.
- ما هو القطب المرجعي للزئبق وكلوريد الزئبق؟ اكتشف قطب الكالوميل المشبع (SCE)

















