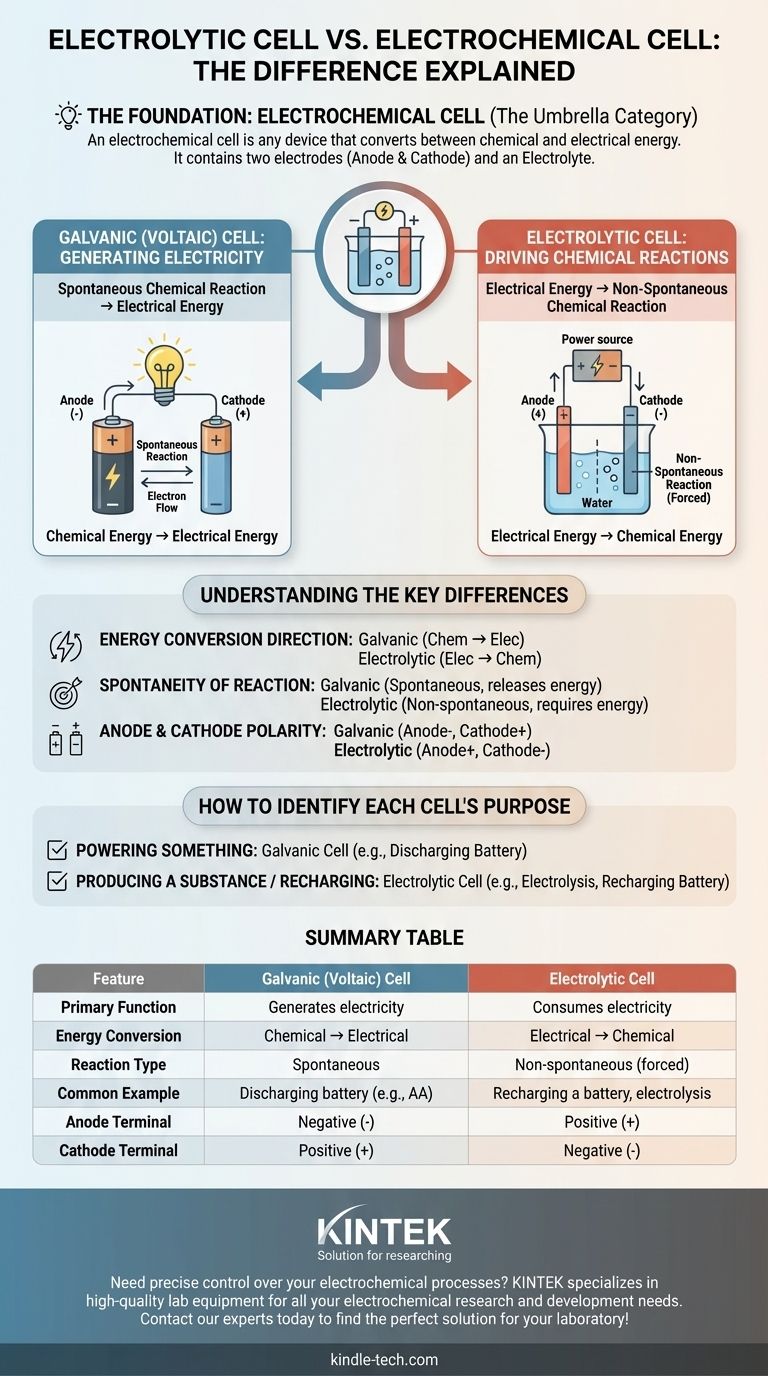
المصدر الأساسي للالتباس هو أن الخلية التحليلية ليست مفهومًا منفصلاً عن الخلية الكهروكيميائية - بل هي واحدة من نوعين رئيسيين من الخلايا الكهروكيميائية. الخلية الكهروكيميائية هي الفئة العامة لأي جهاز يحول بين الطاقة الكيميائية والكهربائية. يكمن التمييز الحقيقي بين الخلايا الغلفانية (الفولتية)، التي تولد الكهرباء من التفاعلات الكيميائية، والخلايا التحليلية، التي تستخدم الكهرباء لإحداث تفاعلات كيميائية.
مصطلح الخلية الكهروكيميائية هو الفئة الشاملة. النوعان المحددان تحت هذه الفئة هما الخلايا الغلفانية (التي تنتج الكهرباء) والخلايا التحليلية (التي تستهلك الكهرباء). يكمن اختلافهما الجوهري في اتجاه تحويل الطاقة.

الأساس: ما هي الخلية الكهروكيميائية؟
المكونات الأساسية
الخلية الكهروكيميائية هي أي جهاز يحتوي على قطبين كهربائيين (مصعد ومهبط) وإلكتروليت. تعمل هذه المكونات معًا لتسهيل نقل الإلكترونات، إما بإنشاء تيار كهربائي أو استهلاكه.
الغرض الشامل
الغرض الوحيد للخلية الكهروكيميائية هو أن تكون بمثابة جسر بين الطاقة الكيميائية والطاقة الكهربائية. يحدد اتجاه تحويل الطاقة هذا النوع المحدد من الخلايا.
نوعا التحويل الأساسيان
الخلايا الغلفانية (الفولتية): توليد الكهرباء
تستغل الخلية الغلفانية، والمعروفة أيضًا باسم الخلية الفولتية، تفاعلًا كيميائيًا تلقائيًا لإنتاج طاقة كهربائية.
فكر في بطارية AA عادية. تتفاعل المواد الكيميائية بداخلها بشكل طبيعي، مطلقة الطاقة في شكل تيار كهربائي يمكنه تشغيل جهاز. هذه هي الخلية الغلفانية قيد العمل.
الخلايا التحليلية: دفع التفاعلات الكيميائية
الخلية التحليلية تفعل العكس تمامًا. إنها تستخدم مصدرًا خارجيًا للطاقة الكهربائية (مثل مصدر طاقة) لإجبار تفاعل كيميائي غير تلقائي على الحدوث.
أحد الأمثلة الشائعة هو التحليل الكهربائي، مثل فصل الماء إلى هيدروجين وأكسجين. هذا التفاعل لا يحدث من تلقاء نفسه؛ فهو يتطلب إدخالًا مستمرًا للكهرباء، وهي وظيفة الخلية التحليلية. إعادة شحن البطارية مثال آخر على هذه العملية.
فهم الفروق الرئيسية
اتجاه تحويل الطاقة
هذا هو التمييز الأكثر أهمية. تحول الخلية الغلفانية الطاقة الكيميائية المخزنة إلى طاقة كهربائية. تحول الخلية التحليلية الطاقة الكهربائية الموردة إلى طاقة كيميائية.
تلقائية التفاعل
التفاعل الكيميائي في الخلية الغلفانية تلقائي - يتقدم بشكل طبيعي ويطلق الطاقة.
التفاعل في الخلية التحليلية غير تلقائي - يتطلب إدخالًا مستمرًا للطاقة الخارجية للمتابعة.
قطبية المصعد والمهبط
هذه نقطة شائعة للالتباس ولكنها تتبع منطقيًا من تدفق الطاقة.
في الخلية الغلفانية (بطارية فارغة)، المصعد هو مصدر الإلكترونات، مما يجعله الطرف السالب، بينما المهبط هو الطرف الموجب.
في الخلية التحليلية (بطارية قيد الشحن)، يعكس مصدر الطاقة الخارجي التدفق. المصعد هو المكان الذي لا يزال يحدث فيه الأكسدة ولكنه يُجبر على أن يكون الطرف الموجب، والمهبط هو الطرف السالب.
كيفية تحديد غرض كل خلية
استخدم الوظيفة الأساسية للخلية كدليل لك للتفريق بسهولة بين النوعين.
- إذا كان الهدف الأساسي هو تشغيل شيء ما: فأنت تستخدم خلية غلفانية (فولتية)، حيث ينتج تفاعل كيميائي تلقائي كهرباء.
- إذا كان الهدف الأساسي هو إنتاج مادة أو إعادة شحن بطارية: فأنت تستخدم خلية تحليلية، حيث يتم استهلاك الكهرباء لإجبار تفاعل كيميائي.
في نهاية المطاف، كلاهما ببساطة وجهان لعملة كهروكيميائية واحدة، يتم تعريفهما بناءً على ما إذا كانا يولدون طاقة كهربائية أو يستهلكونها.
جدول الملخص:
| الميزة | الخلية الغلفانية (الفولتية) | الخلية التحليلية |
|---|---|---|
| الوظيفة الأساسية | توليد الكهرباء | استهلاك الكهرباء |
| تحويل الطاقة | كيميائية ← كهربائية | كهربائية ← كيميائية |
| نوع التفاعل | تلقائي | غير تلقائي (مُجبر) |
| مثال شائع | بطارية فارغة (مثل AA) | إعادة شحن بطارية، تحليل كهربائي |
| طرف المصعد | سالب (-) | موجب (+) |
| طرف المهبط | موجب (+) | سالب (-) |
هل تحتاج إلى تحكم دقيق في عملياتك الكهروكيميائية؟ تتخصص KINTEK في معدات المختبرات عالية الجودة لجميع احتياجاتك في البحث والتطوير الكهروكيميائي. سواء كنت تطور تقنيات بطاريات جديدة أو تقوم بتصنيع مواد عن طريق التحليل الكهربائي، فإن أجهزتنا الموثوقة تضمن نتائج دقيقة وقابلة للتكرار. تواصل مع خبرائنا اليوم للعثور على الحل المثالي لمختبرك!
دليل مرئي
المنتجات ذات الصلة
- خلية التحليل الكهربائي البصري مزدوجة الطبقة من النوع H مع حمام مائي
- خلية كهروكيميائية بالتحليل الكهربائي لتقييم الطلاء
- خلية كهروكيميائية كهروكيميائية كوارتز للتجارب الكهروكيميائية
- خلية التحليل الكهربائي من النوع H خلية كهروكيميائية ثلاثية
- خلية التحليل الكهربائي من PTFE خلية كهروكيميائية مقاومة للتآكل مختومة وغير مختومة
يسأل الناس أيضًا
- ما هي نصائح التعامل العامة مع خلية التحليل الكهربائي الزجاجية؟ ضمان نتائج كيميائية كهربائية دقيقة
- كيف يؤثر تصميم الخلية الكهروكيميائية على تقييم الأداء التحفيزي الكهروكيميائي؟ العوامل الرئيسية
- كيف يضمن نظام خلية التحليل الكهربائي ثلاثية الأقطاب الدقة؟ تحسين اختبار التآكل للمركبات الألومينا
- ما الفرق بين الخلية الإلكتروليتية والخلية الإلكتروليتية؟ شرح الخلايا الغلفانية مقابل الخلايا الإلكتروليتية
- ما هو الهيكل العام لخلية التحليل الكهربائي بحوض مائي بصري مزدوج الطبقة من النوع H؟ تصميم دقيق للتجارب الخاضعة للرقابة
- كيف تحل الخلايا الكهروضوئية وأنظمة الطاقة بالتيار المستمر تحديات الكشف في مراقبة النشاط الإشعاعي البيئي؟
- كيف يجب تعديل المعلمات التجريبية أثناء التشغيل؟ دليل للتحكم الدقيق من أجل نتائج موثوقة
- ما هي مواصفات الفتحات القياسية لخلية التحليل الكهربائي من النوع H ثلاثية الحجرات؟ دليل لتخطيطات ومنافذ الوظائف



















