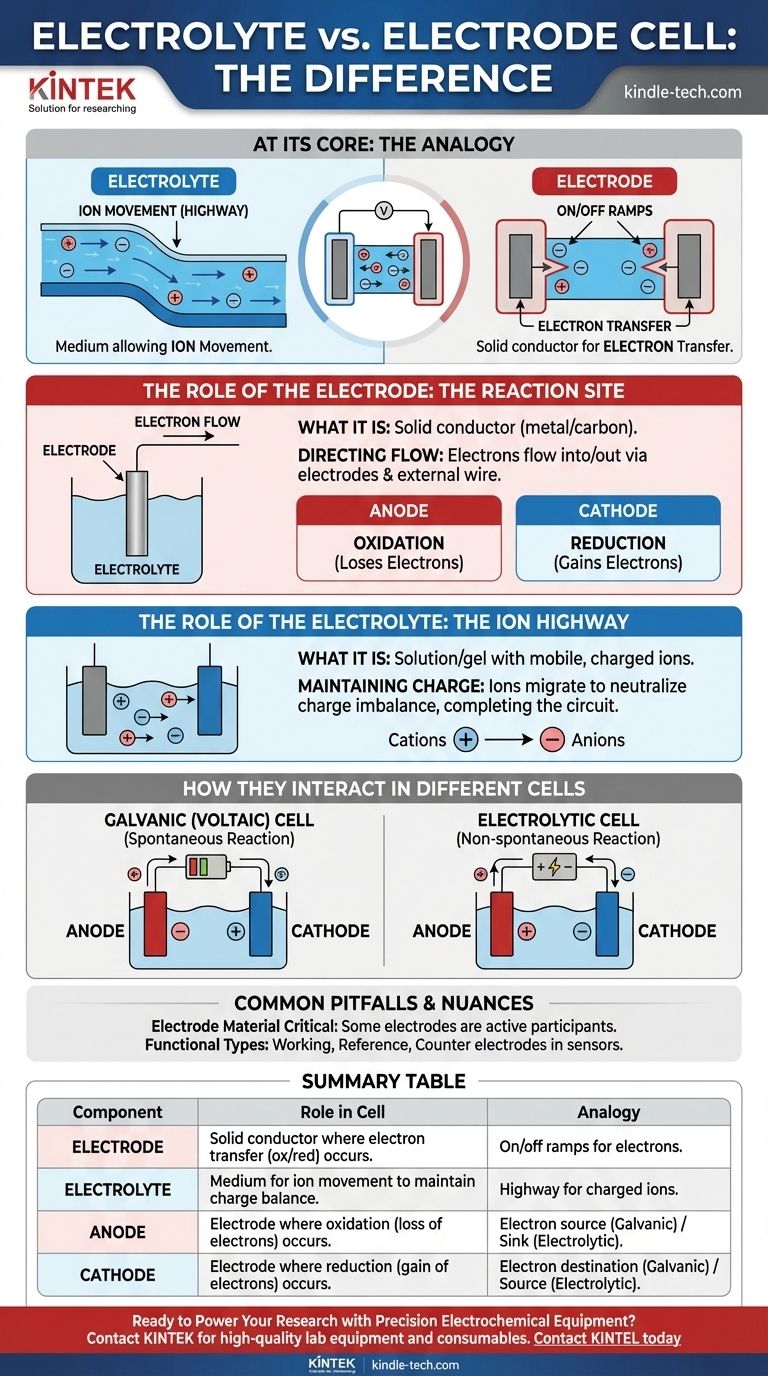
في جوهرها، الإلكتروليت هو الوسط الذي يسمح للأيونات بالتحرك، بينما القطب الكهربائي هو الموصل المادي حيث يحدث التفاعل الكيميائي ونقل الإلكترونات فعليًا. الإلكتروليت هو "الطريق السريع" للأيونات المشحونة داخل الخلية، والأقطاب الكهربائية هي "المداخل والمخارج" التي تربط هذا الطريق السريع بالدائرة الكهربائية الخارجية.
في أي خلية كهروكيميائية، الأقطاب الكهربائية هي الموصلات الصلبة حيث تحدث التفاعلات الكيميائية، إما بإطلاق أو استهلاك الإلكترونات. الإلكتروليت هو الوسط السائل أو الهلامي الضروري الذي ينقل الأيونات بين هذه الأقطاب، ليكمل الدائرة الكهربائية.

دور القطب الكهربائي: موقع التفاعل
يعمل القطب الكهربائي كواجهة مادية بين المكونات الكيميائية داخل الخلية والدائرة الإلكترونية الخارجية.
ما هو القطب الكهربائي
القطب الكهربائي هو موصل كهربائي صلب، عادة ما يكون معدنًا أو كربونًا، يوضع في الإلكتروليت. وظيفته هي نقل الإلكترونات من أو إلى الأنواع الموجودة في المحلول.
توجيه تدفق الإلكترونات
لا يمكن للإلكترونات أن تنتقل عبر الإلكتروليت. بدلاً من ذلك، تتدفق إلى الخلية أو خارجها عبر الأقطاب الكهربائية والسلك الخارجي المتصل.
الأنود مقابل الكاثود
تحتوي جميع الخلايا على نوعين من الأقطاب الكهربائية يتم تحديدهما بواسطة التفاعل الذي يحدث على سطحها:
- الأنود هو حيث تحدث الأكسدة (تفقد المادة الإلكترونات).
- الكاثود هو حيث يحدث الاختزال (تكتسب المادة الإلكترونات).
دور الإلكتروليت: الطريق السريع للأيونات
الإلكتروليت لا يقل أهمية عن الأقطاب الكهربائية. فبدونه، تكون الدائرة غير مكتملة، ولا يمكن أن يتدفق أي تيار.
ما هو الإلكتروليت
الإلكتروليت هو مادة، عادة ما تكون محلولاً يحتوي على أملاح أو أحماض أو قواعد، تنتج محلولاً موصلاً للكهرباء عند إذابته. ويحتوي على أيونات متحركة مشحونة.
الحفاظ على حيادية الشحنة
عندما يتم إطلاق الإلكترونات عند الأنود واستهلاكها عند الكاثود، سيتراكم اختلال في الشحنة بسرعة ويوقف التفاعل. يمنع الإلكتروليت ذلك عن طريق السماح لأيوناته بالهجرة بين الأقطاب، مما يعادل الشحنة ويسمح للعملية بالاستمرار.
كيف تتفاعل في الخلايا المختلفة
تعتمد الشحنة المحددة للأنود والكاثود على ما إذا كانت الخلية تولد أو تستهلك الكهرباء.
في الخلايا الغلفانية (الفولتية)
هذه الخلايا، مثل البطاريات الشائعة، تحول الطاقة الكيميائية إلى طاقة كهربائية من خلال تفاعل تلقائي.
- الأنود سالب، لأنه مصدر الإلكترونات للدائرة الخارجية.
- الكاثود موجب، لأنه المكان الذي تعود فيه الإلكترونات إلى الخلية.
في الخلايا الإلكتروليتية
تستخدم هذه الخلايا طاقة كهربائية خارجية لدفع تفاعل غير تلقائي، كما هو الحال في الطلاء الكهربائي أو تحليل الماء.
- الأنود موجب، لأنه متصل بالطرف الموجب لمصدر الطاقة الخارجي لسحب الإلكترونات بعيدًا.
- الكاثود سالب، لأنه متصل بالطرف السالب لدفع الإلكترونات عليه.
المزالق والفروق الدقيقة الشائعة
فهم التعريفات الأساسية هو الخطوة الأولى. إدراك الفروق الدقيقة هو ما يؤدي إلى الفهم الحقيقي.
مادة القطب الكهربائي حاسمة
القطب الكهربائي ليس دائمًا مجرد موصل خامل. في العديد من البطاريات، تكون مادة القطب الكهربائي نفسها مشاركًا نشطًا في التفاعل الكيميائي، مثل غلاف الزنك لبطارية قلوية يعمل كأنود.
أنواع الأقطاب الوظيفية
في الكيمياء التحليلية وتطبيقات أجهزة الاستشعار، تُعطى الأقطاب أسماء أكثر تحديدًا بناءً على وظيفتها.
- القطب العامل هو حيث يحدث التفاعل الكيميائي محل الاهتمام.
- القطب المرجعي يوفر جهدًا ثابتًا ومستقرًا للقياس مقابله.
- القطب المقابل يكمل الدائرة، ويمرر التيار إلى القطب العامل.
التمييز الصحيح لهدفك
لتطبيق هذه المعرفة، ركز على الدور الأساسي الذي يلعبه كل مكون ضمن سياقك المحدد.
- إذا كان تركيزك الأساسي هو علم البطاريات الأساسي: اعتبر القطب الكهربائي موقع اكتساب/فقدان الإلكترونات (الأنود/الكاثود) والإلكتروليت هو محرك الأيونات الأساسي الذي يحافظ على تشغيل البطارية.
- إذا كان تركيزك الأساسي هو إجراء التحليل الكهربائي: تذكر أن قطبية (+/-) الأقطاب معكوسة عن البطارية، لكن أدوارها الكيميائية الأساسية (الأنود=أكسدة، الكاثود=اختزال) تظل كما هي تمامًا.
- إذا كان تركيزك الأساسي هو بناء أجهزة استشعار كهروكيميائية: يجب عليك التمييز بين القطب العامل (حيث يحدث الحدث)، والقطب المرجعي (للقياس المستقر)، والقطب المقابل (لإكمال الدائرة).
في النهاية، القطب الكهربائي والإلكتروليت هما مكونان متميزان ولكنهما لا ينفصلان ويشكلان أساس جميع التقنيات الكهروكيميائية.
جدول الملخص:
| المكون | الدور في الخلية الكهروكيميائية | التشبيه |
|---|---|---|
| القطب الكهربائي | موصل صلب حيث يحدث نقل الإلكترونات (الأكسدة/الاختزال). | مداخل/مخارج للإلكترونات إلى الدائرة الخارجية. |
| الإلكتروليت | وسط (سائل/هلامي) يسمح بحركة الأيونات للحفاظ على توازن الشحنة. | طريق سريع للأيونات المشحونة داخل الخلية. |
| الأنود | القطب الذي تحدث فيه الأكسدة (فقدان الإلكترونات). | مصدر الإلكترونات (غلفاني) أو مصرف الإلكترونات (إلكتروليتي). |
| الكاثود | القطب الذي يحدث فيه الاختزال (اكتساب الإلكترونات). | وجهة الإلكترونات (غلفاني) أو مصدر الإلكترونات (إلكتروليتي). |
هل أنت مستعد لتزويد بحثك بمعدات كهروكيميائية دقيقة؟
فهم الأساسيات هو الخطوة الأولى. وتطبيقها بالأدوات الصحيحة هو ما يدفع الاكتشاف. سواء كنت تقوم بتطوير مواد بطاريات جديدة، أو إجراء تحليل كهربائي دقيق، أو بناء أجهزة استشعار حساسة، فإن KINTEK توفر معدات المختبرات والمواد الاستهلاكية عالية الجودة التي تحتاجها.
نحن متخصصون في تلبية الاحتياجات الدقيقة للمختبرات. دعنا نساعدك في اختيار الخلايا الكهروكيميائية والأقطاب الكهربائية والإلكتروليتات المثالية لضمان نتائج دقيقة وموثوقة لتطبيقك المحدد.
اتصل بـ KINTEL اليوم لمناقشة متطلبات مشروعك واكتشاف كيف يمكن لحلولنا أن تعزز قدرات مختبرك!
دليل مرئي
المنتجات ذات الصلة
- خلية كهروكيميائية بالتحليل الكهربائي لتقييم الطلاء
- خلية التحليل الكهربائي البصري مزدوجة الطبقة من النوع H مع حمام مائي
- خلية كهروكيميائية تحليل كهربائي بخمسة منافذ
- خلية كهروكيميائية كهروكيميائية كوارتز للتجارب الكهروكيميائية
- خلايا اختبار قابلة للتخصيص من نوع Swagelok لأبحاث البطاريات المتقدمة والتحليل الكهروكيميائي
يسأل الناس أيضًا
- ما هي الطريقة الصحيحة للتعامل مع خلية تحليل كهربائي بحوض مائي خماسي المنافذ؟ ضمان تجارب كيميائية كهربائية دقيقة وآمنة
- ما هي المواد المستخدمة في جسم وغطاء الخلية الإلكتروليتية متعددة الوظائف؟ شرح زجاج البورسليكات العالي وPTFE
- ما هي مزايا استخدام خلية التحليل الكهربائي بثلاثة أقطاب؟ تحقيق الدقة في تحليل الفولاذ المقاوم للصدأ
- ما هي الاحتياطات العامة للتخزين والمناولة لخلية التحليل الكهربائي؟ ضمان الأداء والدقة على المدى الطويل
- ما هي أهمية استخدام خلايا التحليل الكهربائي عالية النقاء ومقاومة للتآكل؟ ضمان طلاءات PEO عالية الجودة
- ما هي احتياطات التعقيم والتسخين لخلية إلكتروليتية ذات حوض مائي مزدوج الطبقات؟ ضمان التشغيل الآمن والنتائج الدقيقة
- ما هو دور خلية التحليل الكهربائي الزجاجية المزودة بسخان ومنظم حرارة في أبحاث تآكل نترات البلوتونيوم؟
- ما هي الوظيفة الأساسية للخلية الكهروضوئية في مرحلة الطلاء المسبق للتصلب بالبورون متعدد المكونات القائم على النيكل؟



















