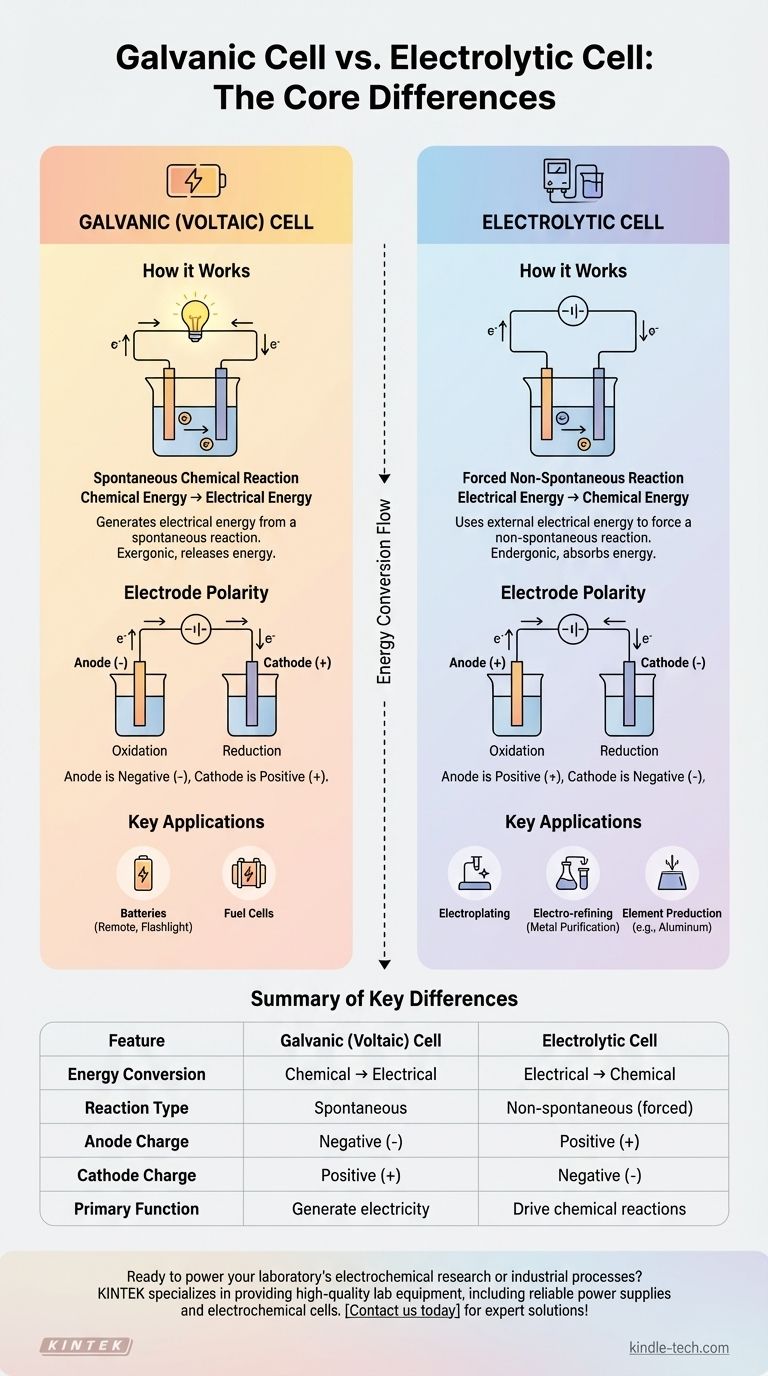
بينما يذكر سؤالك خليتين إلكتروليتيتين، فإن التمييز الأساسي في الكيمياء الكهربائية هو بين الخلية الإلكتروليتية والخلية الغلفانية (المعروفة أيضًا بالخلية الفولتية). تولد الخلية الغلفانية طاقة كهربائية من تفاعل كيميائي تلقائي، مثل البطارية الشائعة. في المقابل، تستخدم الخلية الإلكتروليتية مصدرًا خارجيًا للطاقة الكهربائية لإجبار تفاعل كيميائي غير تلقائي على الحدوث.
يكمن الاختلاف الجوهري في تحويل الطاقة. تحول الخلية الغلفانية الطاقة الكيميائية المخزنة إلى طاقة كهربائية، بينما تفعل الخلية الإلكتروليتية العكس تمامًا، حيث تحول الطاقة الكهربائية إلى طاقة كيميائية لإنتاج مواد مرغوبة.

كيف تعمل الخلايا الغلفانية (الفولتية)
الخلية الغلفانية هي نظام مستقل ينتج الكهرباء. فكر في أي بطارية قياسية تستخدمها في جهاز التحكم عن بعد أو المصباح اليدوي.
التفاعلات الكيميائية التلقائية
محرك الخلية الغلفانية هو تفاعل أكسدة-اختزال (ريدوكس) تلقائي. وهذا يعني أن التفاعل الكيميائي يحدث بشكل طبيعي دون أي مدخلات طاقة خارجية، ويطلق الطاقة في هذه العملية.
تحويل الطاقة: من كيميائية إلى كهربائية
تدفع الطاقة المنبعثة من التفاعل التلقائي الإلكترونات عبر دائرة خارجية، مما يؤدي إلى إنشاء تيار كهربائي. إنها تحول الطاقة الكيميائية الكامنة المخزنة بشكل فعال إلى طاقة كهربائية قابلة للاستخدام.
قطبية الأقطاب الكهربائية
في الخلية الغلفانية، المصعد هو القطب السالب حيث تحدث الأكسدة، والمهبط هو القطب الموجب حيث يحدث الاختزال. تتدفق الإلكترونات من المصعد السالب إلى المهبط الموجب.
كيف تعمل الخلايا الإلكتروليتية
تُستخدم الخلية الإلكتروليتية لدفع التغيرات الكيميائية التي لن تحدث من تلقاء نفسها. تُعرف هذه العملية باسم التحليل الكهربائي.
إجبار التفاعلات غير التلقائية
تم تصميم هذه الخلايا لإجبار تفاعل غير تلقائي على الحدوث. على سبيل المثال، لا يتحلل الماء تلقائيًا إلى هيدروجين وأكسجين؛ بل يتطلب طاقة لفك ارتباطه.
دور مصدر الطاقة الخارجي
لدفع هذا التفاعل، يجب توصيل الخلية الإلكتروليتية بـ مصدر طاقة خارجي، مثل بطارية أو مصدر طاقة تيار مستمر. يوفر هذا المصدر الطاقة اللازمة للتغلب على المقاومة الطبيعية للتفاعل.
وظيفة الإلكتروليت
تحتوي الخلية على إلكتروليت، وهو عادةً ملح منصهر أو محلول ملحي. تحتوي هذه المادة على أيونات متحركة تنجذب إلى الأقطاب الكهربائية، مما يسمح بحدوث التفاعلات الكيميائية وإكمال الدائرة الكهربائية.
التطبيقات الصناعية
هذه العملية حاسمة للعديد من التطبيقات الصناعية، بما في ذلك الطلاء الكهربائي (تغطية جسم بطبقة رقيقة من المعدن)، والتنقية الكهربائية لتنقية المعادن مثل النحاس، وإنتاج عناصر نقية مثل الألومنيوم من خام البوكسيت.
فهم الاختلافات الأساسية
تكشف مقارنة هاتين الخليتين جنبًا إلى جنب عن طبيعتهما المتعاكسة. إنهما وجهان لعملة كيميائية كهربائية واحدة.
تدفق الطاقة والتلقائية
تعتبر الخلية الغلفانية طاردة للطاقة، مما يعني أنها تطلق الطاقة من تفاعل تلقائي. بينما تعتبر الخلية الإلكتروليتية ماصة للطاقة، مما يعني أنها تمتص الطاقة لدفع تفاعل غير تلقائي.
عكس قطبية الأقطاب الكهربائية
هذه نقطة تمييز حاسمة. بينما تحدث الأكسدة دائمًا عند المصعد والاختزال عند المهبط، فإن شحناتهما معكوسة.
- في الخلية الغلفانية: المصعد سالب (-)، المهبط موجب (+).
- في الخلية الإلكتروليتية: المصعد موجب (+)، المهبط سالب (-).
يحدث هذا الانعكاس لأن مصدر الطاقة الخارجي في الخلية الإلكتروليتية يملي تدفق الإلكترونات، متجاوزًا الميل الطبيعي للنظام الكيميائي.
اتخاذ القرار الصحيح لهدفك
يعتمد فهم أي خلية يجب استخدامها كليًا على ما إذا كان هدفك هو توليد الطاقة أو إنشاء منتج كيميائي.
- إذا كان تركيزك الأساسي هو توليد الطاقة من عملية كيميائية: فأنت تصف خلية غلفانية (فولتية)، وهو المبدأ الكامن وراء جميع البطاريات.
- إذا كان تركيزك الأساسي هو استخدام الطاقة لإنشاء مادة: فأنت بحاجة إلى خلية إلكتروليتية، وهي الأساس للطلاء الكهربائي الصناعي، والتنقية، وإنتاج العناصر.
- إذا كان تركيزك الأساسي هو فهم الكيمياء الكهربائية الأساسية: تذكر أن الخلايا الغلفانية تطلق الطاقة تلقائيًا، بينما تتطلب الخلايا الإلكتروليتية طاقة لإجبار التفاعل.
في النهاية، يعد اتجاه تحويل الطاقة هو العامل الأكثر أهمية الذي يحدد ويفصل هاتين الخليتين الكهروكيميائيتين الأساسيتين.
جدول ملخص:
| الميزة | الخلية الغلفانية (الفولتية) | الخلية الإلكتروليتية |
|---|---|---|
| تحويل الطاقة | كيميائية ← كهربائية | كهربائية ← كيميائية |
| نوع التفاعل | تلقائي | غير تلقائي (مجبر) |
| شحنة المصعد | سالب (-) | موجب (+) |
| شحنة المهبط | موجب (+) | سالب (-) |
| الوظيفة الأساسية | توليد الكهرباء (مثل البطاريات) | دفع التفاعلات الكيميائية (مثل الطلاء الكهربائي، التنقية) |
هل أنت مستعد لتشغيل أبحاث الكيمياء الكهربائية في مختبرك أو عملياتك الصناعية؟ تتخصص KINTEK في توفير معدات ومواد استهلاكية عالية الجودة للمختبرات، بما في ذلك مصادر الطاقة الموثوقة والخلايا الكهروكيميائية المصممة خصيصًا لاحتياجاتك. سواء كنت تقوم بتطوير تقنيات بطاريات جديدة أو تحسين أنظمة الطلاء الكهربائي، فإن خبرتنا تضمن حصولك على الأدوات المناسبة للنجاح. اتصل بنا اليوم لمناقشة كيف يمكننا دعم مشاريعك بمعدات دقيقة وحلول متخصصة!
دليل مرئي
المنتجات ذات الصلة
- خلية كهروكيميائية تحليل كهربائي بخمسة منافذ
- خلية كهروكيميائية بالتحليل الكهربائي لتقييم الطلاء
- خلية التحليل الكهربائي البصري مزدوجة الطبقة من النوع H مع حمام مائي
- خلية التحليل الكهربائي من النوع H خلية كهروكيميائية ثلاثية
- خلية تحليل كهربائي مزدوجة الطبقة بخمسة منافذ وحمام مائي
يسأل الناس أيضًا
- ما هي المكونات القياسية لخلية التحليل الكهربائي ذات الحمام المائي بخمسة منافذ؟ أتقن الأداة الدقيقة للتحليل الكهروكيميائي
- كيف يمكن تجنب التلوث أثناء التجارب باستخدام خلية التحليل الكهربائي ذات الحمام المائي بخمسة منافذ؟ أتقن بروتوكول الأعمدة الثلاثة
- ما هي الطريقة الصحيحة للتعامل مع خلية تحليل كهربائي بحوض مائي خماسي المنافذ؟ ضمان تجارب كيميائية كهربائية دقيقة وآمنة
- ما هي إجراءات التخزين الصحيحة للخلية الإلكتروليتية متعددة الوظائف؟ احمِ استثمارك واضمن دقة البيانات
- من أي مادة صُنِعَ خزان التحليل الكهربائي ذو الخمسة منافذ؟ شرح للزجاج البورسليكاتي العالي و PTFE



















