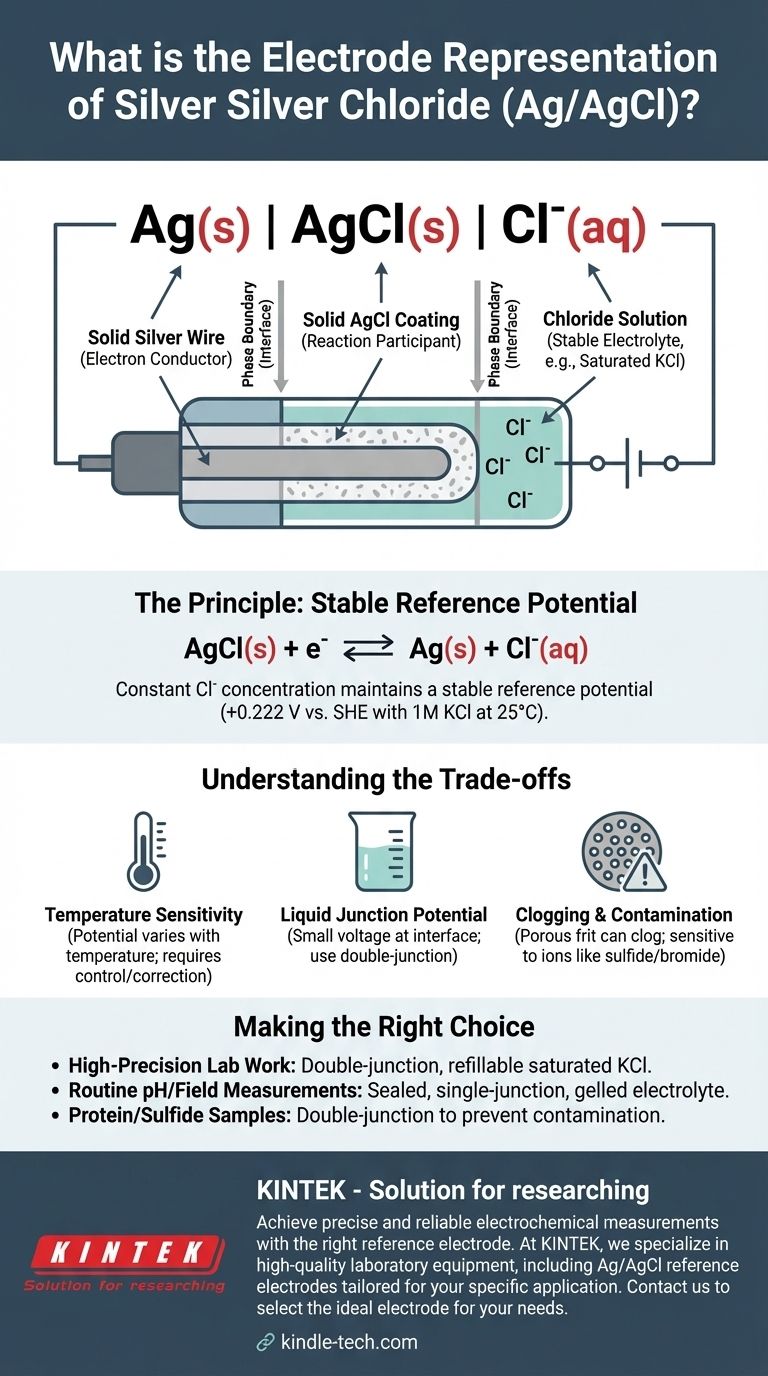
التمثيل المختصر القياسي لقطب الفضة/كلوريد الفضة هو Ag(s) | AgCl(s) | Cl⁻(aq). يصف هذا التدوين الكهروكيميائي الأطوار الفيزيائية والكيميائية للقطب، بدءًا من سلك الفضة المعدني الصلب وصولًا إلى المحلول المائي الذي يحتوي على أيونات الكلوريد. يعتمد الجهد المحدد للقطب بشكل حاسم على تركيز أيونات الكلوريد هذه.
هذا التدوين هو أكثر من مجرد تسمية تقنية؛ إنه مخطط لأحد أكثر الأقطاب المرجعية موثوقية وشيوعًا في الكيمياء الكهربائية. يصف نظامًا مصممًا للحفاظ على جهد ثابت ومستقر، مما يوفر خط أساس ثابت يمكن من خلاله قياس جهود الأقطاب الأخرى بدقة.

تفكيك تدوين القطب
يمثل التدوين Ag(s) | AgCl(s) | Cl⁻(aq) بنية القطب من الداخل إلى الخارج. لكل مكون ورمز معنى دقيق.
الطور الصلب: Ag(s)
يمثل هذا سلك فضة صلب. يعمل هذا السلك كموصل للإلكترونات، حيث يربط القطب بدائرة القياس الخارجية (فولتميتر أو مقياس جهد).
الحد الفاصل بين الطورين: |
يشير الخط العمودي المفرد | إلى حد فاصل بين طورين. يشير إلى الواجهة التي تلتقي فيها حالتان فيزيائيتان مختلفتان، وفي هذه الحالة، معدن الفضة الصلب وطبقة كلوريد الفضة الصلبة.
طبقة الملح غير القابل للذوبان: AgCl(s)
يشير هذا إلى طبقة من كلوريد الفضة الصلب، قليل الذوبان، والمغطاة مباشرة على سطح سلك الفضة. هذه الطبقة هي قلب وظيفة القطب، حيث تشارك مباشرة في التفاعل الكهروكيميائي.
الحد الفاصل بين الطورين الثاني: |
يمثل خط عمودي ثانٍ الحد الفاصل بين طلاء كلوريد الفضة الصلب ومحلول الإلكتروليت المائي المحيط به.
محلول الإلكتروليت: Cl⁻(aq)
يمثل هذا المحلول المائي الذي يُغمر فيه السلك المطلي. يجب أن يحتوي هذا المحلول على تركيز معروف وثابت لأيونات الكلوريد (Cl⁻). عادةً، يتم استخدام محلول كلوريد البوتاسيوم (KCl)، غالبًا بتركيز معين مثل 1 مولار أو، الأكثر شيوعًا، محلول مشبع.
مبدأ القطب المرجعي
يُقدَّر قطب الفضة/كلوريد الفضة ليس لتفاعله الخاص، بل لاستقراره. إنه يوفر جهدًا ثابتًا يعمل كنقطة صفر موثوقة للقياسات الأخرى.
التفاعل الحاكم
يتم إنشاء الجهد المستقر عن طريق توازن عكوس بين المكونات الصلبة وأيونات الكلوريد في المحلول. تفاعل النصف هو:
AgCl(s) + e⁻ ⇌ Ag(s) + Cl⁻(aq)
طالما ظل تركيز (أو بشكل أكثر دقة، نشاط) أيونات الكلوريد في المحلول ثابتًا، فلن يتغير جهد نصف الخلية هذا.
أهمية تركيز الكلوريد الثابت
يضمن استخدام محلول KCl مشبع أن يكون تركيز Cl⁻ ثابتًا وقابلاً للاستنساخ. إذا تبخر بعض الماء، يذوب المزيد من ملح KCl للحفاظ على التشبع. هذا هو السبب في أن الجهد المرجعي مستقر للغاية. بالنسبة لمحلول KCl بتركيز 1 مولار عند 25 درجة مئوية (298 كلفن)، يكون هذا الجهد +0.222 فولت بالنسبة لقطب الهيدروجين القياسي (SHE).
فهم المفاضلات
على الرغم من موثوقيته العالية، فإن قطب الفضة/كلوريد الفضة ليس خاليًا من القيود التي تتطلب دراسة لإجراء عمل دقيق.
الحساسية لدرجة الحرارة
جهد القطب هو دالة لدرجة الحرارة. للحصول على قياسات دقيقة للغاية، يجب التحكم في درجة حرارة الخلية أو يجب تصحيح الجهود المقاسة لتغيرات درجة الحرارة.
جهد الوصلة السائلة
عندما يتلامس محلول KCl الخاص بالقطب مع محلول عينة مختلف، يمكن أن يتطور جهد صغير يُعرف باسم جهد الوصلة السائلة عند الواجهة. يضيف هذا خطأ صغيرًا ولكنه منهجي إلى القياس، والذي يمكن تقليله باستخدام قطب مزدوج الوصلة.
الانسداد والتلوث
يمكن أن تنسد المسام السيراميكية (frit) التي تسمح بالاتصال الكهربائي بين المحلول الداخلي والعينة. ويمكن أيضًا أن تتلوث بأيونات من العينة (مثل الكبريتيد أو البروميد أو اليوديد) التي يمكن أن تتفاعل مع الفضة، مما يتسبب في انحراف جهد القطب بمرور الوقت.
اتخاذ القرار الصحيح لقياسك
تطبيقك يحدد أي تكوين للقطب هو الأفضل.
- إذا كان تركيزك الأساسي هو العمل المخبري عالي الدقة: استخدم قطب فضة/كلوريد فضة مزدوج الوصلة مع محلول KCl مشبع قابل لإعادة التعبئة لتقليل جهد الوصلة والسماح بسهولة الصيانة.
- إذا كان تركيزك الأساسي هو قياسات الأس الهيدروجيني الروتينية أو القياسات الميدانية: يكون القطب أحادي الوصلة والمختوم بالإلكتروليت الهلامي متينًا وقليل الصيانة ومناسبًا تمامًا.
- إذا كان تركيزك الأساسي هو تحليل العينات التي تحتوي على بروتينات أو كبريتيدات: يجب عليك استخدام قطب مزدوج الوصلة لمنع انسداد وتلوث الوصلة المرجعية الأساسية.
إن فهم هذا التدوين يحوله من تسمية مشفرة إلى مخطط وظيفي للقياس الكهروكيميائي الموثوق.
جدول الملخص:
| المكون | الرمز | الوصف |
|---|---|---|
| سلك الفضة الصلب | Ag(s) | موصل يتصل بالدائرة الخارجية. |
| طلاء كلوريد الفضة | AgCl(s) | طبقة ملح غير قابلة للذوبان تتيح التفاعل العكوس. |
| محلول أيون الكلوريد | Cl⁻(aq) | إلكتروليت مائي (مثل KCl) بتركيز ثابت لأيونات Cl⁻. |
| الحد الفاصل بين الطورين |
حقق قياسات كهروكيميائية دقيقة وموثوقة باستخدام القطب المرجعي الصحيح.
في KINTEK، نحن متخصصون في المعدات المخبرية عالية الجودة، بما في ذلك مجموعة من أقطاب الفضة/كلوريد الفضة المرجعية المصممة خصيصًا لتطبيقك - سواء كنت تتطلب نماذج مزدوجة الوصلة عالية الدقة للأعمال المخبرية الحساسة أو خيارات متينة ومنخفضة الصيانة للتحليل الروتيني.
يمكن لخبرائنا مساعدتك في اختيار القطب المثالي لضمان جهد ثابت، وتقليل الأخطاء، وتعزيز دقة أبحاثك.
اتصل بـ KINTEK اليوم لمناقشة احتياجاتك المخبرية واكتشاف كيف يمكن للمواد الاستهلاكية والمعدات الموثوقة لدينا دعم عملك.
دليل مرئي
المنتجات ذات الصلة
- قطب مرجعي كالوميل كلوريد الفضة كبريتات الزئبق للاستخدام المخبري
- قطب القرص المعدني الكهربائي
- قطب قرص البلاتين الدوار للتطبيقات الكهروكيميائية
- قطب القرص الذهبي
- قطب دوار بقرص وحلقة (RRDE) / متوافق مع PINE، و ALS اليابانية، و Metrohm السويسرية من الكربون الزجاجي والبلاتين
يسأل الناس أيضًا
- ما هي مجالات تطبيق قطب ثاني أكسيد الرصاص-التيتانيوم لتطور الأكسجين؟ دليل للأكسدة المتقدمة
- ما هي وظائف قطب الكاثود المرجعي Ag/AgCl وسلك البلاتين في دراسات أكسدة أغشية (U1−xThx)O2؟
- ماذا يفعل القطب المساعد؟ ضمان قياسات كهروكيميائية دقيقة
- كيف يجب صيانة وتنظيف القطب الكهربائي المصنوع من التيتانيوم بانتظام؟ احمِ استثمارك وحقق أقصى قدر من الأداء
- لماذا يتم اختيار الفولاذ المقاوم للصدأ المحتوي على الموليبدينوم ككاثود لمياه الصرف الصحي لوجبات السمك؟ تصميم متين ومستقر
- ما هي المواصفات المتوفرة لألواح الذهب والبلاتين؟ ألواح عالية النقاء للتطبيقات التي تتطلب دقة عالية
- ما هي الأهمية التقنية للألواح القطبية المتوازية في التخثير الكهربائي؟ تحسين كفاءة المفاعل
- لماذا تعد صيانة الأقطاب الكهربائية والعناية بها مهمة، وماذا تتضمن؟ ضمان سلامة البيانات وزيادة عائد الاستثمار



















