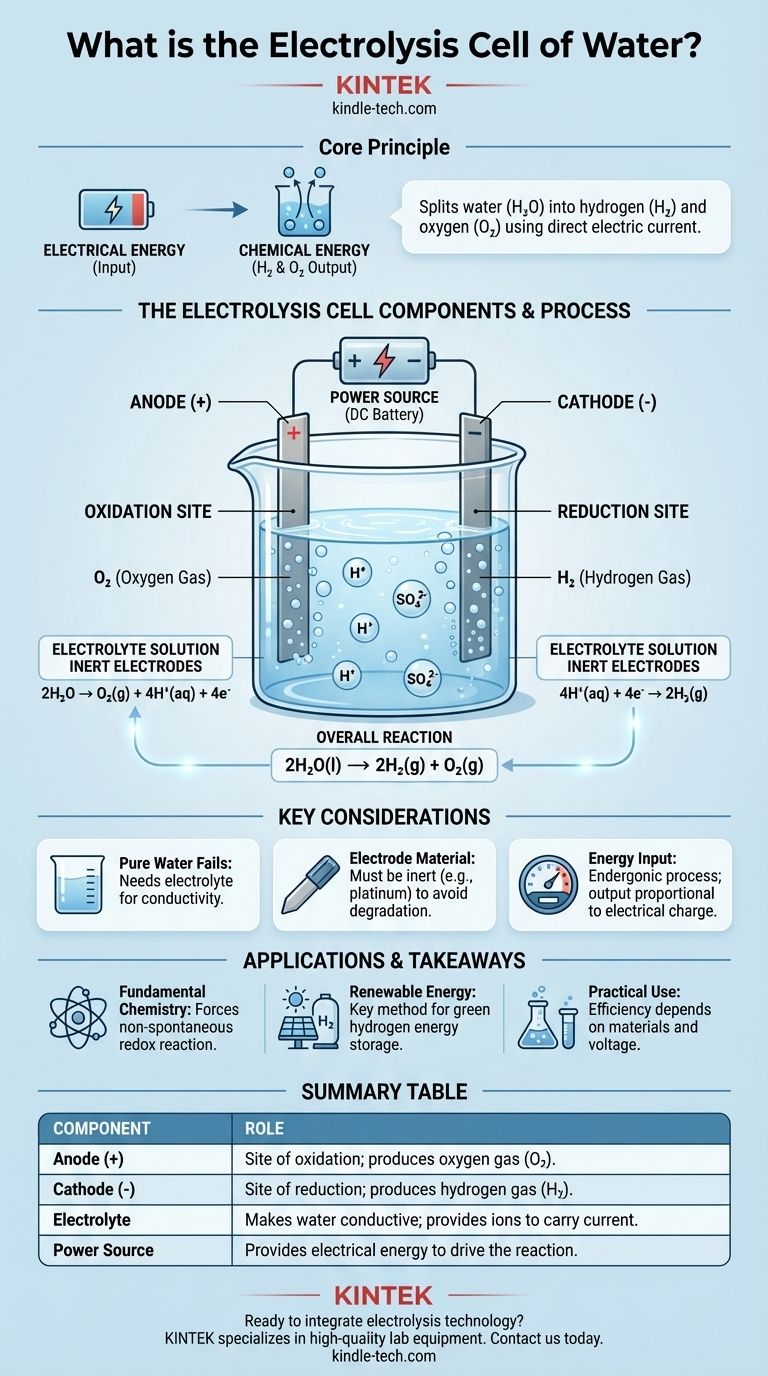
في جوهرها، خلية التحليل الكهربائي للماء هي جهاز يستخدم الطاقة الكهربائية لفصل الماء (H₂O) إلى عناصره المكونة: غاز الهيدروجين (H₂) وغاز الأكسجين (O₂). يتم تحقيق ذلك عن طريق تمرير تيار كهربائي مباشر عبر الماء الذي يحتوي على كمية صغيرة من الإلكتروليت، مما يجبر على حدوث تغيير كيميائي لن يحدث من تلقاء نفسه. المكونات الأساسية هي قطبان كهربائيان (أنود وكاثود) مغموران في الإلكتروليت ومتصلان بمصدر طاقة خارجي.
الغرض الرئيسي لخلية التحليل الكهربائي هو تحويل الطاقة الكهربائية إلى طاقة كيميائية. تستخدم جهدًا خارجيًا لدفع تفاعل أكسدة واختزال غير تلقائي، مما يؤدي بفعالية إلى تخزين الطاقة المدخلة في الروابط الكيميائية لجزيئات الهيدروجين والأكسجين الناتجة.

المكونات الأساسية وأدوارها
تعمل الخلية الإلكتروليتية للماء من خلال التفاعل الدقيق لثلاثة أجزاء رئيسية: الأقطاب الكهربائية، والإلكتروليت، ومصدر الطاقة. يلعب كل منها دورًا مميزًا وحاسمًا في العملية.
الأقطاب الكهربائية: الأنود والكاثود
تحتوي الخلية على قطبين كهربائيين، وهما موصلان يمر من خلالهما التيار الكهربائي إلى المحلول ويخرج منه. عادة ما تكون مصنوعة من مادة خاملة، مثل البلاتين أو الجرافيت، لضمان أنها تسهل التفاعل دون أن تستهلكه.
الأنود هو القطب الموجب. هذا هو موقع الأكسدة، حيث تفقد المواد الإلكترونات.
الكاثود هو القطب السالب. هذا هو موقع الاختزال، حيث تكتسب المواد الإلكترونات.
الإلكتروليت: جعل الماء موصلاً
الماء النقي موصل ضعيف جدًا للكهرباء لأنه يحتوي على عدد قليل جدًا من الأيونات الحرة الحركة لحمل التيار بفعالية.
لحل هذه المشكلة، تضاف كمية صغيرة من الإلكتروليت، مثل حمض الكبريتيك (H₂SO₄). يذوب الإلكتروليت في الماء ويوفر أيونات متحركة (في هذه الحالة، H⁺ و SO₄²⁻) يمكنها نقل الشحنة بين الأقطاب الكهربائية، مما يكمل الدائرة الكهربائية.
مصدر الطاقة: دفع التفاعل
فصل الماء هو تفاعل ماص للطاقة، مما يعني أنه يتطلب إدخال طاقة لحدوثه. الماء مستقر ولن يتحلل تلقائيًا.
يوفر مصدر طاقة خارجي، مثل بطارية أو مصدر تيار مستمر، الجهد اللازم. يدفع هذا الضغط الكهربائي الإلكترونات إلى الكاثود ويسحبها من الأنود، مما يجبر التحلل الكيميائي للماء على المضي قدمًا.
العملية الكيميائية: كيف يتم فصل الماء
العملية الكلية هي تفاعل أكسدة واختزال (أكسدة-اختزال)، مقسمة إلى تفاعلين نصفيين مميزين يحدثان عند كل قطب كهربائي.
الأكسدة عند الأنود (+)
عند الأنود الموجب، تتأكسد جزيئات الماء. تفقد إلكتروناتها، التي تتدفق بعد ذلك من الخلية إلى الدائرة الخارجية.
ينتج عن هذا التفاعل غاز الأكسجين (O₂) وأيونات الهيدروجين (H⁺). التفاعل النصفي هو: 2H₂O → O₂(g) + 4H⁺(aq) + 4e⁻
الاختزال عند الكاثود (-)
تنجذب أيونات الهيدروجين (H⁺) المتولدة عند الأنود (والموجودة من الإلكتروليت الحمضي) إلى الكاثود السالب.
عند الكاثود، تكتسب هذه الأيونات الإلكترونات التي تتدفق من الدائرة الخارجية. ينتج عن تفاعل الاختزال هذا غاز الهيدروجين (H₂). التفاعل النصفي هو: 4H⁺(aq) + 4e⁻ → 2H₂(g)
التفاعل الكلي
عند دمج التفاعلين النصفيين، تلغي الإلكترونات وأيونات الهيدروجين على كلا الجانبين بعضها البعض، مما يكشف عن النتيجة الكلية البسيطة والأنيقة للتحليل الكهربائي للماء.
التغير الكيميائي الصافي هو: 2H₂O(l) → 2H₂(g) + O₂(g). لكل جزيئين من الماء يتم فصلهما، ينتج جزيئان من غاز الهيدروجين وجزيء واحد من غاز الأكسجين.
فهم الاعتبارات الرئيسية
بينما المفهوم واضح ومباشر، هناك عدة عوامل حاسمة لكي تعمل الخلية بشكل صحيح وفعال. يكشف فهم هذه القيود عن الطبيعة الحقيقية للعملية.
لماذا يفشل الماء النقي
بدون إلكتروليت، تكون مقاومة الماء عالية للغاية. سيؤدي تطبيق جهد كهربائي إلى تدفق تيار لا يكاد يذكر، وبالتالي، لا يكاد يوجد إنتاج للهيدروجين أو الأكسجين. لا يستهلك الإلكتروليت؛ وظيفته الوحيدة هي العمل كناقل للشحنة.
مادة القطب حاسمة
استخدام أقطاب خاملة مثل البلاتين ضروري. إذا استخدمت معدنًا نشطًا مثل الزنك أو النحاس للأنود، فإن الأنود نفسه سيتأكسد ويذوب في المحلول بدلاً من الماء. سينتج عن ذلك منتجات مختلفة وغير مقصودة ويدمر القطب.
مدخلات الطاقة تحدد المخرجات
التحليل الكهربائي ليس مصدرًا للطاقة المجانية؛ إنه عملية تحويل للطاقة. تتناسب كمية الهيدروجين والأكسجين المنتجة طرديًا مع كمية الشحنة الكهربائية التي تمر عبر الخلية. يتطلب الأمر كمية كبيرة من الطاقة الكهربائية لإنتاج كمية صغيرة من غاز الهيدروجين.
اتخاذ القرار الصحيح لهدفك
فهم خلية التحليل الكهربائي ذو قيمة للعديد من التخصصات. تعتمد خلاصتك على هدفك الأساسي.
- إذا كان تركيزك الأساسي هو الكيمياء الأساسية: انظر إلى هذا كدليل مثالي على كيفية إجبار الطاقة الكهربائية على تفاعل أكسدة واختزال غير تلقائي، وفصل مركب مستقر إلى عناصره.
- إذا كان تركيزك الأساسي هو الطاقة المتجددة: اعترف بالتحليل الكهربائي كطريقة رئيسية لتخزين الطاقة، وتحويل الكهرباء الفائضة من مصادر مثل الطاقة الشمسية أو الرياح إلى وقود الهيدروجين.
- إذا كان تركيزك الأساسي هو التطبيق العملي: تذكر أن كفاءة ومعدل ومنتجات التحليل الكهربائي تعتمد كليًا على المواد المحددة المستخدمة - الإلكتروليت، ومادة القطب، والجهد المطبق.
في النهاية، التحليل الكهربائي للماء هو عملية قوية تستخدم الكهرباء لإطلاق الطاقة الكيميائية المخزنة داخل جزيء بسيط.
جدول ملخص:
| المكون | الدور في خلية التحليل الكهربائي |
|---|---|
| الأنود (القطب الموجب) | موقع الأكسدة؛ ينتج غاز الأكسجين (O₂). |
| الكاثود (القطب السالب) | موقع الاختزال؛ ينتج غاز الهيدروجين (H₂). |
| الإلكتروليت | يجعل الماء موصلاً؛ يوفر أيونات لحمل التيار. |
| مصدر الطاقة | يوفر الطاقة الكهربائية لدفع التفاعل غير التلقائي. |
هل أنت مستعد لدمج تقنية التحليل الكهربائي في سير عمل مختبرك؟ تتخصص KINTEK في معدات المختبرات والمواد الاستهلاكية عالية الجودة للعمليات الكيميائية المتقدمة. سواء كنت تقوم بتطوير حلول جديدة لتخزين الطاقة أو تجري أبحاثًا أساسية، فإن خبرتنا تضمن حصولك على المعدات الموثوقة التي تحتاجها. اتصل بفريقنا اليوم لمناقشة كيف يمكننا دعم متطلبات مختبرك المحددة.
دليل مرئي
المنتجات ذات الصلة
- خلية التحليل الكهربائي البصري مزدوجة الطبقة من النوع H مع حمام مائي
- خلية كهروكيميائية تحليل كهربائي بخمسة منافذ
- خلية تحليل كهربائي مزدوجة الطبقة بخمسة منافذ وحمام مائي
- خلية التحليل الكهربائي من النوع H خلية كهروكيميائية ثلاثية
- خلية غاز الانتشار الكهروكيميائية التحليلية خلية تفاعل سائل
يسأل الناس أيضًا
- ما هو الغرض من الهيكل مزدوج الطبقات في خلية التحليل الكهربائي من النوع H؟ تحقيق تحكم دقيق في درجة الحرارة
- ما هي الميزات البصرية التي تتميز بها خلية التحليل الكهربائي من النوع H؟ نوافذ كوارتز دقيقة للتصوير الكهروكيميائي
- ما هو النظام التجريبي النموذجي المستخدم مع خلية التحليل الكهربائي ذات الحمام المائي المزدوج الطبقة؟ تحقيق تحكم كهروكيميائي دقيق
- ما هي الميزات الرئيسية لخلية التحليل الكهربائي ذات الحمام المائي مزدوج الطبقة؟ حقق تحكمًا دقيقًا في درجة الحرارة لتجاربك
- ما هو هيكل خلية التحليل الكهربائي ذات الغشاء القابل للتبديل من النوع H؟ دليل للفصل الكهروكيميائي الدقيق



















