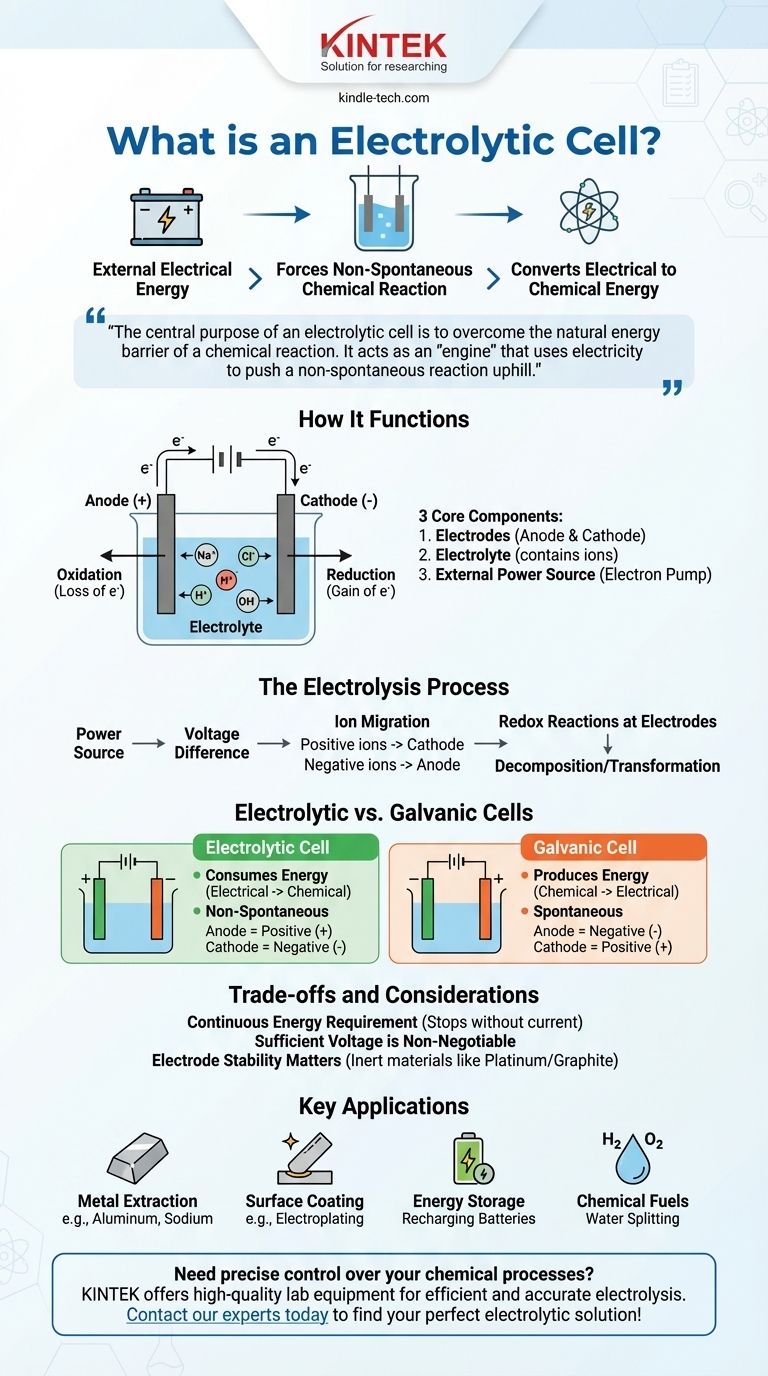
في جوهرها، الخلية الإلكتروليتية هي جهاز يستخدم الطاقة الكهربائية من مصدر خارجي، مثل البطارية، لإجبار تفاعل كيميائي لن يحدث من تلقاء نفسه. هذه العملية، المعروفة بالتحليل الكهربائي، تحول الطاقة الكهربائية إلى طاقة كيميائية مخزنة عن طريق تفكيك المركبات مثل الماء أو الأملاح المنصهرة.
الغرض الأساسي للخلية الإلكتروليتية هو التغلب على حاجز الطاقة الطبيعي للتفاعل الكيميائي. تعمل كـ "محرك" يستخدم الكهرباء لدفع تفاعل غير تلقائي صعودًا، لإنجاز مهام مثل فصل العناصر أو شحن البطارية.

كيف تعمل الخلية الإلكتروليتية
لفهم الخلية الإلكتروليتية، يجب أن ننظر إلى أجزائها الأساسية والعملية التي تمكنها. تم تصميم النظام بأكمله للتحكم في تدفق الإلكترونات والأيونات لدفع تغيير كيميائي محدد.
المكونات الأساسية الثلاثة
تتكون الخلية الإلكتروليتية من ثلاثة أجزاء رئيسية.
-
الأقطاب الكهربائية (الأنود والكاثود): وهما موصلان معدنيان أو إلكترونيان يعملان كمواقع للتفاعل الكيميائي. الأنود هو القطب الموجب حيث يحدث الأكسدة (فقدان الإلكترونات)، والكاثود هو القطب السالب حيث يحدث الاختزال (اكتساب الإلكترونات).
-
الإلكتروليت: وهي مادة، عادة ما تكون محلولًا سائلًا أو ملحًا مصهورًا، تحتوي على أيونات حرة الحركة. يسمح الإلكتروليت بتدفق الشحنة بين القطبين، ليكمل الدائرة الكهربائية.
-
مصدر طاقة خارجي: وهو مكون حاسم، مثل بطارية أو مصدر طاقة تيار مستمر. يعمل كـ "مضخة إلكترونات"، يسحب الإلكترونات بعيدًا عن الأنود ويدفعها إلى الكاثود.
عملية التحليل الكهربائي
يخلق مصدر الطاقة فرق جهد عبر الأقطاب الكهربائية.
هذا يجبر الأيونات في الإلكتروليت على الهجرة. تتحرك الأيونات الموجبة الشحنة نحو الكاثود السالب، وتتحرك الأيونات السالبة الشحنة نحو الأنود الموجب.
عند الأقطاب الكهربائية، تحدث تفاعلات الأكسدة والاختزال (نقل الشحنة). عند الأنود، تفقد المواد الإلكترونات، وعند الكاثود، تكتسب المواد الإلكترونات، مما يؤدي إلى تفكك أو تحول مكونات الإلكتروليت.
التمييز الحاسم: الخلايا الإلكتروليتية مقابل الخلايا الغلفانية
نقطة الالتباس الشائعة هي الفرق بين الخلية الإلكتروليتية ونظيرتها، الخلية الغلفانية (أو الفولتية)، وهي ما نفكر فيه عادة كبطارية قياسية.
تحويل الطاقة
تستهلك الخلية الإلكتروليتية الطاقة. إنها تحول الطاقة الكهربائية إلى طاقة كيميائية.
تنتج الخلية الغلفانية الطاقة. إنها تحول الطاقة الكيميائية المخزنة إلى طاقة كهربائية.
تلقائية التفاعل
التفاعل في الخلية الإلكتروليتية غير تلقائي. يتطلب مدخل طاقة خارجي للمضي قدمًا.
التفاعل في الخلية الغلفانية تلقائي. يحدث بشكل طبيعي، ويطلق الطاقة في هذه العملية.
قطبية القطب الكهربائي
في الخلية الإلكتروليتية، يكون الأنود موجبًا والكاثود سالبًا. هذا لأن مصدر الطاقة الخارجي يحدد الشحنة.
في الخلية الغلفانية، يكون الأنود سالبًا والكاثود موجبًا. يحدد التفاعل الكيميائي التلقائي نفسه الشحنة.
فهم المقايضات والاعتبارات
على الرغم من قوتها، تعمل الخلايا الإلكتروليتية ضمن قيود محددة من المهم التعرف عليها.
متطلب طاقة مستمر
الخاصية الأساسية للخلية الإلكتروليتية هي اعتمادها على مصدر طاقة خارجي. تتوقف عملية التحليل الكهربائي لحظة إزالة التيار الكهربائي.
الجهد الكافي غير قابل للتفاوض
يجب أن يكون الجهد الخارجي المطبق مرتفعًا بما يكفي للتغلب على المقاومة الطبيعية للتفاعل غير التلقائي. إذا كان الجهد منخفضًا جدًا، فلن يحدث أي تغيير كيميائي.
استقرار القطب الكهربائي مهم
يجب اختيار الأقطاب الكهربائية نفسها بعناية. في العديد من العمليات، تُصنع من مواد خاملة مثل البلاتين أو الجرافيت التي تسهل التفاعل دون أن تستهلك. في تطبيقات أخرى، يتم اختيار مادة القطب الكهربائي عمدًا للمشاركة في التفاعل، كما هو الحال في بعض أنواع التنقية.
التطبيقات الرئيسية للخلايا الإلكتروليتية
تمنح القدرة على إجبار التفاعلات الكيميائية الخلايا الإلكتروليتية دورًا مركزيًا في الصناعة والتكنولوجيا.
- إذا كان تركيزك الأساسي هو إنتاج عناصر نقية: يستخدم التحليل الكهربائي لاستخلاص المعادن مثل الألومنيوم من خامها (البوكسيت) أو لإنتاج الصوديوم وغاز الكلور من كلوريد الصوديوم المنصهر.
- إذا كان تركيزك الأساسي هو الطلاء السطحي: تستخدم عملية الطلاء الكهربائي خلية إلكتروليتية لترسيب طبقة رقيقة من معدن واحد (مثل الكروم أو الذهب) على آخر للحماية أو الزخرفة.
- إذا كان تركيزك الأساسي هو تخزين الطاقة: يتضمن إعادة شحن البطارية تشغيلها كخلية إلكتروليتية. يجبر الشاحن الخارجي الأيونات على العودة إلى حالتها الأصلية، لتخزين الطاقة لاستخدامها لاحقًا.
- إذا كان تركيزك الأساسي هو إنشاء وقود كيميائي: يمكن للخلايا الإلكتروليتية تقسيم الماء (H₂O) إلى غاز الهيدروجين وغاز الأكسجين، حيث يعمل الهيدروجين كمصدر وقود نظيف.
من خلال تطبيق الطاقة الكهربائية بدقة، تمنحنا الخلية الإلكتروليتية تحكمًا مباشرًا في التحولات الكيميائية.
جدول الملخص:
| الميزة | الخلية الإلكتروليتية | الخلية الغلفانية (البطارية) |
|---|---|---|
| تحويل الطاقة | تحول الطاقة الكهربائية إلى طاقة كيميائية | تحول الطاقة الكيميائية إلى طاقة كهربائية |
| نوع التفاعل | غير تلقائي (يتطلب طاقة خارجية) | تلقائي (يحدث بشكل طبيعي) |
| شحنة الأنود | موجبة | سالبة |
| الوظيفة الأساسية | دفع التفاعلات الكيميائية المرغوبة (مثل الطلاء الكهربائي) | توليد الكهرباء |
هل تحتاج إلى تحكم دقيق في عملياتك الكيميائية؟ معدات مختبرات KINTEK عالية الجودة، بما في ذلك مصادر الطاقة الموثوقة والأقطاب الكهربائية المتينة، ضرورية للتحليل الكهربائي الفعال والدقيق. سواء كان تطبيقك هو الطلاء الكهربائي، تنقية المعادن، أو أبحاث تخزين الطاقة، فإن موادنا الاستهلاكية وأدواتنا مصممة لأداء فائق. اتصل بخبرائنا اليوم للعثور على الحل الإلكتروليتي المثالي لاحتياجات مختبرك!
دليل مرئي
المنتجات ذات الصلة
- خلية كهروكيميائية تحليل كهربائي بخمسة منافذ
- خلية التحليل الكهربائي من النوع H خلية كهروكيميائية ثلاثية
- خلية كهروكيميائية بالتحليل الكهربائي لتقييم الطلاء
- خلية التحليل الكهربائي البصري مزدوجة الطبقة من النوع H مع حمام مائي
- خلية تحليل كهربائي مزدوجة الطبقة بخمسة منافذ وحمام مائي
يسأل الناس أيضًا
- كيف تساعد وحدة التلميع والحفر الكهروكيميائي في الكشف عن حدود الحبيبات؟ تحليل السبائك عالي الدقة
- كيف تساعد محطة العمل الكهروكيميائية في تقييم مقاومة التآكل؟ قياس أداء الفولاذ المصهور بالليزر
- ما هو الدور الذي تلعبه السيراميك المسامي الزركوني في خلية كهروكيميائية ذات سائل فوق حرج؟ ضمان سلامة البيانات.
- ما هي الوظائف الأساسية للحشيات المصنوعة من السيليكون المخصصة في خلية التدفق الكهروكيميائي؟ مفتاح التحليل الدقيق
- ما هو دور الإلكتروليت في الخلية، وكيف يتم التحكم في التفاعل؟ إتقان العمليات الكهروكيميائية
- ما هو الدور الذي تلعبه خلية الانتشار الكهروكيميائية ذات الحجرتين في دراسة انتشار الهيدروجين في الفولاذ بنسبة 9% كروم؟
- ما الفرق بين الخلية الفولتية والخلية الكهروكيميائية؟ فهم نوعي تحويل الطاقة
- ما هي استخدامات الترسيب الكهربائي؟ تعزيز المتانة والجماليات والإلكترونيات



















