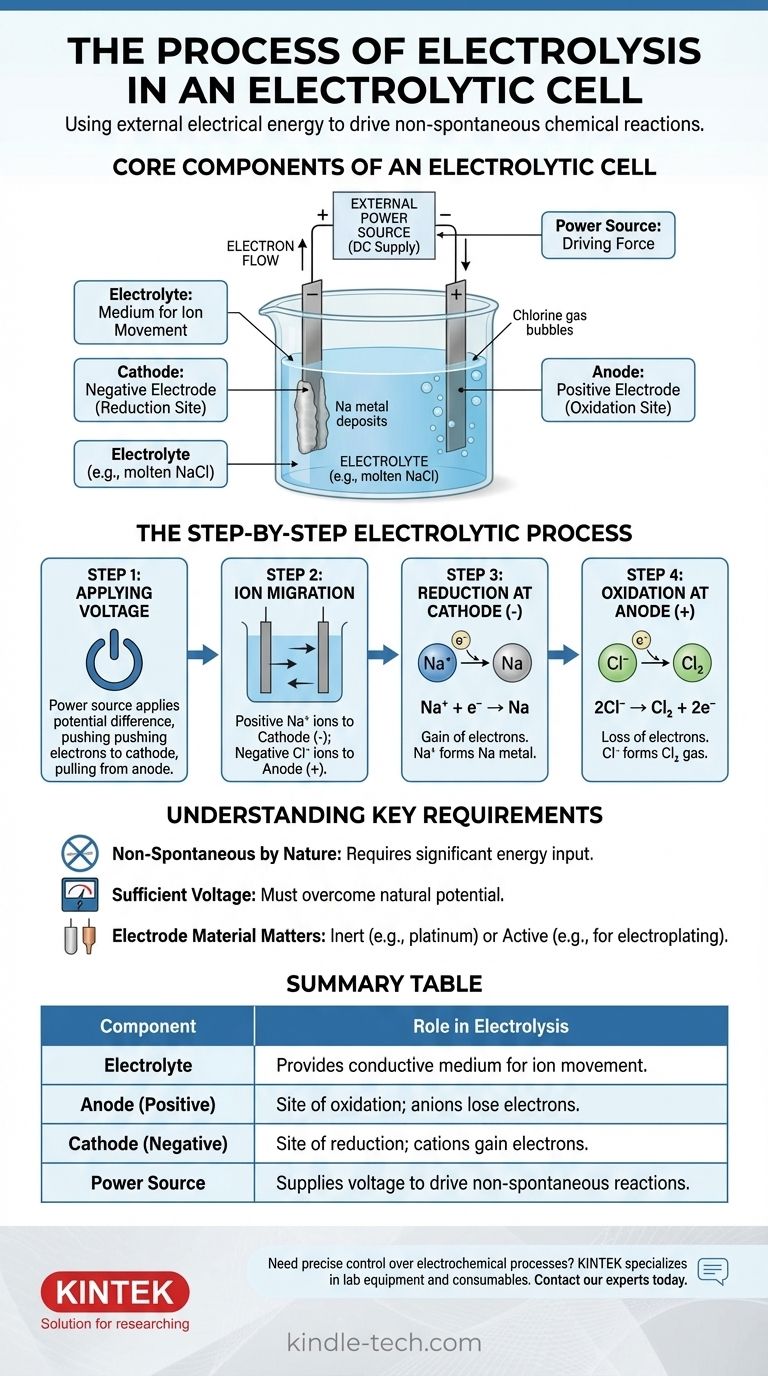
في جوهرها، التحليل الكهربائي هو عملية استخدام الطاقة الكهربائية لدفع تفاعل كيميائي لن يحدث من تلقاء نفسه. يطبق مصدر طاقة خارجي جهدًا عبر قطبين مغمورين في محلول موصل أو ملح منصهر، يسمى الإلكتروليت. هذه الطاقة المطبقة تجبر الأيونات على الهجرة إلى الأقطاب المشحونة بشكل معاكس، حيث تخضع للتحلل من خلال تفاعلات الأكسدة والاختزال.
الخلية الإلكتروليتية هي محرك لعكس التفاعلات الكيميائية. من خلال تطبيق طاقة خارجية، فإنها تجبر الإلكترونات على التدفق ضد ميلها الطبيعي، مما يجبر المركبات الكيميائية المستقرة على التفكك إلى عناصرها المكونة.

المكونات الأساسية للخلية الإلكتروليتية
لفهم العملية، يجب عليك أولاً فهم وظيفة كل جزء. النظام هو تفاعل منسق بعناية بين ثلاثة مكونات رئيسية.
الإلكتروليت: وسط لحركة الأيونات
الإلكتروليت هو مادة تحتوي على أيونات حرة الحركة، مما يجعلها موصلة للكهرباء. عادة ما يكون مركبًا أيونيًا منصهرًا، مثل كلوريد الصوديوم (NaCl)، أو محلولًا مائيًا يحتوي على أيونات مذابة.
الغرض الوحيد من الإلكتروليت هو توفير وسط يمكن للأيونات المشحونة أن تنتقل من خلاله بين الأقطاب الكهربائية.
الأقطاب الكهربائية: الأنود والكاثود
الأقطاب الكهربائية هي مواد موصلة (غالبًا معادن أو جرافيت) مغمورة في الإلكتروليت. إنها تعمل كواجهة مادية حيث تلتقي الدائرة الكهربائية بالمحلول الكيميائي.
في الخلية الإلكتروليتية، يتم تحديد القطبية بواسطة مصدر الطاقة الخارجي:
- الأنود هو القطب الموجب.
- الكاثود هو القطب السالب.
مصدر الطاقة الخارجي: القوة الدافعة
عادة ما يكون هذا بطارية أو مصدر طاقة تيار مستمر. وظيفته هي إنشاء فرق جهد عبر الأقطاب الكهربائية، مما يجبر الإلكترونات على التحرك في اتجاه لا تتحرك فيه تلقائيًا.
هذا الجهد الخارجي هو "المضخة" التي تدفع التفاعل غير التلقائي بأكمله، متغلبًا على الاستقرار الكيميائي الطبيعي للإلكتروليت.
عملية التحليل الكهربائي خطوة بخطوة
تتكشف العملية بتسلسل دقيق بمجرد تنشيط مصدر الطاقة. يمكننا توضيح ذلك باستخدام مثال كلوريد الصوديوم المنصهر (NaCl).
الخطوة 1: تطبيق الجهد
يتم تطبيق جهد خارجي. يدفع مصدر الطاقة الإلكترونات نحو قطب واحد، مما يجعله مشحونًا سالبًا (الكاثود)، ويسحب الإلكترونات بعيدًا عن الآخر، مما يجعله مشحونًا موجبًا (الأنود).
الخطوة 2: هجرة الأيونات
داخل إلكتروليت NaCl المنصهر، يوجد الصوديوم كأيونات موجبة (كاتيونات، Na⁺) ويوجد الكلوريد كأيونات سالبة (أنيونات، Cl⁻).
تتجاذب الأضداد: تنجذب كاتيونات Na⁺ الموجبة نحو الكاثود السالب، بينما تنجذب أنيونات Cl⁻ السالبة نحو الأنود الموجب.
الخطوة 3: الاختزال عند الكاثود (القطب السالب)
عندما تصل كاتيونات Na⁺ إلى الكاثود المشحون سالبًا، تكتسب كل منها إلكترونًا يوفره مصدر الطاقة. هذا الكسب للإلكترونات هو تفاعل اختزال.
تختزل أيونات Na⁺ لتكوين معدن الصوديوم المحايد (Na)، الذي يترسب على الكاثود.
الخطوة 4: الأكسدة عند الأنود (القطب الموجب)
في الوقت نفسه، عندما تصل أنيونات Cl⁻ إلى الأنود المشحون موجبًا، تتخلى كل منها عن إلكترون للقطب. هذا الفقد للإلكترونات هو تفاعل أكسدة.
تتأكسد أيونات Cl⁻ لتكوين ذرات كلور محايدة، والتي تتحد لتصبح غاز الكلور (Cl₂) الذي يتصاعد من الأنود. تنتقل الإلكترونات المتحررة عبر الدائرة الخارجية عائدة إلى مصدر الطاقة، مما يكمل الدائرة.
فهم المتطلبات الرئيسية
التحليل الكهربائي قوي ولكنه يعمل ضمن قيود محددة. يمكن أن يؤدي تجاهل هذه القيود إلى فشل التجارب أو سوء فهم النتائج.
غير تلقائي بطبيعته
المبدأ الأساسي هو أن التحليل الكهربائي يدفع تفاعلًا غير تلقائي. يتطلب تحلل الملح إلى معدن الصوديوم وغاز الكلور، على سبيل المثال، مدخلًا كبيرًا من الطاقة. بدون الجهد الخارجي، لن يحدث شيء.
الحاجة إلى جهد كافٍ
يجب أن يوفر مصدر الطاقة الخارجي جهدًا عاليًا بما يكفي للتغلب على الإمكانات الطبيعية للتفاعل الكيميائي. إذا كان الجهد منخفضًا جدًا، فلن يكون قويًا بما يكفي لإجبار هجرة الأيونات ونقل الإلكترونات، ولن يستمر التفاعل.
مادة القطب مهمة
للتحلل البسيط، تُستخدم أقطاب خاملة (مثل البلاتين أو الكربون). تسهل هذه المواد نقل الإلكترونات دون المشاركة في التفاعل نفسه. في تطبيقات أخرى، مثل الطلاء الكهربائي، يمكن أن يكون الأنود قطبًا "نشطًا" مصممًا للتأكسد والذوبان في الإلكتروليت.
تطبيق هذا على أمثلة شائعة
مبادئ التحليل الكهربائي عالمية، لكن المنتجات المحددة تعتمد كليًا على الإلكتروليت المستخدم.
- إذا كان هدفك هو إنتاج معادن نقية: استخدم ملحًا منصهرًا لذلك المعدن كإلكتروليت. سيتم اختزال المعدن النقي وترسيبه عند الكاثود، كما يظهر في الإنتاج الصناعي للصوديوم والألومنيوم.
- إذا كان هدفك هو تحليل الماء: استخدم الماء مع كمية صغيرة من حمض أو ملح لتحسين التوصيل. ستنتج هذه العملية غاز الهيدروجين (H₂) عند الكاثود وغاز الأكسجين (O₂) عند الأنود.
- إذا كان هدفك هو طلاء جسم بالكهرباء: يتم تعيين الجسم المراد طلاؤه ككاثود. يتم اختزال أيونات المعدن من محلول الإلكتروليت على سطح الجسم، مكونة طبقة معدنية رقيقة وموحدة.
من خلال التحكم في تدفق الإلكترونات، يمكننا التحكم مباشرة وعكس العمليات الكيميائية، وهي قدرة أساسية تدعم الكثير من الصناعة الحديثة.
جدول ملخص:
| المكون | الدور في التحليل الكهربائي |
|---|---|
| الإلكتروليت | يوفر وسطًا موصلًا لحركة الأيونات (مثل NaCl المنصهر). |
| الأنود (موجب) | موقع الأكسدة؛ تفقد الأنيونات الإلكترونات (مثل Cl⁻ ← غاز Cl₂). |
| الكاثود (سالب) | موقع الاختزال؛ تكتسب الكاتيونات الإلكترونات (مثل Na⁺ ← معدن Na). |
| مصدر الطاقة | يوفر الجهد لدفع التفاعلات غير التلقائية. |
هل تحتاج إلى تحكم دقيق في العمليات الكهروكيميائية؟ تتخصص KINTEK في معدات المختبرات والمواد الاستهلاكية للتحليل الكهربائي، والطلاء الكهربائي، وتصنيع المواد. تساعدك مصادر الطاقة الموثوقة، والأقطاب الكهربائية، ومحاليل الإلكتروليت لدينا على تحقيق نتائج متسقة—سواء كنت تقوم بتحليل المركبات، أو تكرير المعادن، أو طلاء الأسطح. اتصل بخبرائنا اليوم لمناقشة الاحتياجات المحددة لمختبرك!
دليل مرئي
المنتجات ذات الصلة
- خلية كهروكيميائية كهروكيميائية كوارتز للتجارب الكهروكيميائية
- خلية التحليل الكهربائي البصري مزدوجة الطبقة من النوع H مع حمام مائي
- خلية غاز الانتشار الكهروكيميائية التحليلية خلية تفاعل سائل
- خلية تدفق قابلة للتخصيص لتقليل انبعاثات ثاني أكسيد الكربون لأبحاث NRR و ORR و CO2RR
- حافظة بطارية ليثيوم-هواء لتطبيقات مختبر البطاريات
يسأل الناس أيضًا
- لماذا يُستخدم خلية التحليل الكهربائي بالكوارتز لمياه الصرف الصحي لحمض الأكريليك؟ ضمان الاستقرار الكيميائي وسلامة البيانات
- ما هي التطبيقات الأساسية للخلية الإلكتروليتية المصنوعة بالكامل من الكوارتز؟ ضرورية للتحليل عالي النقاوة والتحليل البصري
- ما هي مواصفات الفتحة القياسية للخلايا التحليلية الكهربائية المصنوعة بالكامل من الكوارتز، سواء كانت مغلقة أو غير مغلقة؟ قم بتحسين إعداد الكيمياء الكهربائية الخاص بك
- ما هي إجراءات التشغيل واحتياطات السلامة أثناء التجربة باستخدام خلية تحليل كهربائي من الكوارتز بالكامل؟ ضمان السلامة والدقة في مختبرك
- ما هي الاحتياطات التي يجب اتخاذها عند التعامل مع خلية التحليل الكهربائي المصنوعة بالكامل من الكوارتز واستخدامها؟ ضمان أداء آمن ودقيق ومتين



















