معايير التصميم للخلايا الإلكتروليتية
حجم الخلية الإلكتروليتية
يلعب حجم الخلية الإلكتروليتية دورًا محوريًا في تحديد كفاءة ودقة العمليات الكهروكيميائية. ويتوقف الحجم الأمثل للخلية على الحفاظ على نسبة مناسبة بين القطب العامل وحجم المحلول. هذه النسبة ليست ثابتة؛ فهي تختلف بشكل كبير بناءً على نوع القياس أو الاختبار المحدد الذي يتم إجراؤه.
على سبيل المثال، في القياسات التحليلية عالية الدقة، غالبًا ما يُفضل حجم خلية أصغر مع نسبة قطب كهربائي إلى محلول أعلى. يقلل هذا التكوين من سمك طبقة الانتشار، مما يعزز حساسية ودقة القراءات. وعلى العكس من ذلك، في التطبيقات الصناعية التي تنطوي على إنتاج المعادن على نطاق واسع، قد يكون حجم الخلية الأكبر مع نسبة أقل من القطب إلى المحلول ضروريًا لاستيعاب زيادة الإنتاجية ومتطلبات التشغيل.
| نوع القياس | حجم الخلية المفضل | نسبة القطب إلى المحلول |
|---|---|---|
| تحليل عالي الدقة | صغيرة | عالية (على سبيل المثال، 1:10) |
| إنتاج المعادن الصناعية | كبيرة | منخفضة (على سبيل المثال، 1:100) |
إن فهم هذه النسبة وتحسينها أمر بالغ الأهمية لتحقيق النتائج المرجوة في مختلف التطبيقات الكهروكيميائية.
مواد الخلايا الإلكتروليتية
عند اختيار المواد اللازمة للخلايا الإلكتروليتية، يبرز خياران أساسيان: الزجاج وبولي تترافلوروإيثيلين (PTFE). كل مادة لها مجموعة من المزايا والقيود الخاصة بها، والتي يجب مراعاتها بعناية بناءً على التطبيق المحدد والظروف البيئية.
تشتهر مادة PTFE، على وجه الخصوص، بثباتها الاستثنائي، خاصةً في البيئات القاسية مثل القلويات المركزة والماء المائي. ويُعد هذا الثبات أمرًا بالغ الأهمية للحفاظ على سلامة وكفاءة عملية التحليل الكهربائي، خاصةً في البيئات الصناعية حيث لا مفر من التعرض الطويل للمواد المسببة للتآكل. تضمن الطبيعة الخاملة ل PTFE عدم تفاعلها مع الإلكتروليت أو مكونات الخلية الأخرى، وبالتالي تقليل الاضطرابات المحتملة وإطالة العمر التشغيلي للخلية.
ومن ناحية أخرى، يقدم الزجاج فوائده الخاصة، خاصة في التطبيقات التي تكون فيها الشفافية ضرورية لمراقبة عملية التحليل الكهربائي. ومع ذلك، فإن قابليته للتآكل في البيئات القلوية القوية تحد من استخدامه في سياقات معينة. وعلى الرغم من ذلك، يظل الزجاج خيارًا شائعًا للتجارب على نطاق المختبر والعروض التوضيحية التعليمية نظرًا لفعاليته من حيث التكلفة وسهولة تصنيعه.

باختصار، يتوقف الاختيار بين الزجاج وPTFE على المتطلبات المحددة لعملية التحليل الكهربائي، بما في ذلك البيئة الكيميائية وطول العمر التشغيلي واعتبارات التكلفة.
الحجاب الحاجز للخلية الإلكتروليتية
يخدم الحجاب الحاجز في الخلية الإلكتروليتية وظيفة حاسمة في فصل القطب العامل عن القطب المساعد. واحدة من أكثر المواد المستخدمة لهذا الغرض هي الزجاج المسامي. وهذا الاختيار ليس اعتباطيًا؛ فالزجاج المسامي يوفر العديد من المزايا التي تعزز أداء ودقة عملية التحليل الكهربائي.
أولاً، يضمن الزجاج المسامي توزيعًا موحدًا للتيار في جميع أنحاء الخلية. وهذا التوحيد ضروري للحفاظ على قياسات متسقة وموثوقة. ومن خلال توفير مسار متسق لتدفق التيار، يساعد الزجاج المسامي على تقليل التقلبات والأخطاء في البيانات التي يتم جمعها.
وثانيًا، استخدام الزجاج المسامي كغشاء يقلل من التداخل من القطب المساعد. في الخلايا الإلكتروليتية، يمكن للنواتج المتولدة في القطب المساعد أن تنتشر أحيانًا في بيئة القطب العامل، مما يسبب تفاعلات غير مرغوب فيها ويؤدي إلى نتائج منحرفة. تعمل المسام الدقيقة في الزجاج كحاجز يمنع مثل هذا التلوث المتبادل ويحافظ على سلامة بيئة القطب العامل.
بالإضافة إلى ذلك، فإن الزجاج المسامي مقاوم للغاية للهجوم الكيميائي مما يجعله مناسبًا للاستخدام في مجموعة متنوعة من محاليل الإلكتروليت. ويضمن هذا الثبات الكيميائي أن يظل الحجاب الحاجز فعالاً على مدى فترات طويلة، حتى في الظروف القاسية.
وباختصار، فإن اختيار الزجاج المسامي كمادة غشائية مدفوع بقدرته على توفير توزيع موحد للتيار، وتقليل التداخل، والحفاظ على الاستقرار الكيميائي، وكلها أمور حاسمة للتشغيل الدقيق والموثوق للخلايا الإلكتروليتية.
الإلكتروليت
تلعب الإلكتروليتات الخاملة دورًا محوريًا في تصميم الخلايا الإلكتروليتية، وذلك في المقام الأول لمنع هجرة المواد النشطة التي يمكن أن تتداخل مع التفاعلات الكيميائية المقصودة. يجب أن يكون تركيز هذه الشوارد الخاملة أعلى بكثير من تركيز المواد الفعالة لضمان فعاليتها. عادة، يجب أن يكون التركيز أكبر 100 مرة على الأقل من المادة الفعالة. يعمل هذا التركيز العالي كحاجز، مما يقلل من احتمالية التلوث التبادلي ويضمن استقرار وموثوقية عملية التحليل الكهربائي.
على سبيل المثال، في إنتاج المعادن الصناعية، حيث يكون التحكم الدقيق في التفاعلات الكيميائية أمرًا بالغ الأهمية، يضمن استخدام الشوارد الخاملة عدم تعرض التفاعلات الأولية للخطر بسبب وجود أنواع تفاعلية أخرى. ولا تؤدي نسبة التركيز العالية هذه إلى استقرار البيئة الإلكتروليتية فحسب، بل تعزز أيضًا من كفاءة العملية، مما يقلل من احتمال حدوث تفاعلات جانبية غير مرغوب فيها. وبالتالي، فإن الاختيار الدقيق والإدارة الدقيقة للإلكتروليتات الخاملة هي مكونات أساسية في تصميم الخلايا الإلكتروليتية وتشغيلها.
جهاز تنفيس الخلايا الإلكتروليتية
تعد قنوات المدخل والمخرج مكونات أساسية في الخلية الإلكتروليتية، وهي مصممة لتسهيل عمليات إزالة الأكسجين وامتصاص الغازات. تكوين هذه القنوات أمر بالغ الأهمية للحفاظ على كفاءة وسلامة عملية التحليل الكهربائي. وعادةً ما يتم وضع المدخل بشكل استراتيجي في الجزء السفلي من الخلية، مما يضمن توزيع أي غاز وارد بالتساوي عبر الإلكتروليت. ويساعد هذا الموضع السفلي في الخلط الشامل للغازات مع الإلكتروليت، مما يعزز إزالة الأكسجين بشكل فعال.
أما المخرج، من ناحية أخرى، فهو مزود بآلية منع تسرب الماء. ويخدم مانع تسرب الماء هذا أغراضًا متعددة: فهو يمنع التدفق العكسي للغاز من المخرج، ويضمن إطلاق الغازات بشكل متحكم فيه، ويحافظ على ضغط مستقر داخل الخلية. من خلال وجود مانع تسرب الماء، يمكن للخلية الإلكتروليتية أن تعمل في ظروف مثالية، مما يقلل من خطر تسرب الغاز ويضمن بقاء البيئة داخل الخلية مستقرة ومواتية لعملية التحليل الكهربائي.
وباختصار، فإن التصميم الدقيق لقنوات المدخل والمخرج، مع وجود المدخل في الأسفل والمخرج الذي يتميز بختم مائي، أمر بالغ الأهمية لإزالة الأكسجين وامتصاص الغازات بفعالية في الخلايا الإلكتروليتية، وبالتالي تعزيز الكفاءة والسلامة العامة للعملية.
جسر الملح للخلية الإلكتروليتية
يعتبر جسر الملح مكونًا أساسيًا في الخلايا الإلكتروليتية، حيث يعمل كقناة تربط بين الأقطاب المرجعية والبحثية. ويعد هذا الاتصال ضروريًا للحفاظ على الحياد الكهربائي داخل الخلية، وبالتالي تسهيل التدفق السلس للأيونات وإكمال الدائرة الكهربائية. ويتكون الجسر الملحي عادةً من إلكتروليت قوي، مثل كلوريد الصوديوم أو نترات البوتاسيوم، الذي يوضع في أنبوب زجاجي على شكل حرف U أو ينقع في مواد مسامية مثل ورق الترشيح.
وتتمثل إحدى الوظائف الأساسية لجسر الملح في تخفيف جهد التلامس السائل، وهي ظاهرة تحدث عندما يتلامس إلكتروليتان مختلفان، مما يؤدي إلى فرق في الجهد. ومن خلال التأكد من أن محلول الإلكتروليت في جسر الملح خامل وغير تفاعلي مع المحاليل الأخرى، يتم تقليل مخاطر التفاعلات الكيميائية غير المرغوب فيها. ويسمح هذا الخمول بحركة الأيونات دون عوائق بين نصفي الخلية، مما يحافظ على توزيع الشحنة في حالة مستقرة ويمنع التلوث.
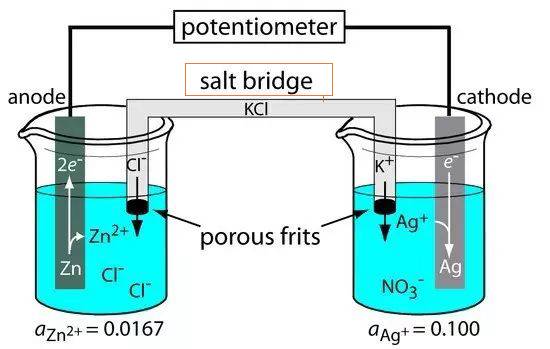
هناك نوعان شائعان من الجسور الملحية: جسر الأنبوب الزجاجي وجسر ورق الترشيح. جسر الأنبوب الزجاجي، كما يوحي الاسم، عبارة عن أنبوب على شكل حرف U مملوء بالشوارد، بينما يستخدم جسر ورق الترشيح ورق ترشيح مسامي مبلل بمحلول إلكتروليت. يخدم كلا النوعين نفس الغرض ولكنهما يختلفان في هيكلهما المادي وسهولة الاستخدام.
في التطبيقات العملية، مثل بناء الخلايا الجلفانية أو الخلايا الفولتية، يلعب جسر الملح دورًا محوريًا. عندما تتدفق الإلكترونات من نصف خلية إلى أخرى من خلال دائرة كهربائية خارجية، ينشأ فرق في الشحنة. وبدون جسر الملح، سيؤدي فرق الشحنة هذا إلى توقف تدفق الإلكترونات بسرعة. ويسمح جسر الملح بالحركة المستمرة للأيونات، مما يضمن بقاء توزيع الشحنة مستقرًا وعمل الخلية بكفاءة.
وباختصار، يعتبر جسر الملح عنصرًا حاسمًا في الخلايا الإلكتروليتية، مما يتيح التدفق السلس للأيونات والحفاظ على الحياد الكهربائي. ويتم اختيار تصميمه وتكوينه بعناية لمنع التفاعلات غير المرغوب فيها وضمان سلامة العملية الكهروكيميائية.
أنبوب Rukin الشعري لخلية التحليل الكهربائي
يؤدي أنبوب Rukin الشعري دورًا محوريًا في تصميم الخلية الإلكتروليتية، خاصةً في الحفاظ على الحد الأدنى من المقاومة بين القطبين المرجعي والشغلي. هذه الميزة الحاسمة ضرورية لتحقيق التحكم الدقيق في الإمكانات، وهو أمر أساسي لدقة وموثوقية العمليات الإلكتروليتية.
الوظائف الرئيسية لأنبوب روكين الشعري
-
الحد الأدنى من المقاومة: تتمثل الوظيفة الأساسية لأنبوب Rukin الشعري في ضمان إبقاء المقاومة الكهربائية بين القطبين المرجعي والعامل عند الحد الأدنى المطلق. ويتحقق ذلك من خلال تصميم الأنبوب، الذي يسمح بتوصيل كهربائي فعال دون فقدان أو تداخل كبير.
-
تحكم دقيق في الإمكانات: من خلال تسهيل الحد الأدنى من المقاومة، يتيح أنبوب Rukin الشعري تحكمًا أكثر دقة في فرق الجهد بين الأقطاب الكهربائية. هذه الدقة أمر بالغ الأهمية لمختلف التطبيقات الإلكتروليتية، من إنتاج المعادن الصناعية إلى البحث العلمي، حيث يمكن أن تؤدي حتى الانحرافات الطفيفة في الإمكانات إلى أخطاء كبيرة.
-
استقرار محسّن: يساهم تصميم أنبوب Rukin الشعري أيضًا في الاستقرار الكلي للخلية الإلكتروليتية. ومن خلال تقليل احتمالية التقلبات المحتملة، فإنه يساعد في الحفاظ على بيئة متسقة ومستقرة لعملية التحليل الكهربائي.
اعتبارات المواد والتصميم
-
اختيار المواد: يُصنع أنبوب Rukin الشعري عادةً من مواد توفر توصيلًا كهربائيًا عاليًا ومقاومة كيميائية، مثل البلاتين أو الذهب. تضمن هذه المواد قدرة الأنبوب على تحمل الظروف القاسية للعمليات الإلكتروليتية دون تدهور.
-
هندسة الأنبوب: تم تصميم هندسة أنبوب Rukin الشعري بعناية لتحسين تدفق التيار الكهربائي. ويشمل ذلك اعتبارات طول الأنبوب وقطره وموضع قنوات المدخل والمخرج، وكلها تساهم في تقليل المقاومة وتعزيز التوصيل.
وباختصار، يعتبر أنبوب Rukin الشعري مكونًا لا غنى عنه في تصميم الخلايا الإلكتروليتية، حيث يوفر حلاً قويًا لضمان الحد الأدنى من المقاومة والتحكم الدقيق في الإمكانات. كما أن اختياره الدقيق للمواد وتصميمه الأمثل يجعله عنصرًا أساسيًا في تحقيق نتائج إلكتروليتية موثوقة ودقيقة.
أنواع الخلايا الإلكتروليتية
خلية إلكتروليتية أحادية الغرفة
تم تصميم الخلايا الإلكتروليتية أحادية الحجرة خصيصًا لدراسات التآكل، حيث يتم وضع كل من الأقطاب الكهربائية البحثية والمساعدة داخل نفس الحجرة. يبسط هذا التكوين الإعداد من خلال التخلص من الحاجة إلى التقسيم المعقد، مما يجعله خيارًا مثاليًا للباحثين الذين يركزون على آليات التآكل.

في مثل هذه الخلايا، يسمح القرب القريب من الأقطاب الكهربائية البحثية والإضافية بمراقبة عمليات التآكل في الوقت الفعلي. وهذا الأمر مفيد بشكل خاص في الدراسات التي يتم فيها ملاحظة التغيرات السريعة في إمكانات القطب الكهربائي، حيث يقلل من الفارق الزمني بين القياسات. بالإضافة إلى ذلك، يقلل تصميم الغرفة الواحدة من خطر التلوث الذي يمكن أن ينشأ من الغرف المنفصلة، مما يضمن جمع بيانات أكثر دقة واتساقًا.
علاوة على ذلك، يسهل استخدام غرفة واحدة التحكم بسهولة في البيئة الإلكتروليتية. يمكن للباحثين ضبط تركيبة الإلكتروليت وتركيزه بدقة، بالإضافة إلى درجة الحرارة والضغط داخل الغرفة لمحاكاة ظروف التآكل المختلفة. هذه القدرة على التكيف أمر بالغ الأهمية لفهم كيفية تأثير العوامل المختلفة على معدلات التآكل وأنماطه.
على الرغم من مزاياها، فإن إعداد الغرفة الواحدة له قيود. على سبيل المثال، عدم وجود غشاء يعني عدم وجود حاجز مادي لفصل نواتج قطب البحث عن نواتج القطب الكهربائي المساعد. وهذا يمكن أن يؤدي إلى تداخل محتمل في القياسات، خاصةً في الدراسات التي تنطوي على مواد شديدة التفاعل أو المواد المتطايرة. لذلك، في حين أن تصميم الغرفة الواحدة عملي للعديد من دراسات التآكل، إلا أنه قد لا يكون مناسبًا لجميع الظروف التجريبية.
الخلية الإلكتروليتية ذات الغرفة المزدوجة
تم تصميم الخلية الإلكتروليتية ذات الغرفة المزدوجة للتخفيف من التداخل من منتجات القطب المساعد من خلال استخدام غشاء يفصل القطب العامل عن القطب المساعد. هذا التكوين مفيد بشكل خاص في الحد من التلوث المتبادل وضمان قياسات أكثر دقة.

الميزات والفوائد الرئيسية
- مادة الحجاب الحاجز: عادةً ما يتم تصنيع الحجاب الحاجز باستخدام زجاج مسامي، ويسمح بمرور الأيونات مع منع التلامس المباشر لمنتجات القطب الكهربائي، وبالتالي الحفاظ على سلامة بيئة العمل.
- توزيع تيار موحد: يضمن الحجاب الحاجز توزيعًا موحدًا للتيار عبر الخلية الإلكتروليتية، وهو أمر بالغ الأهمية للحصول على نتائج متسقة وموثوقة.
- تقليل التداخل: من خلال عزل القطب العامل عن القطب المساعد، يقلل تصميم الغرفة المزدوجة بشكل كبير من احتمالية التداخل، مما يعزز دقة البيانات التي يتم جمعها.
التطبيقات والمزايا
- دراسات التآكل: يعد إعداد الغرفة المزدوجة مفيدًا بشكل خاص في دراسات التآكل حيث يكون الحفاظ على نقاء القطب العامل أمرًا ضروريًا.
- القياسات الدقيقة: بالنسبة للتطبيقات التي تتطلب دقة عالية، كما هو الحال في الكيمياء التحليلية، توفر الخلية ذات الغرفة المزدوجة بيئة محكومة تقلل من التأثيرات الخارجية.
لا يحسن هذا التصميم دقة القياسات فحسب، بل يطيل أيضًا من العمر التشغيلي للأقطاب الكهربائية عن طريق تقليل التعرض للمنتجات الثانوية الضارة المحتملة.
أنواع التحليل الكهربائي بناءً على توليد المنتج
نوع التحليل الكهربائي للماء
التحليل الكهربائي للماء هو عملية أساسية تحدث في ظل ظروف محددة، تشمل في المقام الأول الأحماض المؤكسدة , والقواعد القوية و ومحاليل الأملاح الحمضية المؤكسدة للمعادن النشطة . ويتميز هذا النوع من التحليل الكهربائي بتحلل جزيئات الماء إلى غازات الهيدروجين والأكسجين، وهو تفاعل مثير للاهتمام من الناحية العلمية ومهم من الناحية الصناعية.
ولفهم التحليل الكهربي للماء، من الضروري الخوض في طبيعة الشوارد المعنية. الأحماض المؤكسدة مثل حمض النيتريك (HNO₃) وحمض الكبريتيك (H₂SO₄)، تحتوي على ذرات أكسجين مرتبطة بالذرة المركزية، ما يسهل إطلاق الأكسجين أثناء عملية التحليل الكهربائي. وبالمثل القواعد القوية مثل هيدروكسيد الصوديوم (NaOH) وهيدروكسيد البوتاسيوم (KOH) توفر بيئة قلوية للغاية تعزز تفكك جزيئات الماء.

في سياق المحاليل الملحية الحمضية المؤكسدة للمعادن النشطة مثل نترات الصوديوم (NaNO₃) أو كبريتات البوتاسيوم (K₂SO₄)، فإن وجود المعادن النشطة مثل الصوديوم (Na) أو البوتاسيوم (K₂SO₄) يعزز توصيلية المحلول، وبالتالي يسهل عملية التحليل الكهربائي. عندما تذوب هذه الأملاح في الماء، تخلق وسطًا موصلًا حيث تعمل المعادن النشطة كحاملات للشحنات، مما يدعم تدفق الإلكترونات اللازمة لحدوث التحليل الكهربائي.
والتحليل الكهربي للماء ليس فقط عملية رئيسية في العديد من التطبيقات الصناعية، مثل إنتاج غاز الهيدروجين لخلايا الوقود، ولكنه أيضًا بمثابة مفهوم أساسي في الكيمياء الكهربية. ويُعد فهم الظروف المحددة التي تحدث فيها هذه العملية - سواء في وجود الأحماض المؤكسدة أو القواعد القوية أو المحاليل الحمضية المؤكسدة للمعادن النشطة - أمرًا بالغ الأهمية لتحسين تصميم الخلايا الإلكتروليتية وضمان كفاءة تحويل الطاقة.
تحلل نوع الإلكتروليت
إن تحلل نوع الإلكتروليت هو عملية محددة تحدث في ظل ظروف معينة، خاصةً مع الأحماض الخالية من الأكسجين والمحاليل التي تحتوي على معادن غير نشطة وأملاح خالية من الأكسجين. ويختلف هذا النوع من التحليل الكهربي عن غيره بسبب غياب الأكسجين الذي يؤثر بشكل كبير على التفاعلات الكيميائية في الأقطاب الكهربائية.
في البيئات الخالية من الأكسجين، لا تساهم الأحماض والأملاح في تكوين غاز الأكسجين، وهو منتج ثانوي شائع في العديد من عمليات التحليل الكهربائي. وبدلاً من ذلك، ينصب التركيز على التفاعل المباشر بين الإلكتروليت والأقطاب الكهربائية، مما يؤدي إلى تحلل الإلكتروليت نفسه. وتعد هذه العملية حاسمة في التطبيقات الصناعية حيث يكون الحفاظ على بيئة خالية من الأكسجين أمرًا ضروريًا لمنع التلوث وضمان نقاء المنتجات النهائية.
على سبيل المثال، في إنتاج بعض المعادن، يمكن أن يؤدي استخدام الأحماض والأملاح الخالية من الأكسجين في إنتاج بعض المعادن إلى منع تكوين الأكاسيد، والتي يمكن أن تضر بجودة المعدن. ويبسط غياب الأكسجين أيضًا خطوات ما بعد المعالجة، حيث لا توجد حاجة لإزالة الشوائب القائمة على الأكسجين من المنتج.
وباختصار، يتميز التحلل من نوع الإلكتروليت باعتماده على ظروف خالية من الأكسجين، والتي لا تغير المسارات الكيميائية فحسب، بل تعزز أيضًا كفاءة ونقاء المنتجات الناتجة.
النوع القلوي المطلق للهيدروجين
إن النوع القلوي لإطلاق الهيدروجين من التحليل الكهربائي هو عملية محددة تحدث في وجود معادن نشطة ومحاليل حمض لا هوائي. ويتميز هذا النوع من التحليل الكهربي بإطلاق غاز الهيدروجين عند المهبط، وهو نتيجة مباشرة لاختزال أيونات الهيدروجين الموجودة في المحلول الحمضي اللاهوائي. وتؤدي الفلزات النشطة، التي عادة ما تكون فلزات قلوية أو قلوية ترابية، دورًا حاسمًا في هذه العملية من خلال توفير الإلكترونات اللازمة لتفاعل الاختزال.
والطبيعة اللاهوائية للمحلول الحمضي ضرورية لمنع تكوين غاز الأكسجين، الذي من شأنه أن يعقد عملية التحليل الكهربي. في البيئة اللاهوائية، تكون أيونات الهيدروجين هي الأنواع الأساسية التي تخضع للاختزال، مما يؤدي إلى إنتاج غاز الهيدروجين بكفاءة. وتكتسب هذه العملية أهمية خاصة في التطبيقات الصناعية حيث يكون إنتاج غاز الهيدروجين هدفاً رئيسياً، كما هو الحال في إنتاج بعض المواد الكيميائية أو في تكنولوجيا خلايا الوقود.
ولتسهيل هذا النوع من التحليل الكهربائي، يجب تصميم الخلية الإلكتروليتية مع مراعاة اعتبارات محددة. وغالبًا ما يتم استخدام غشاء، مثل الزجاج المسامي، لفصل القطب العامل عن القطب المساعد، مما يضمن توزيع التيار بشكل موحد وتقليل التداخل من نواتج القطب المساعد. وبالإضافة إلى ذلك، يجب التحكم في تركيز الإلكتروليت بعناية لمنع هجرة المواد النشطة، مما قد يؤثر سلبًا على عملية التحليل الكهربائي.
باختصار، يعتبر نوع التحليل الكهربائي القلوي لإطلاق الهيدروجين عملية متخصصة تستفيد من تفاعلية المعادن النشطة وخصائص المحاليل الحمضية اللاهوائية لإنتاج غاز الهيدروجين بكفاءة. ويعد التصميم السليم للخلية الإلكتروليتية واختيار المواد أمرًا بالغ الأهمية لضمان نجاح هذه العملية في التطبيقات الصناعية.
نوع الحمض المولد للأكسجين
إن نوع الحمض المولد للأكسجين من التحليل الكهربي يتميز بحدوثه مع محاليل الأكسجينات المعدنية غير النشطة. وتكتسب هذه المحاليل، التي تشمل مركبات مثل النترات والكبريتات، أهمية خاصة في التطبيقات الصناعية حيث يكون توليد الأكسجين عملية بالغة الأهمية.
وفي هذا النوع من التحليل الكهربائي، تؤدي المعادن غير النشطة، التي لا تشارك بسهولة في التفاعلات الكيميائية، دورًا حاسمًا. وتعمل الأكسجينات الموجودة في المحلول كمصدر أساسي للأكسجين، مما يسهل عملية التحليل الكهربائي. ويضمن استقرار هذه المعادن غير النشطة أن الخلية الإلكتروليتية يمكن أن تعمل بكفاءة دون خطر التلوث أو التفاعلات غير المقصودة.
وتنطوي العملية على تحلل الأكسجين، مما يؤدي إلى إطلاق غاز الأكسجين عند المصعد. وهذا الإطلاق هو نتيجة مباشرة للعمل الإلكتروليتي، حيث يتسبب التيار الكهربائي المطبق في تكسير الأكسجين إلى العناصر المكونة له. وتبقى المعادن غير النشطة غير متأثرة إلى حد كبير، مما يحافظ على سلامة ونقاء البيئة الإلكتروليتية.
وتشمل العوامل الرئيسية التي يجب مراعاتها في هذا النوع من التحليل الكهربي تركيز الأوكسجينات في المحلول واستقرار المعادن غير النشطة. يجب التحكم في التركيز بعناية لضمان توليد الأكسجين على النحو الأمثل، بينما يجب اختيار المعادن على أساس خمولها لمنع أي تداخل مع عملية التحليل الكهربائي.
وبشكل عام، فإن نوع الحمض المولد للأكسجين للتحليل الكهربائي ضروري في الصناعات التي يكون فيها التحكم الدقيق في إنتاج الأكسجين ضروريًا، كما هو الحال في تكرير المعادن وبعض عمليات التصنيع الكيميائي.
شروط تحويل الطاقة والتحليل الكهربائي
خصائص الكاثود والأنود
في عمليات التحليل الكهربائي، يمكن أن تختلف أدوار الكاثود والأنود بشكل كبير اعتمادًا على التفاعل المحدد الذي يحدث داخل الخلية. وفي حين أن هذين القطبين هما مكونان أساسيان في الخلية الإلكتروليتية، فإن مشاركتهما في التفاعل الكيميائي ليست واضحة دائمًا.
فالكاثود، الذي عادةً ما يكون موقع الاختزال، والأنود، حيث تحدث الأكسدة، لا يشاركان بالضرورة بشكل مباشر في التفاعل. وهذا يعني أن الأقطاب الكهربائية نفسها يمكن أن تظل خاملة كيميائياً طوال العملية، حيث تعمل فقط كقنوات لتدفق الإلكترونات. على سبيل المثال، في بعض الخلايا الإلكتروليتية، تُصنع الأقطاب الكهربائية من مواد مثل البلاتين أو الجرافيت، وهي معروفة بثباتها الكيميائي ومقاومتها للتفاعل في ظل ظروف التحليل الكهربائي.
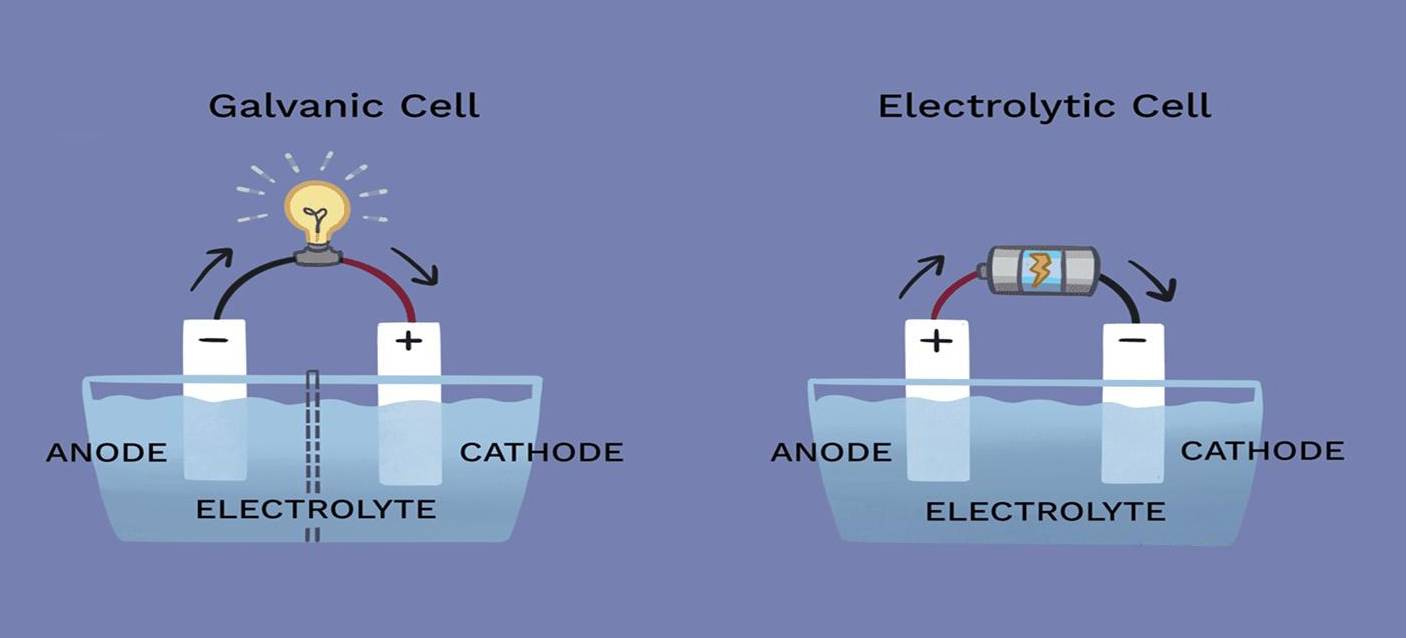
وعلاوة على ذلك، فإن شرط الخمول ليس عالميًا. في بعض التطبيقات، يتم استخدام أقطاب نشطة يمكن أن تخضع لتغيرات أثناء العملية. يمكن أن تؤثر هذه الأقطاب النشطة على ديناميكيات التفاعل، مما قد يغير كفاءة أو نتيجة التحليل الكهربائي. ولذلك، فإن الاختيار بين الأقطاب الخاملة والنشطة هو اعتبار تصميمي حاسم يؤثر على الأداء العام وفعالية الخلية الإلكتروليتية.
شروط التحليل الكهربائي
التحليل الكهربائي هو عملية تتطلب شروطًا محددة لتعمل بفعالية. ويتطلب التحليل الكهربائي في جوهره مصدر طاقة تيار مباشر (DC) . وهذا يضمن تدفق ثابت للطاقة الكهربائية، وهو أمر ضروري لتحريك التفاعلات الكيميائية في الأقطاب الكهربائية.
يتضمن الإعداد توصيلات مميزة للقطب المهبط والقطب الأنود . وعادةً ما يتم توصيل الكاثود، الذي يجذب الكاتيونات، بالطرف السالب لمصدر طاقة التيار المستمر، بينما يتم توصيل الأنود، الذي يجذب الأنيونات، بالطرف الموجب. هذه التوصيلات ضرورية للاتجاه الصحيح لتدفق الإلكترونات والتحولات الكيميائية اللاحقة.
ولكي يحدث التحليل الكهربي، يجب غمر الأقطاب الكهربائية في محلول إلكتروليت أو أو إلكتروليت منصهر . يعمل الإلكتروليت كوسيط يمكن أن تتحرك من خلاله الأيونات، مما يسهل توصيل الكهرباء. ويُعد اختيار الإلكتروليت أمرًا بالغ الأهمية، حيث يجب أن يكون قادرًا على التفكك إلى أيونات يمكنها المشاركة في التفاعلات الكهروكيميائية.
وأخيرًا، يجب أن تكون الدائرة المغلقة ضرورية لإكمال المسار الكهربائي. وهذا يضمن تدفق الإلكترونات من الأنود إلى المهبط عبر الدائرة الخارجية، بينما تتحرك الأيونات عبر محلول الإلكتروليت. وبدون دائرة مغلقة، سينقطع تدفق الكهرباء وتتوقف عملية التحليل الكهربي.
المنتجات ذات الصلة
- خلية كهروكيميائية للتآكل المسطح
- خلية كهروكيميائية تحليل كهربائي بخمسة منافذ
- خلية التحليل الكهربائي من النوع H خلية كهروكيميائية ثلاثية
- خلية تحليل كهربائي مزدوجة الطبقة بخمسة منافذ وحمام مائي
- حمام مائي متعدد الوظائف للخلية الكهروكيميائية بطبقة واحدة أو مزدوجة
المقالات ذات الصلة
- تقنيات الخلايا الإلكتروليتية المتقدمة لأحدث الأبحاث المعملية
- فهم أقطاب الكالوميل المشبعة المرجعية: التركيب والاستخدامات والاعتبارات
- استكشاف حمام ماء الخلايا الإلكتروليتية متعدد الوظائف: التطبيقات والفوائد
- التقنيات المتقدمة في تقييم الطلاء باستخدام الخلايا الإلكتروليتية
- كيف تصنع القطب المرجعي Ag / AgCl الخاص بك للتجارب الكهروكيميائية














