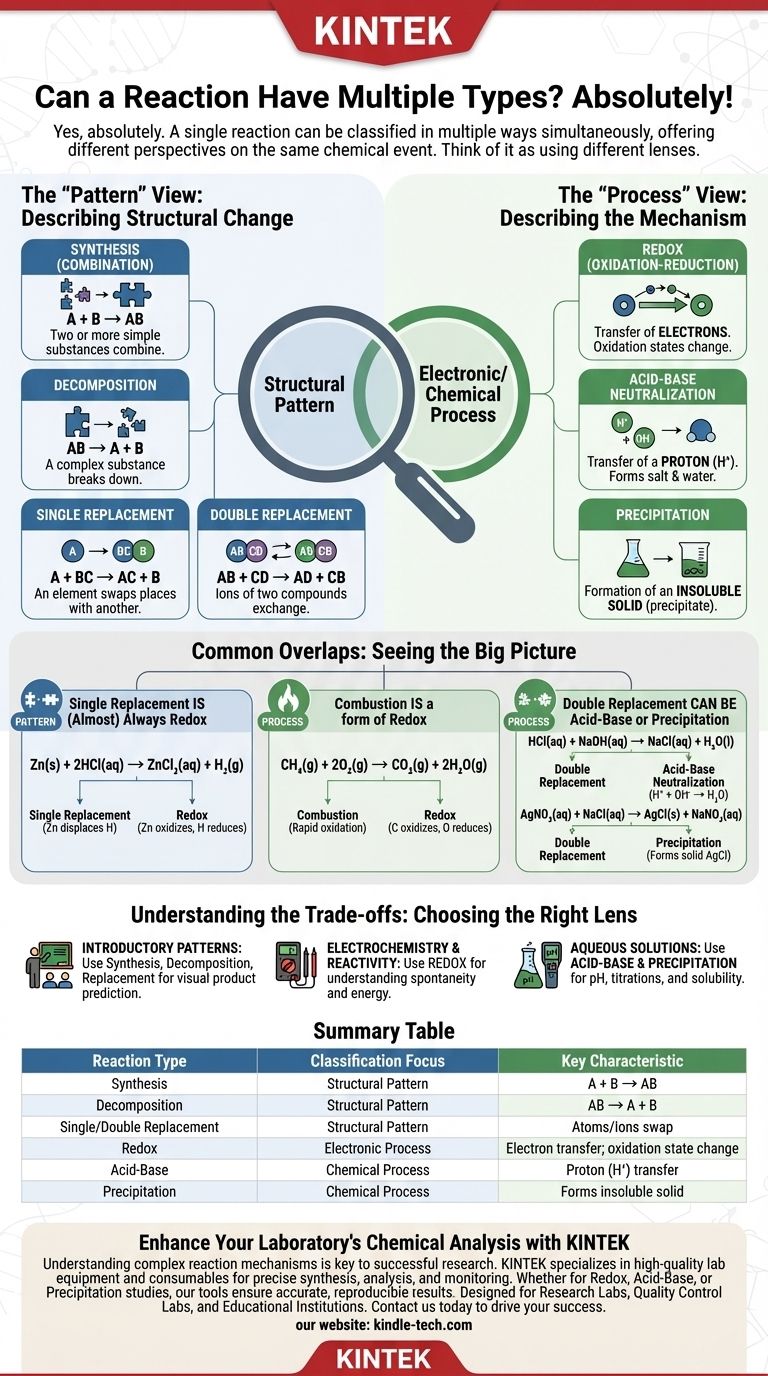
نعم، بالتأكيد. غالبًا ما يمكن تصنيف التفاعل الكيميائي الواحد على أنه عدة أنواع من التفاعلات في وقت واحد. هذه نقطة شائعة للالتباس لأن الكيمياء التمهيدية غالبًا ما تقدم أنواع التفاعلات على أنها فئات متبادلة الاستبعاد، ولكن الفهم الأكثر تقدمًا يكشف أنها مجرد عدسات مختلفة لتحليل نفس الحدث الكيميائي.
المفتاح هو فهم أن بعض أنواع التفاعلات تصف النمط الهيكلي لكيفية إعادة ترتيب الذرات (مثل التخليق أو التفكك)، بينما يصف البعض الآخر العملية الإلكترونية أو الكيميائية الأساسية (مثل الأكسدة والاختزال أو الحمض والقاعدة). يمكن أن يُظهر التفاعل الواحد كلاً من نمط محدد وعملية محددة.

لماذا لا تكفي التصنيفات البسيطة
تعتمد الطريقة التي نصنف بها التفاعلات على ما نريد أن نفهمه عنها. الفئات البسيطة التي يتم تعلمها أولاً مفيدة للتعرف على الأنماط المرئية، لكنها لا تشرح دائمًا التغيير الكيميائي الأساسي.
منظور "النمط": وصف التغيير الهيكلي
في وقت مبكر من تعليمك الكيميائي، تتعلم التعرف على التفاعلات من خلال كيفية تكوين النواتج من المتفاعلات. تصف هذه الفئات "شكل" التحول العام.
الأنواع الرئيسية القائمة على النمط هي:
- التخليق (أو الاتحاد): تتحد مادتان بسيطتان أو أكثر لتكوين ناتج أكثر تعقيدًا (
A + B → AB). - التفكك: تتحلل مادة معقدة إلى مواد أبسط (
AB → A + B). - الاستبدال الأحادي: يتبادل عنصر ما مكانه مع عنصر آخر في مركب (
A + BC → AC + B). - الاستبدال المزدوج: تتبادل أيونات مركبين أماكنها لتكوين مركبين جديدين (
AB + CD → AD + CB).
هذه التصنيفات ممتازة للتنبؤ السريع بالنواتج بناءً على نمط مألوف.
منظور "العملية": وصف الآلية
التصنيفات الأكثر تطوراً تصف كيف يحدث التحول على المستوى الجزيئي أو الإلكتروني. إنها تركز على العملية الأساسية التي تحرك التفاعل.
تشمل الأنواع الرئيسية القائمة على العملية ما يلي:
- الأكسدة والاختزال (Redox): يتضمن هذا النوع نقل الإلكترونات. تتغير حالات الأكسدة لعنصر واحد أو أكثر أثناء التفاعل.
- معادلة الحمض والقاعدة: يتفاعل حمض وقاعدة، وعادة ما يتضمن نقل بروتون (أيون H⁺) لتكوين ملح وماء.
- الترسيب: يتم خلط محلولين مائيين، ويتكون صلب غير قابل للذوبان (راسب).
هذه التصنيفات ضرورية لفهم القوى الدافعة الكامنة وراء التفاعل.
التداخلات الشائعة التي ستصادفها
إن رؤية كيفية تداخل هذه الفئات هي أفضل طريقة لترسيخ فهمك. ستحتوي معظم التفاعلات التي تصادفها على أكثر من تصنيف واحد صالح.
الاستبدال الأحادي هو دائمًا تقريبًا تفاعل أكسدة واختزال
انظر إلى تفاعل الزنك المعدني مع حمض الهيدروكلوريك:
Zn(s) + 2HCl(aq) → ZnCl₂(aq) + H₂(g)
هذا تفاعل استبدال أحادي كلاسيكي لأن الزنك يزيح الهيدروجين. ومع ذلك، فهو أيضًا تفاعل أكسدة واختزال لأن حالات الأكسدة تتغير: يتأكسد الزنك (من 0 إلى +2) ويُختزل الهيدروجين (من +1 إلى 0).
الاحتراق هو شكل من أشكال الأكسدة والاختزال
احتراق الميثان مثال جيد:
CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(g)
على الرغم من أننا نسمي هذا احتراقًا، إلا أنه أيضًا تفاعل أكسدة واختزال أساسي. يتأكسد الكربون (من -4 إلى +4) ويُختزل الأكسجين (من 0 إلى -2).
الاستبدال المزدوج يمكن أن يكون حمضًا وقاعدة أو ترسيبًا
انظر إلى معادلة حمض الهيدروكلوريك مع هيدروكسيد الصوديوم:
HCl(aq) + NaOH(aq) → NaCl(aq) + H₂O(l)
هذا تفاعل استبدال مزدوج؛ يتبادل أيوني Na⁺ و H⁺ الأماكن. والأهم من ذلك، أنه المثال المحدد لـ معادلة الحمض والقاعدة.
وبالمثل، خلط نترات الفضة وكلوريد الصوديوم:
AgNO₃(aq) + NaCl(aq) → AgCl(s) + NaNO₃(aq)
هذا يتناسب مع نمط الاستبدال المزدوج، لكن أهم سمة له هي تكوين مادة صلبة، مما يجعله تفاعل ترسيب.
فهم المفاضلات: الغرض من التصنيف
اختيار التسمية لا يتعلق بإيجاد الإجابة "الصحيحة" الوحيدة. بل يتعلق باستخدام التسمية الأكثر وصفًا وفائدة لهدفك المحدد.
محدودية الأنماط البسيطة
تصنيف التفاعل على أنه "استبدال أحادي" يخبرك بما حدث للذرات، لكنه لا يشرح لماذا حدث ذلك. إنه لا يوضح سبب تفاعل الزنك مع حمض الهيدروكلوريك بينما النحاس لا يتفاعل.
قوة التصنيفات الميكانيكية
تحديد نفس التفاعل على أنه "أكسدة واختزال" يوفر رؤية أعمق بكثير. يسمح لك باستخدام مفاهيم مثل سلسلة النشاط أو جهود الأقطاب القياسية للتنبؤ بما إذا كان التفاعل سيحدث تلقائيًا ولقياس الطاقة المتضمنة. تسمية الأكسدة والاختزال تشرح "السبب".
اتخاذ القرار الصحيح لهدفك
استخدم التصنيف الذي يخدم غرضك بشكل أفضل. الهدف ليس العثور على تسمية واحدة وحصرية، بل تطبيق التسمية الأكثر صلة.
- إذا كان تركيزك الأساسي هو التعرف على الأنماط الأساسية في دورة تمهيدية: التزم بالتخليق والتفكك والاستبدال الأحادي/المزدوج للتنبؤ بالنواتج بصريًا.
- إذا كان تركيزك الأساسي هو الكيمياء الكهربائية أو التنبؤ بالتفاعلية: تصنيف الأكسدة والاختزال هو العدسة الأكثر أهمية للاستخدام.
- إذا كان تركيزك الأساسي هو العمل مع المحاليل المائية ودرجة الحموضة والمعايرات: سيكون تصنيف التفاعلات على أنها حمض-قاعدة أو ترسيب هو النهج الأكثر فائدة.
في نهاية المطاف، يعتمد استخدام التسمية الصحيحة على السؤال المحدد الذي تحاول الإجابة عليه حول التحول الكيميائي.
جدول الملخص:
| نوع التفاعل | تركيز التصنيف | السمة الرئيسية |
|---|---|---|
| التخليق | النمط الهيكلي | يتحد اثنان أو أكثر من المتفاعلات في ناتج واحد (A + B → AB) |
| التفكك | النمط الهيكلي | يتحلل مركب واحد إلى مواد أبسط (AB → A + B) |
| الاستبدال الأحادي/المزدوج | النمط الهيكلي | تتبادل الذرات أو الأيونات الأماكن بين المركبات |
| الأكسدة والاختزال | العملية الإلكترونية | تتضمن نقل الإلكترونات؛ تتغير حالات الأكسدة |
| الحمض-القاعدة | العملية الكيميائية | تتضمن نقل البروتون (H⁺) |
| الترسيب | العملية الكيميائية | تكوين مادة صلبة غير قابلة للذوبان من محاليل مائية |
عزز التحليل الكيميائي لمختبرك مع KINTEK
يعد فهم آليات التفاعل المعقدة أمرًا أساسيًا للبحث والتطوير الناجح. في KINTEK، نحن متخصصون في توفير معدات ومستهلكات مختبرية عالية الجودة تدعم التخليق الكيميائي والتحليل ومراقبة العمليات بدقة. سواء كنت تعمل على تفاعلات الأكسدة والاختزال، أو معايرات الحمض والقاعدة، أو دراسات الترسيب، فإن أدواتنا الموثوقة تساعدك على تحقيق نتائج دقيقة وقابلة للتكرار.
تم تصميم منتجاتنا من أجل:
- مختبرات الأبحاث التي تتطلب تحكمًا دقيقًا في درجة الحرارة لتفاعلات التخليق والتفكك.
- مختبرات مراقبة الجودة التي تحتاج إلى معدات متسقة لتحليلات الحمض والقاعدة والترسيب.
- المؤسسات التعليمية التي تبحث عن أجهزة متينة وسهلة الاستخدام لتعليم أنواع التفاعلات الأساسية والمتقدمة.
دع KINTEK تكون شريكك الموثوق به في تطوير قدرات مختبرك. اتصل بنا اليوم لمناقشة احتياجاتك المحددة واكتشاف كيف يمكن لحلولنا أن تدفع نجاحك.
دليل مرئي
المنتجات ذات الصلة
- خلية غاز الانتشار الكهروكيميائية التحليلية خلية تفاعل سائل
- مفاعل مفاعل ضغط عالي من الفولاذ المقاوم للصدأ للمختبر
- مفاعلات الضغط العالي القابلة للتخصيص للتطبيقات العلمية والصناعية المتقدمة
- دورة تسخين بدرجة حرارة ثابتة عالية، حمام مائي، مبرد، دورة للمفاعل
- مطحنة طحن الأنسجة الهجينة المختبرية
يسأل الناس أيضًا
- لماذا لا يُستخدم التذرية بالتيار المستمر (DC sputtering) للعوازل؟ التغلب على تأثير تراكم الشحنات باستخدام التذرية بالترددات الراديوية (RF Sputtering)
- ما هي أوجه التشابه بين عمليتي التكليس والتلبيد؟ شرح المبادئ الحرارية المشتركة الرئيسية
- كيف تحافظ على درجة الحرارة ثابتة في المختبر؟ إتقان التحكم الحراري الدقيق للحصول على نتائج موثوقة
- ما هو المعالجة الحرارية في عملية التصنيع؟ تحويل خصائص المواد لتحقيق أداء فائق
- ما هي مرشحة الضغط في الصناعة؟ دليل الفصل عالي الضغط بين المواد الصلبة والسائلة
- كيف يؤثر جهاز التحضين الهزاز على إنتاجية السكريات المختزلة؟ تحسين التحلل المائي لـ Pennisetum alopecuroides
- ما هو الفرق بين السبيكة (Sinter) والكرات (Pellet)؟ حسّن فرن الصهر الخاص بك باختيار التكتل (Agglomeration) المناسب
- ما هي الاعتبارات الرئيسية لمعدات التحريك للزيوت عالية اللزوجة؟ تحسين الاختزال التحفيزي الخالي من المذيبات






