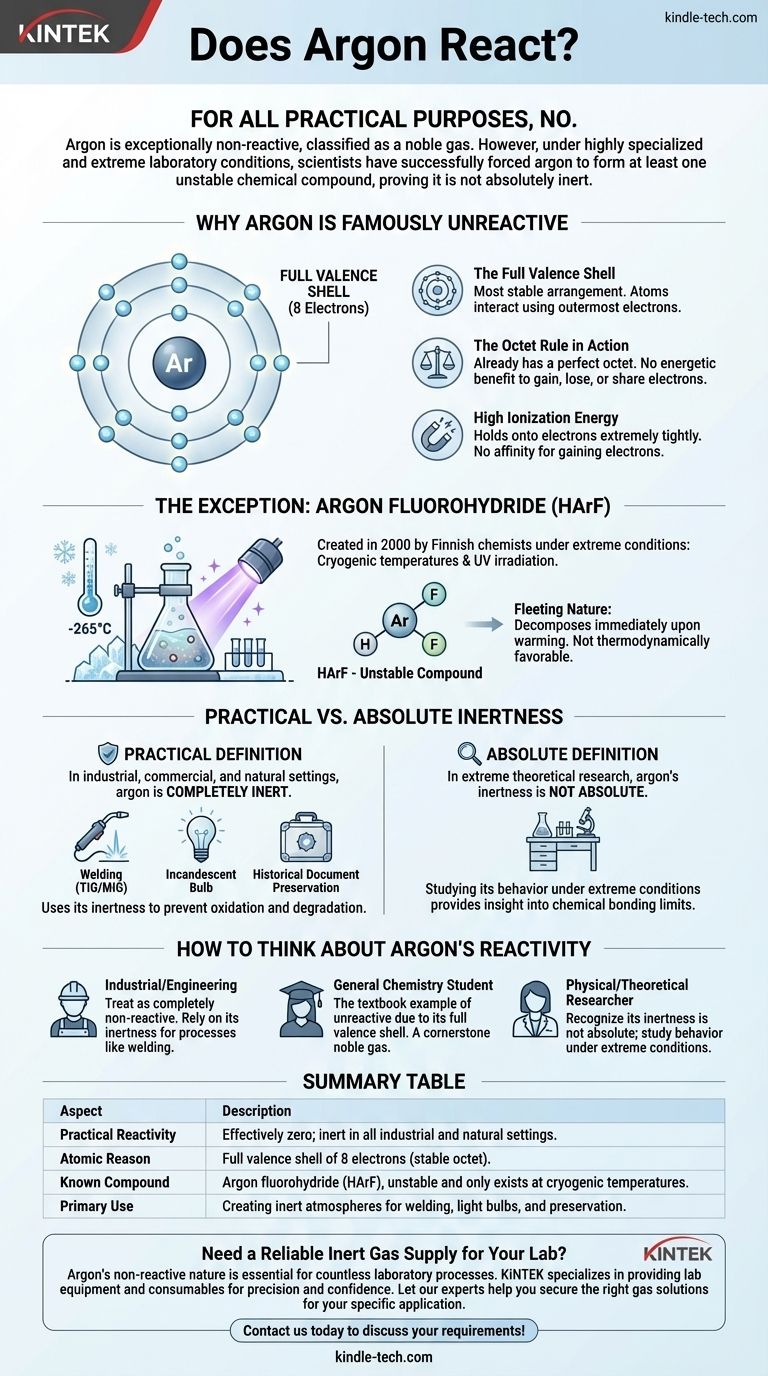
لجميع الأغراض العملية، لا. الأرغون غير تفاعلي بشكل استثنائي، ولهذا السبب يتم تصنيفه كغاز نبيل. ومع ذلك، في ظل ظروف مختبرية متخصصة للغاية ومتطرفة، نجح العلماء في إجبار الأرغون على تكوين مركب كيميائي واحد غير مستقر على الأقل، مما يثبت أنه ليس خاملاً تمامًا.
الخلاصة الأساسية هي أن "تفاعلية" العنصر ليست مسألة بسيطة بنعم أو لا. في حين أن التكوين المثالي لغلاف الإلكترون الخاص بالأرغون يجعله خاملاً في أي سياق طبيعي أو صناعي، يمكن التغلب على عدم تفاعله بقدر كافٍ من الطاقة في ظل ظروف التبريد الشديد، مما يكشف عن التعقيدات الدقيقة للروابط الكيميائية.

لماذا يُعرف الأرغون بأنه "غير تفاعلي"
لفهم سبب مقاومة الأرغون الشديدة لتكوين الروابط الكيميائية، يجب أن ننظر إلى تركيبه الذري. إن سمعته بأنه خامل ليست اعتباطية؛ بل هي نتيجة مباشرة لتكوينه الإلكتروني.
الغلاف التكافؤي الممتلئ
تتفاعل الذرات وتكوّن روابط باستخدام إلكتروناتها الخارجية، والمعروفة باسم الإلكترونات التكافؤية.
يحتوي الأرغون على ثمانية إلكترونات تكافؤية، مما يملأ غلافه الإلكتروني الخارجي بالكامل. هذا هو الترتيب الأكثر استقرارًا الذي يمكن أن تمتلكه الذرة.
"قاعدة الثمانيات" قيد التنفيذ
"قاعدة الثمانيات" هي مبدأ أساسي في الكيمياء ينص على أن الذرات تميل إلى اكتساب أو فقدان أو مشاركة الإلكترونات لتحقيق غلاف خارجي ممتلئ بثمانية إلكترونات.
نظرًا لأن الأرغون يمتلك بالفعل هذه الثمانية المكتملة المثالية، فلا توجد فائدة طاقية له لاكتساب أو فقدان أو مشاركة الإلكترونات مع الذرات الأخرى. إنه بالفعل في حالته المثالية ذات الطاقة المنخفضة.
طاقة التأين العالية
طاقة التأين هي الطاقة المطلوبة لإزالة إلكترون من الذرة. يمتلك الأرغون طاقة تأين عالية جدًا، مما يعني أنه يتمسك بإلكتروناته بقوة شديدة.
وبالمثل، فإنه لا يمتلك ألفة لاكتساب الإلكترونات. ببساطة لا يوجد "دافع" كيميائي للأرغون للدخول في تفاعل في الظروف العادية.
الاستثناء الذي يثبت القاعدة
لعقود من الزمان، كان يُعتقد أن الأرغون خامل تمامًا. تغير هذا في عام 2000 عندما قام فريق من الكيميائيين الفنلنديين بإنشاء أول مركب أرغون حقيقي معروف.
إجبار التفاعل تحت ظروف قصوى
المركب، فلوروهيدريد الأرغون (HArF)، لم يتم إنشاؤه في دورق مختبر عادي.
كان على العلماء تجميد مزيج من الأرغون وفلوريد الهيدروجين على سطح في درجات حرارة تقترب من الصفر المطلق (حوالي -265 درجة مئوية أو -445 درجة فهرنهايت) ثم تعريضه للأشعة فوق البنفسجية القوية. كان هذا الإدخال الهائل للطاقة كافياً لإجبار ذرة الأرغون المترددة على الارتباط مؤقتًا.
الطبيعة العابرة لمركبات الأرغون
مركب HArF الناتج غير مستقر للغاية. وهو يوجد فقط في درجات الحرارة شديدة البرودة هذه.
إذا تم تدفئته قليلاً، فإن الروابط الضعيفة تنكسر، ويتحلل على الفور إلى أرغون وفلوريد هيدروجين منفصلين. ويسلط هذا الضوء على أن المركب ليس مفضلاً من الناحية الديناميكية الحرارية ويوجد فقط لأنه "محاصر" بالبرودة الشديدة.
الخمول العملي مقابل الخمول المطلق
يكشف هذا الاكتشاف أنه يجب علينا التمييز بين مفهومين: ما هو صحيح بالمعنى العملي وما هو صحيح بالمعنى النظري المطلق.
التعريف العملي للخمول
في أي بيئة صناعية أو تجارية أو طبيعية، يكون الأرغون خاملاً تمامًا. فهو لا يتفاعل مع الهواء أو الماء أو المعادن أو أي مادة أخرى يلامسها.
إن هذا الخمول العملي هو ما يجعله ذا قيمة كبيرة.
لماذا هذا مهم للتطبيقات
عدم تفاعل الأرغون هو ميزة، وليس قيدًا. في اللحام (TIG/MIG)، فإنه يخلق "درعًا" خاملًا حول المعدن المنصهر، مما يمنعه من الأكسدة أو التفاعل مع الغازات الموجودة في الهواء، مما يضمن لحامًا نظيفًا وقويًا.
في المصابيح الكهربائية المتوهجة، يمنع جو الأرغون الفتيل التنغستن الساخن من الاحتراق. وفي حفظ الوثائق التاريخية، فإنه يوفر بيئة خالية من الأكسجين لوقف التدهور.
كيف تفكر في تفاعلية الأرغون
يحدد سياقك كيف يجب أن تنظر إلى السلوك الكيميائي للأرغون. يعد فهم هذا التمييز أمرًا أساسيًا لتطبيق المبادئ الكيميائية بشكل صحيح.
- إذا كنت تعمل في بيئة صناعية أو هندسية: تعامل مع الأرغون على أنه غاز غير تفاعلي تمامًا. إن خموله هو أهم خاصية له ويمكن الاعتماد عليه في عمليات مثل اللحام والتصنيع.
- إذا كنت طالبًا في الكيمياء العامة: افهم أن الأرغون هو المثال النموذجي للعنصر غير التفاعلي بسبب غلافه الإلكتروني التكافؤي الممتلئ، مما يجعله حجر الزاوية في مجموعة الغازات النبيلة.
- إذا كنت باحثًا في الكيمياء الفيزيائية أو النظرية: أدرك أن خمول الأرغون ليس مطلقًا، وأن دراسة سلوكه في الظروف القصوى توفر رؤى قيمة حول حدود الترابط الكيميائي.
في نهاية المطاف، فإن عزوف الأرغون الشديد عن التفاعل هو خاصية أساسية تجعله مثيرًا للاهتمام علميًا ومفيدًا للغاية في العالم الحقيقي.
جدول ملخص:
| الجانب | الوصف |
|---|---|
| التفاعلية العملية | صفر فعليًا؛ خامل في جميع البيئات الصناعية والطبيعية. |
| السبب الذري | غلاف تكافؤ ممتلئ بـ 8 إلكترونات (ثمانية مكتملة مستقرة). |
| المركب المعروف | فلوروهيدريد الأرغون (HArF)، غير مستقر ويوجد فقط في درجات حرارة التبريد الشديد. |
| الاستخدام الأساسي | إنشاء أجواء خاملة للحام والمصابيح الكهربائية والحفظ. |
هل تحتاج إلى إمداد موثوق من الغاز الخامل لمختبرك؟
إن الطبيعة غير التفاعلية للأرغون ضرورية لعدد لا يحصى من العمليات المخبرية، بدءًا من إنشاء أجواء خاضعة للرقابة وحتى التعامل مع المواد الحساسة. يعد ضمان حصولك على إمداد ثابت وعالي النقاء أمرًا بالغ الأهمية لنتائجك.
تتخصص KINTEK في توفير المعدات والمواد الاستهلاكية للمختبرات التي تحتاجها للعمل بدقة وثقة. دع خبرائنا يساعدونك في تأمين حلول الغاز المناسبة لتطبيقك المحدد.
اتصل بنا اليوم عبر نموذجنا لمناقشة متطلباتك!
دليل مرئي
المنتجات ذات الصلة
- دائرة تبريد 10 لتر حمام مياه تبريد حمام تفاعل بدرجة حرارة ثابتة منخفضة الحرارة
- مجمع تيار رقائق الألومنيوم لبطارية الليثيوم
- فرن صهر بالحث الفراغي على نطاق المختبر
- مطحنة فائقة الدقة بالاهتزاز مبردة بالماء ومنخفضة الحرارة بشاشة تعمل باللمس
- مصنع قطع تفلون PTFE مخصص لوعاء الطحن
يسأل الناس أيضًا
- لماذا يلزم وجود مبرد مياه دائري لتصنيع جسيمات النانو الزرقاء البروسية؟ ضمان الاستقرار وقابلية تكرار الدُفعات
- لماذا يلزم وجود نظام تبريد بالماء في أجهزة اختبار التآكل تحت الإجهاد في درجات الحرارة العالية؟ استقرار دقة الاختبار.
- ما هو الغرض من استخدام نظام مياه التبريد بعد المعالجة المسبقة لقش القمح؟ تحسين إنتاجية السكر والسلامة
- لأي أنواع من المواد تعتبر أحواض الماء والمبردات حلاً مثالياً؟ العناية الأساسية للعينات الحساسة
- ما هي قاعدة دلتا 20؟ دليل لتشخيص وإتقان قهوة الإسبريسو الخاصة بك














