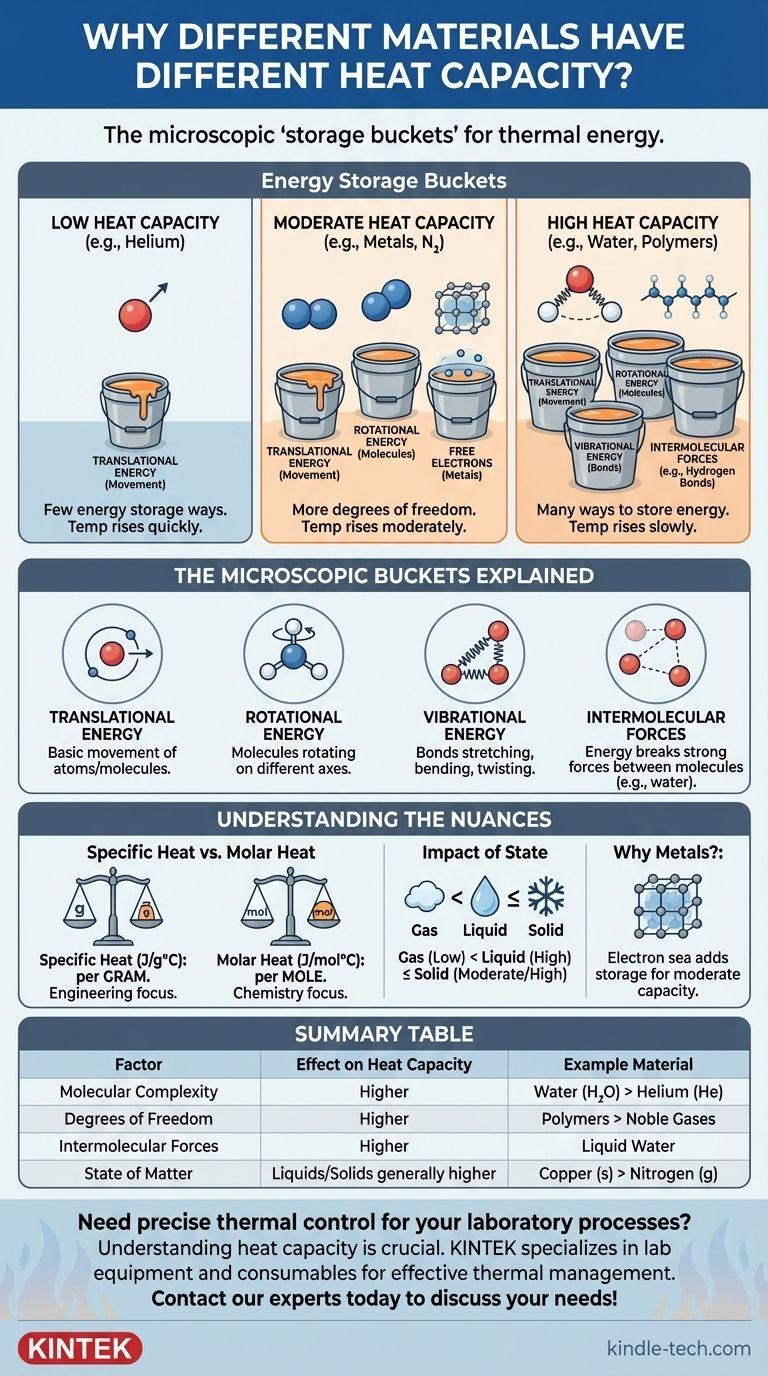
في جوهرها، يتم تحديد السعة الحرارية للمادة من خلال الطرق التي يمكنها من خلالها تخزين الطاقة الحرارية على المستوى المجهري. عندما تضيف الحرارة، فإن تلك الطاقة لا تجعل الذرات تتحرك بشكل أسرع فحسب؛ بل يتم توزيعها في "صناديق تخزين" مختلفة، مثل الدورانات والاهتزازات الجزيئية. المواد ذات الهياكل الأكثر تعقيدًا لديها المزيد من صناديق التخزين هذه، لذا فهي تتطلب المزيد من الطاقة لتحقيق نفس الزيادة في درجة الحرارة.
الخلاصة الرئيسية هي هذه: السعة الحرارية هي مقياس للتعقيد الجزيئي والحرية. المواد ذات الذرات البسيطة (مثل الغازات النبيلة) لديها سعة حرارية منخفضة، في حين أن المواد ذات الجزيئات المعقدة والقوى القوية بين الجزيئية (مثل الماء) لديها سعة حرارية عالية لأن لديها طرقًا أكثر بكثير لامتصاص الطاقة تتجاوز الحركة البسيطة.

ما هي السعة الحرارية، حقًا؟
لفهم الاختلافات بين المواد، يجب علينا أولاً فصل مفاهيم الحرارة ودرجة الحرارة.
درجة الحرارة مقابل الحرارة
درجة الحرارة هي مقياس لـ متوسط الطاقة الحركية للجسيمات في المادة. فكر فيها على أنها متوسط سرعة الذرات أو الجزيئات أثناء حركتها وارتعاشها وذبذبتها.
أما الحرارة، فهي إجمالي الطاقة الحرارية المنقولة إلى المادة أو خارجها. عندما تضيف الحرارة، فإنك تضيف طاقة. وظيفة هذه الطاقة هي رفع إجمالي الطاقة الداخلية للمادة.
تشبيه "تخزين الطاقة"
تخيل أن لديك عدة دلاء فارغة. إضافة الحرارة تشبه صب الماء في تلك الدلاء. درجة الحرارة تشبه مستوى الماء في دلو واحد فقط من تلك الدلاء، الدلو المسمى "الحركة" (الطاقة الحركية).
يتم تحديد السعة الحرارية للمادة من خلال عدد الدلاء الإجمالي الذي تمتلكه. إذا كان للمادة دلو واحد فقط ("الحركة")، فإن كل الماء الذي تصبه يذهب إلى هناك، ويرتفع المستوى بسرعة. إذا كان للمادة العديد من الدلاء، فيجب عليك صب كمية أكبر بكثير من الماء لرفع المستوى في دلو "الحركة" المحدد هذا.
الدلاء المجهرية: أين يتم تخزين الطاقة
تمتلك المواد المختلفة أنواعًا مختلفة من "الدلاء" المجهرية، والتي تسمى رسميًا درجات الحرية. يوفر كل منها طريقة مختلفة لتخزين الطاقة الحرارية.
1. طاقة الانتقال (الدلو الأساسي)
هذه هي طاقة الذرة أو الجزيء الذي ينتقل من مكان إلى آخر. جميع المواد لديها هذا. وهو المساهم الرئيسي فيما نقيسه كدرجة حرارة.
بالنسبة لمادة بسيطة مثل غاز الهيليوم، الذي تتكون ذراته من كرات فردية، فإن هذه هي الطريقة الوحيدة تقريبًا لتخزين الطاقة. وسعته الحرارية منخفضة جدًا.
2. طاقة الدوران (للجزيئات)
لا يمكن للذرة الواحدة أن تدور بشكل هادف لتخزين الطاقة، ولكن يمكن للجزيء أن يفعل ذلك. يمكن لجزيء بسيط مكون من ذرتين مثل النيتروجين (N₂) أن يدور على محورين مختلفين، مثل دوران عصا.
الجزيء غير الخطي الأكثر تعقيدًا مثل الماء (H₂O) يمكن أن يدور على ثلاثة محاور مختلفة. كل محور دوران هو "دلو" إضافي لتخزين الطاقة، مما يزيد من سعته الحرارية.
3. طاقة الاهتزاز (محدد رئيسي)
الروابط التي تربط الذرات معًا في الجزيء ليست قضبانًا صلبة؛ بل هي أقرب إلى النوابض. يمكنها التمدد والانثناء والالتواء. كل من أوضاع الاهتزاز هذه هو دلو طاقة فعال آخر. يحتوي الجزيء ثنائي الذرة البسيط على وضع اهتزاز واحد. الجزيء المعقد ذو الذرات والروابط العديدة لديه العشرات. هذا هو السبب الرئيسي وراء امتلاك المواد المعقدة مثل الزيوت والبوليمرات لسعات حرارية أعلى من الغازات البسيطة.
4. القوى بين الجزيئية (مثال الماء)
في السوائل والمواد الصلبة، يتم استخدام الطاقة أيضًا للعمل ضد القوى بين الجزيئات. الماء هو المثال الأسمى لهذا. جزيئاته مرتبطة بـ روابط هيدروجينية قوية.
قبل أن تتمكن جزيئات الماء من التسارع بشكل كبير (زيادة درجة الحرارة)، يجب أن يذهب جزء كبير من طاقة الحرارة المضافة أولاً إلى هز وكسر هذه الروابط القوية. يعمل هذا كمصرف طاقة هائل، مما يمنح الماء أحد أعلى السعات الحرارية النوعية لأي مادة شائعة.
فهم الفروق الدقيقة
عند مقارنة المواد، فإن السياق أمر بالغ الأهمية. مجرد النظر إلى رقم قد يكون مضللاً دون فهم ما يمثله.
السعة الحرارية النوعية مقابل السعة الحرارية المولية
السعة الحرارية النوعية هي الطاقة المطلوبة لرفع جرام واحد من المادة درجة مئوية واحدة (جول/جم درجة مئوية). هذا مفيد للهندسة والتطبيقات الواقعية حيث الكتلة هي الشاغل الرئيسي.
السعة الحرارية المولية هي الطاقة اللازمة لرفع مول واحد من المادة درجة واحدة (جول/مول درجة مئوية). هذا غالبًا ما يكون أكثر فائدة لعلماء الفيزياء والكيمياء، لأنه يقارن عددًا متساويًا من الجزيئات، مما يوفر مقارنة أكثر عدلاً للتعقيد الجزيئي. على سبيل المثال، السعة الحرارية النوعية للماء تزيد بأكثر من أربعة أضعاف سعة النحاس، لكن سعته الحرارية المولية أكبر بثلاث مرات فقط.
تأثير الحالة (غاز، سائل، صلب)
تتغير السعة الحرارية للمادة حسب حالتها.
- تمتلك الغازات سعات حرارية أقل لأن جزيئاتها متباعدة ولا تتفاعل كثيرًا.
- تمتلك السوائل سعات أعلى بسبب الطاقة اللازمة للتغلب على القوى بين الجزيئية.
- تخزن المواد الصلبة الطاقة في شبكة اهتزازات جماعية (تسمى الفونونات). غالبًا ما تكون سعتها مماثلة لشكلها السائل ولكنها قد تكون أقل في درجات الحرارة شديدة البرودة.
لماذا تمتلك المعادن سعة حرارية معتدلة
قد تتوقع أن يكون للمعادن، كونها ذرات بسيطة، سعة حرارية منخفضة. سعتها معتدلة بسبب تركيبها الفريد: شبكة صلبة من الأيونات داخل "بحر" من الإلكترونات المتحركة بحرية. يمكن لبحر الإلكترونات هذا أيضًا امتصاص الطاقة الحرارية، ليعمل كدلو تخزين طاقة إضافي تفتقر إليه الغازات الذرية البسيطة.
اتخاذ الخيار الصحيح لهدفك
كيفية تفسيرك لبيانات السعة الحرارية تعتمد كليًا على هدفك.
- إذا كان تركيزك الأساسي هو الهندسة أو الإدارة الحرارية: استخدم السعة الحرارية النوعية (لكل جرام)، لأنها تخبرك مباشرة بمقدار ارتفاع درجة حرارة كتلة معينة من المادة في تصميم واقعي.
- إذا كان تركيزك الأساسي هو الكيمياء أو الفيزياء الأساسية: قارن السعة الحرارية المولية (لكل مول) لعزل تأثيرات البنية الجزيئية، ودرجات الحرية، والترابط على تخزين الطاقة.
- إذا كان تركيزك الأساسي هو علوم المناخ أو البيولوجيا: أدرك أن السعة الحرارية النوعية العالية بشكل استثنائي للماء، مدفوعة بالروابط الهيدروجينية، هي العامل الأكثر أهمية في تثبيت مناخ الأرض وتنظيم درجة حرارة الجسم في الكائنات الحية.
في نهاية المطاف، فإن السعة الحرارية للمادة هي البصمة الكلية لعالمها المجهري.
جدول ملخص:
| العامل | التأثير على السعة الحرارية | المادة المثال |
|---|---|---|
| التعقيد الجزيئي | جزيئات أكثر تعقيدًا = سعة أعلى | الماء (H₂O) مقابل الهيليوم (He) |
| درجات الحرية | المزيد من الطرق لتخزين الطاقة (الدوران، الاهتزاز) = سعة أعلى | البوليمرات مقابل الغازات النبيلة |
| القوى بين الجزيئية | قوى أقوى (مثل الروابط الهيدروجينية) = سعة أعلى | الماء السائل |
| حالة المادة | السوائل/المواد الصلبة أعلى بشكل عام من الغازات | النحاس (صلب) مقابل النيتروجين (غاز) |
| الإلكترونات الحرة | بحر الإلكترونات في المعادن يضيف سعة معتدلة | معادن مثل الألومنيوم |
هل تحتاج إلى تحكم حراري دقيق لعمليات المختبر الخاصة بك؟ يعد فهم السعة الحرارية أمرًا بالغ الأهمية للتطبيقات مثل التخليق الكيميائي واختبار المواد والتحليل الحراري. تتخصص KINTEK في معدات المختبرات والمواد الاستهلاكية، حيث توفر الأدوات التي تحتاجها لإدارة الطاقة الحرارية بفعالية. سواء كنت بحاجة إلى أفران أو سخانات أو أنظمة مراقبة لدرجة الحرارة، فإن حلولنا مصممة للدقة والموثوقية. اتصل بخبرائنا اليوم لمناقشة كيف يمكننا دعم احتياجات مختبرك المحددة وتعزيز نتائج أبحاثك.
دليل مرئي
المنتجات ذات الصلة
- ألواح سيراميك مخصصة من الألومينا والزركونيا بأشكال خاصة لمعالجة السيراميك الدقيق المتقدم
- مشتت حراري مسطح مضلع من سيراميك كربيد السيليكون (SIC) للسيراميك الدقيق المتقدم الهندسي
- ألواح معدنية عالية النقاء من الذهب والبلاتين والنحاس والحديد
- بوتقة جرافيت نقية عالية النقاء للتبخير
- رغوة النحاس
يسأل الناس أيضًا
- ما هي معلمات عملية الترسيب بالرش المغناطيسي؟ المتغيرات الرئيسية لإعداد أغشية رقيقة فائقة الجودة
- هل يمكن إعادة استخدام مسحوق SLS؟ نعم، مع استراتيجية معدل التحديث الصحيحة.
- هل يمكن أن تتشكل أنابيب الكربون النانوية بشكل طبيعي؟ نعم، وإليك الأماكن التي تصنعها فيها الطبيعة.
- ما هي 3 مزايا للكتلة الحيوية؟ إطلاق العنان للطاقة المتجددة والموثوقة وتقليل النفايات
- ما هي المواد الأولية لإنتاج الفحم الحيوي؟ اختر المادة المناسبة لتطبيقك
- ما هي عملية التذرية في الفراغ؟ دليل لترسيب الأغشية الرقيقة عالية النقاء
- ما الذي يستخدم للمعالجة الحرارية للصلب؟ أتقن الأدوات للتحكم الدقيق في علم المعادن
- لماذا يجب أن يمر غاز المنتج عبر مكثف وأنبوب تجفيف؟ ضمان دقة MicroGC وحمايته













