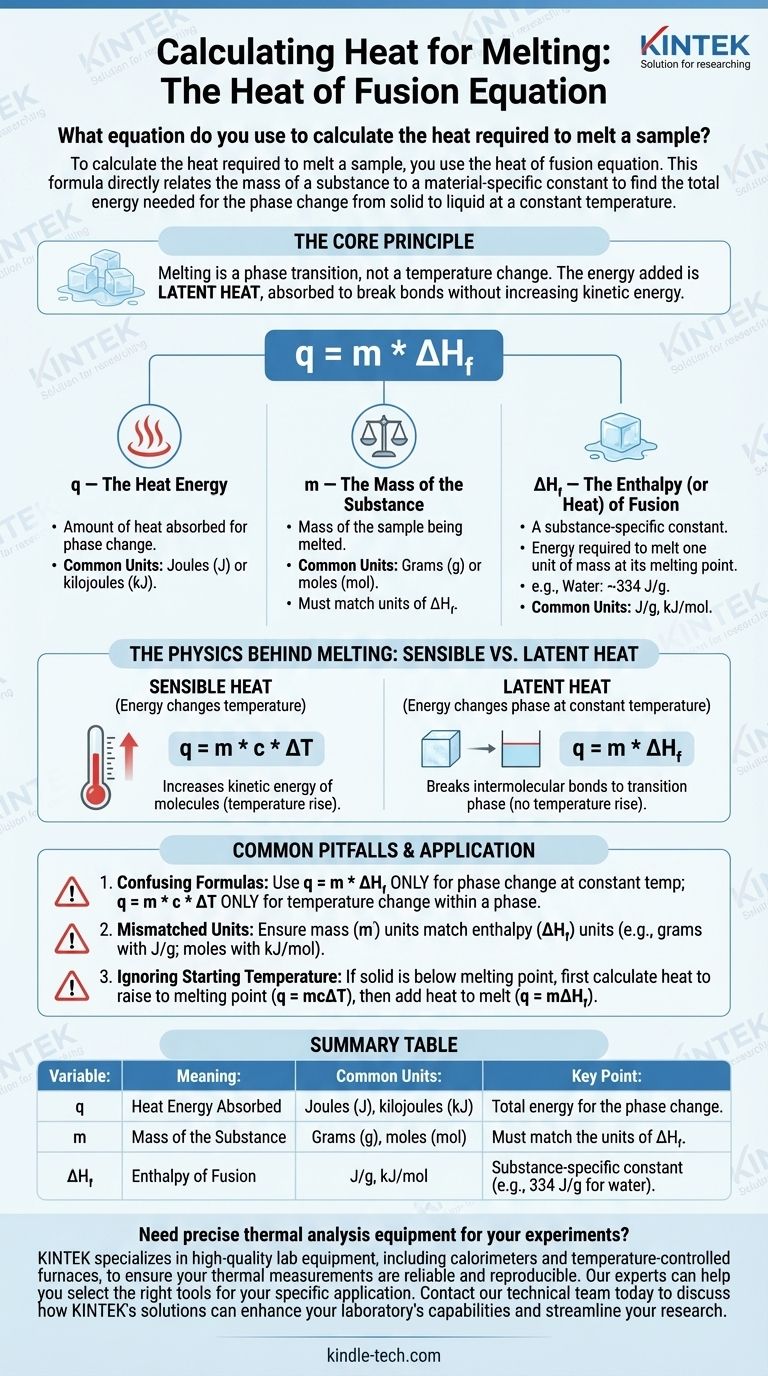
لحساب الحرارة اللازمة لإذابة عينة، تستخدم معادلة حرارة الانصهار. تربط هذه الصيغة مباشرة كتلة المادة بثابت خاص بالمادة لإيجاد إجمالي الطاقة اللازمة لتغير الحالة من صلب إلى سائل عند درجة حرارة ثابتة.
المبدأ الأساسي هو أن الانصهار هو انتقال طور، وليس تغيرًا في درجة الحرارة. تسمى الطاقة التي تضيفها بالحرارة الكامنة، والتي يتم امتصاصها لكسر روابط الهيكل الصلب دون زيادة الطاقة الحركية للجزيئات.

تفكيك معادلة حرارة الانصهار
صيغة حساب الحرارة الممتصة أثناء الانصهار هي:
q = m * ΔH_f
يمثل كل متغير في هذه المعادلة جزءًا حيويًا من العملية الفيزيائية. فهمها بشكل فردي هو مفتاح تطبيق الصيغة بشكل صحيح.
q — الطاقة الحرارية
يمثل q كمية الحرارة التي تمتصها المادة لتحدث تغير الطور. يتم التعبير عن هذه القيمة عادةً بـ الجول (J) أو الكيلوجول (kJ)، على الرغم من أن السياقات القديمة قد تستخدم السعرات الحرارية (cal).
m — كتلة المادة
m هي كتلة العينة التي تقوم بإذابتها. من الأهمية بمكان أن تتطابق وحدات الكتلة، عادةً الجرام (g) أو المولات (mol)، مع الوحدات المستخدمة في ثابت حرارة الانصهار لتلك المادة.
ΔH_f — إنثالبي (أو حرارة) الانصهار
ΔH_f هو المتغير الأكثر أهمية. إنه إنثالبي الانصهار، والذي يسمى غالبًا الحرارة الكامنة للانصهار.
هذا ثابت فيزيائي فريد لكل مادة. يحدد كمية الطاقة المطلوبة لإذابة وحدة واحدة من كتلة (مثل 1 جرام أو 1 مول) من تلك المادة عند نقطة انصهارها.
على سبيل المثال، حرارة انصهار الماء تبلغ تقريبًا 334 جول لكل جرام (J/g). هذا يعني أنه يجب عليك إضافة 334 جول من الطاقة لإذابة 1 جرام من الثلج عند 0 درجة مئوية إلى 1 جرام من الماء السائل عند 0 درجة مئوية.
الفيزياء وراء الانصهار: الحرارة المحسوسة مقابل الحرارة الكامنة
نقطة الالتباس الشائعة هي لماذا لا ترتفع درجة الحرارة أثناء الانصهار. يوضح ذلك الفرق بين نوعين من الطاقة الحرارية.
الحرارة المحسوسة
الحرارة المحسوسة هي الطاقة التي تغير درجة حرارة المادة. عندما تضيف حرارة محسوسة، فإنك تزيد من الطاقة الحركية للجزيئات، مما يجعلها تتحرك بشكل أسرع، وهو ما نقيسه كزيادة في درجة الحرارة. صيغة ذلك هي q = m * c * ΔT.
الحرارة الكامنة
الحرارة الكامنة هي الطاقة الممتصة أو المنبعثة أثناء تغير الطور عند درجة حرارة ثابتة. أثناء الانصهار، تُستخدم الطاقة الواردة بالكامل لكسر الروابط الجزيئية التي تربط الشبكة البلورية للصلب معًا، وتحويلها إلى سائل.
ولأن الطاقة "مخفية" في تغير الطور بدلاً من التسبب في ارتفاع درجة الحرارة، فإنها تسمى كامنة.
الأخطاء الشائعة التي يجب تجنبها
يعد تطبيق المفهوم أو الصيغة الخاطئة مصدرًا متكررًا للخطأ في الحسابات الديناميكية الحرارية. كن على دراية بهذه الأخطاء الشائعة.
الخلط بين حرارة الانصهار والحرارة النوعية
الخطأ الأكثر شيوعًا هو استخدام الصيغة الخاطئة.
- استخدم
q = m * ΔH_f(حرارة الانصهار) فقط لتغير الطور عند درجة حرارة ثابتة (مثل إذابة الجليد عند 0 درجة مئوية). - استخدم
q = m * c * ΔT(الحرارة النوعية) فقط لتغيير درجة حرارة مادة ضمن طور واحد (مثل تسخين الجليد الصلب من -10 درجة مئوية إلى 0 درجة مئوية).
الوحدات غير المتطابقة
تحقق دائمًا من وحداتك. إذا كانت كتلتك (m) بالجرام، فيجب أن تكون حرارة الانصهار (ΔH_f) بالجول لكل جرام (J/g). إذا تم إعطاء ΔH_f بالكيلوجول لكل مول (kJ/mol)، فيجب عليك أولاً تحويل كتلة عينتك إلى مولات.
تجاهل درجة الحرارة الأولية
تنطبق معادلة حرارة الانصهار فقط إذا كانت المادة بالفعل عند نقطة انصهارها. إذا كان لديك مادة صلبة أقل من نقطة انصهارها، فيجب عليك إجراء حساب من خطوتين:
- احسب الحرارة اللازمة لرفع المادة الصلبة إلى نقطة انصهارها (
q = mcΔT). - احسب الحرارة اللازمة لإذابة المادة الصلبة عند نقطة انصهارها (
q = mΔH_f). - اجمع النتائج للحصول على إجمالي الحرارة المطلوبة.
تطبيق الصيغة الصحيحة لحساباتك
لضمان حل مشكلتك بشكل صحيح، حدد العملية الدقيقة التي تحتاج إلى حسابها.
- إذا كان تركيزك الأساسي هو إذابة مادة موجودة بالفعل عند نقطة انصهارها: فأنت تحتاج فقط إلى معادلة حرارة الانصهار:
q = m * ΔH_f. - إذا كان تركيزك الأساسي هو تسخين مادة دون تغيير طورها: فأنت تحتاج فقط إلى معادلة السعة الحرارية النوعية:
q = m * c * ΔT. - إذا كان تركيزك الأساسي هو تسخين مادة صلبة ثم إذابتها بالكامل: يجب عليك حساب الحرارة لكل خطوة على حدة وجمعها معًا:
q_total = (m * c * ΔT)_تسخين + (m * ΔH_f)_انصهار.
فهم العملية الفيزيائية التي تقوم بنمذجتها هو المفتاح لاختيار المعادلة الصحيحة.
جدول الملخص:
| المتغير | المعنى | الوحدات الشائعة | نقطة رئيسية |
|---|---|---|---|
| q | الطاقة الحرارية الممتصة | جول (J)، كيلوجول (kJ) | إجمالي الطاقة لتغير الطور |
| m | كتلة المادة | جرام (g)، مول (mol) | يجب أن تتطابق مع وحدات ΔH_f |
| ΔH_f | إنثالبي الانصهار | J/g، kJ/mol | ثابت خاص بالمادة (مثل 334 J/g للماء) |
هل تحتاج إلى معدات تحليل حراري دقيقة لتجاربك؟
يعد الحساب الدقيق لمتطلبات الحرارة أمرًا أساسيًا في علم المواد والكيمياء والصيدلة. تتخصص KINTEK في معدات المختبرات عالية الجودة، بما في ذلك أجهزة قياس السعرات الحرارية والأفران ذات التحكم في درجة الحرارة، لضمان أن تكون قياساتك الحرارية موثوقة وقابلة للتكرار.
يمكن لخبرائنا مساعدتك في اختيار الأدوات المناسبة لتطبيقك المحدد، سواء كنت تدرس تغيرات الطور، أو تخليق المواد، أو حركية التفاعل.
اتصل بفريقنا الفني اليوم لمناقشة كيف يمكن لحلول KINTEK أن تعزز قدرات مختبرك وتبسط أبحاثك.
دليل مرئي
المنتجات ذات الصلة
- آلة مكبس هيدروليكي مسخن مع ألواح تسخين يدوية مدمجة للاستخدام في المختبر
- آلة الضغط الهيدروليكي المسخنة 24T 30T 60T مع ألواح مسخنة للضغط الساخن المخبري
- قالب التسخين الكهربائي الأسطواني للمختبر للتطبيقات المعملية
- آلة الضغط الهيدروليكي الأوتوماتيكية المسخنة بألواح مسخنة للمختبر الصحافة الساخنة 25 طن 30 طن 50 طن
- قالب مكبس الأشعة تحت الحمراء للمختبر
يسأل الناس أيضًا
- ما هي الصيانة الوقائية لمعدات المختبرات؟ استراتيجية استباقية لسلامة البيانات وسلامة الموظفين
- ما هو العنصر الذي جعل لحام الفولاذ المقاوم للصدأ صعبًا؟ إنها طبقة أكسيد الكروم
- ما هي الآثار البيئية لتصنيع المعادن؟ دليل الاستدامة والحلول
- ما هي الوظيفة التي يؤديها شاكر درجة الحرارة الثابتة أثناء اختبارات أداء الامتزاز؟ ضمان دقة البيانات
- ما هو نطاق الضغط للرش بالترسيب (Sputtering)؟ حسّن عملية ترسيب الأغشية الرقيقة الخاصة بك
- ما هو الغرض من المعالجة الحرارية بعد الترسيب عند 700 درجة مئوية لطلاءات الألومنيوم؟ تعزيز مقاومة الأكسدة
- لماذا تعتبر صناديق القفازات اللاهوائية وأنظمة تطهير النيتروجين ضرورية لتجارب بكتيريا اختزال الكبريتات؟ ضمان الاستبعاد الأمثل للأكسجين
- ما هو السماكة المثالية للطلاء؟ تحقيق التوازن المثالي بين الأداء والتكلفة


























