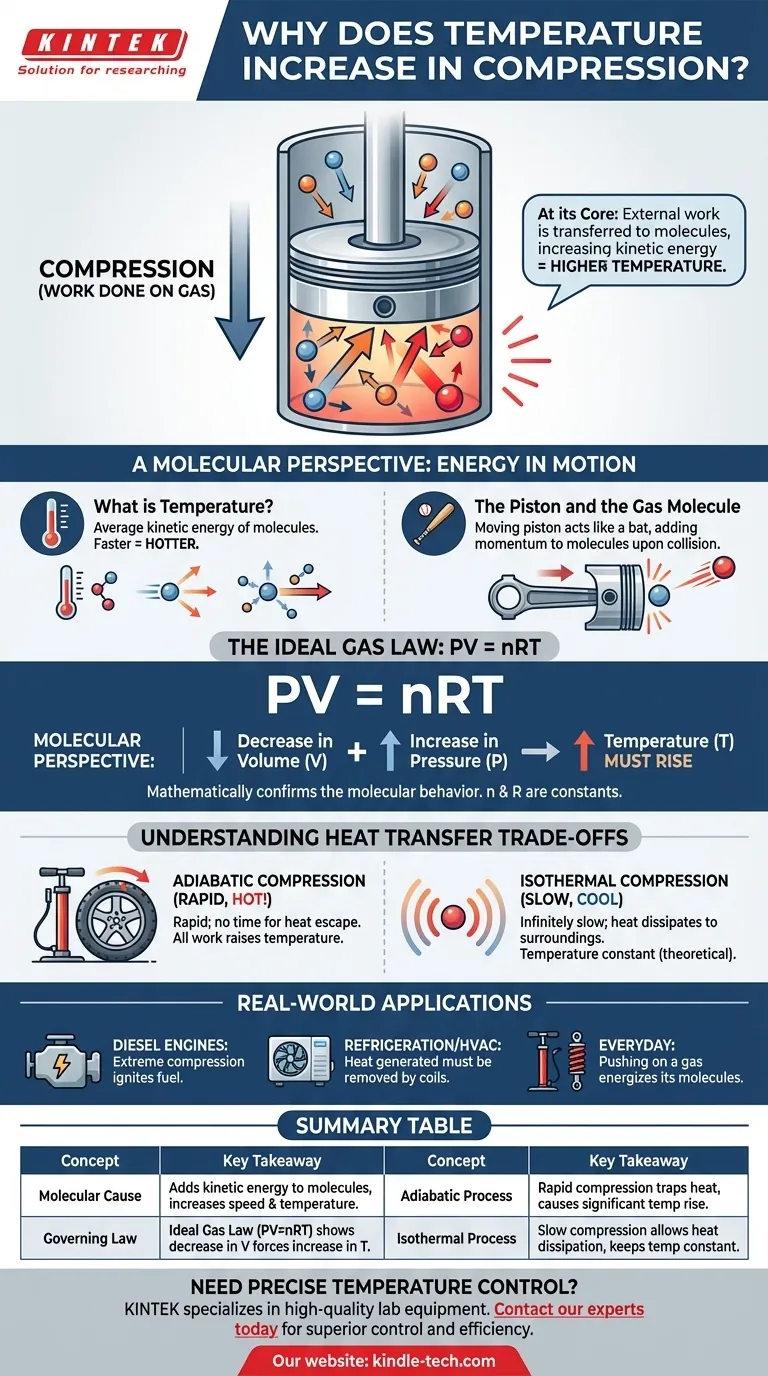
في جوهره، يؤدي ضغط الغاز إلى زيادة درجة حرارته لأنك تقوم ببذل شغل عليه. ينتقل هذا الشغل الخارجي مباشرة إلى جزيئات الغاز، مما يزيد من طاقتها الحركية. نقيس هذه الزيادة في متوسط الطاقة الحركية للجزيئات كارتفاع في درجة الحرارة.
إن عملية الضغط ليست مجرد تقليل للحجم؛ بل هي حقن للطاقة. فالقوة التي تطبقها لضغط الغاز تضيف طاقة إلى جزيئاته، مما يجعلها تتحرك بشكل أسرع، وهو ما ندركه كحرارة.

منظور جزيئي: الطاقة في الحركة
لفهم التسخين بالضغط حقًا، يجب أن نفكر فيما يحدث على مستوى الجزيئات الفردية. درجة حرارة الغاز هي ببساطة مقياس لمتوسط حركة جزيئاته التي لا تعد ولا تحصى.
ما هي درجة الحرارة، حقًا؟
درجة الحرارة هي قياس عياني لمتوسط الطاقة الحركية للجزيئات في نظام ما. تمتلك الجزيئات الأسرع حركة طاقة حركية أكبر، مما يؤدي إلى ارتفاع درجة الحرارة. أما الجزيئات الأبطأ حركة فتعني درجة حرارة أقل.
عملية الضغط
تخيل غازًا محتويًا داخل أسطوانة بها مكبس متحرك. لضغط الغاز، يجب عليك دفع المكبس للداخل ماديًا، مطبقًا قوة على مسافة. هذا الإجراء هو التعريف العلمي للشغل.
المكبس وجزيء الغاز
فكر في المكبس المتحرك كمضرب وجزيء الغاز ككرة. عندما يصطدم جزيء بمكبس ثابت، فإنه يرتد بنفس السرعة. ومع ذلك، عندما يصطدم بمكبس يتحرك للداخل، يضيف المكبس زخمًا وطاقة إلى الجزيء، مما يجعله يرتد بسرعة أكبر.
التأثير التراكمي
يحدث هذا الانتقال للطاقة مليارات المرات في الثانية مع جميع الجزيئات التي تصطدم بسطح المكبس. كل تصادم يضيف قدرًا ضئيلًا من الطاقة. والنتيجة التراكمية هي زيادة كبيرة في متوسط السرعة – وبالتالي متوسط الطاقة الحركية – لجميع الجزيئات، مما يتسبب في ارتفاع درجة حرارة الغاز.
دور قانون الغاز المثالي
يتم وصف هذا السلوك الجزيئي رياضيًا بواسطة قوانين فيزيائية أساسية، وأبسطها هو قانون الغاز المثالي. يوفر هذا القانون تأكيدًا عالي المستوى لما نراه على المستوى الجزيئي.
المعادلة الحاكمة: PV = nRT
يربط قانون الغاز المثالي الضغط (P) والحجم (V) ودرجة الحرارة (T) لكمية معينة من الغاز (n). يمثل الحرف "R" ثابتًا. توضح هذه المعادلة أن هذه الخصائص مرتبطة بشكل جوهري.
كيف يتنبأ القانون بالنتيجة
عندما تضغط غازًا، فإنك تقلل حجمه (V). كما أن القوة التي تطبقها تزيد من ضغطه (P). لكي تظل المعادلة PV = nRT متوازنة، يجب أن يقابل الزيادة في الجانب الأيسر من المعادلة (من الجمع بين زيادة P ونقصان V) زيادة في الجانب الأيمن. وبما أن n و R ثابتان، يجب أن ترتفع درجة الحرارة (T).
فهم المقايضات: انتقال الحرارة
يغير معدل الضغط النتيجة بشكل كبير لأنه يحدد مقدار الوقت المتاح للنظام للتفاعل مع محيطه.
الانضغاط الأديباتي (لا يوجد تسرب للحرارة)
يحدث هذا عندما يكون الضغط سريعًا جدًا بحيث لا يوجد وقت للحرارة المتولدة للهروب إلى البيئة المحيطة. يتم تحويل كل الشغل الذي تقوم به مباشرة إلى رفع الطاقة الداخلية ودرجة حرارة الغاز. يعتبر نفخ إطار دراجة مثالاً واقعيًا قريبًا؛ حيث يصبح المضخة ساخنة بشكل ملحوظ.
الانضغاط الأيزوثرمي (هروب مثالي للحرارة)
هذا هو مثال نظري مثالي يحدث عندما يتم الضغط ببطء شديد. يسمح هذا المعدل البطيء بتبديد كل الحرارة الإضافية المتولدة عن الشغل إلى البيئة المحيطة، مما يحافظ على درجة حرارة الغاز ثابتة. على الرغم من أنه لا يمكن تحقيقه عمليًا، إلا أنه مفهوم حاسم للتحليل الديناميكي الحراري.
السيناريو الواقعي
تقع جميع العمليات الواقعية تقريبًا بين هذين النقيضين. فبعض الشغل المبذول يزيد من درجة الحرارة الداخلية، بينما يتم فقدان بعض الحرارة المتولدة إلى البيئة.
كيفية تطبيق هذا المبدأ
فهم التسخين بالضغط ليس مجرد أمر أكاديمي؛ بل هو أساسي لعدد لا يحصى من التطبيقات والأنظمة في العالم الحقيقي.
- إذا كان تركيزك الأساسي على الظواهر اليومية: تذكر أن دفع الغاز (بذل الشغل) ينشط جزيئاته، وهذا هو السبب في أن مضخة الدراجة أو ممتص الصدمات يصبح ساخنًا.
- إذا كان تركيزك الأساسي على تصميم المحركات: هذا المبدأ هو الأساس ذاته لمحرك الديزل، الذي يستخدم الضغط الشديد لتسخين الهواء بما يكفي لإشعال الوقود بدون شمعة احتراق.
- إذا كان تركيزك الأساسي على التبريد أو أنظمة التدفئة والتهوية وتكييف الهواء (HVAC): الحرارة المتولدة أثناء مرحلة ضغط المبرد هي الحرارة المهدرة التي يجب إزالتها بنشاط بواسطة ملفات المكثف الموجودة في الجزء الخلفي من ثلاجتك أو في وحدة تكييف الهواء الخارجية.
في النهاية، الرابط بين الشغل الميكانيكي والطاقة الحرارية هو قانون أساسي للفيزياء، يحول القوة إلى حرارة على المستوى الجزيئي.
جدول الملخص:
| المفهوم | الخلاصة الرئيسية |
|---|---|
| السبب الجزيئي | يضيف الضغط طاقة حركية لجزيئات الغاز، مما يزيد من سرعتها ودرجة حرارتها. |
| القانون الحاكم | يوضح قانون الغاز المثالي (PV=nRT) رياضيًا أن انخفاض الحجم (V) يفرض زيادة في درجة الحرارة (T). |
| العملية الأديباتية | الضغط السريع (مثل مضخة الدراجة) يحبس الحرارة، مما يسبب ارتفاعًا كبيرًا في درجة الحرارة. |
| العملية الأيزوثرمية | الضغط البطيء والنظري يسمح بتبديد الحرارة، مما يحافظ على درجة الحرارة ثابتة. |
| التأثير الواقعي | أساسي لمحركات الديزل ودورات التبريد وأنظمة التدفئة والتهوية وتكييف الهواء (HVAC). |
هل تحتاج إلى تحكم دقيق في درجة الحرارة لعملياتك؟ مبادئ الديناميكا الحرارية حاسمة للبحث والتطوير والتطبيقات الصناعية. تتخصص KINTEK في توفير معدات ومواد استهلاكية عالية الجودة للمختبرات، وتلبي الاحتياجات الدقيقة للمختبرات. سواء كنت تقوم بتطوير مواد جديدة أو تحسين الأنظمة الحرارية، يمكن لخبرتنا دعم عملك. اتصل بخبرائنا اليوم لمناقشة كيف يمكننا مساعدتك في تحقيق تحكم وكفاءة فائقين في مختبرك.
دليل مرئي
المنتجات ذات الصلة
- محطة عمل الضغط المتساوي الحراري الرطب WIP 300 ميجا باسكال للتطبيقات عالية الضغط
- قالب تسخين مزدوج الألواح للمختبر
- قالب ضغط مضاد للتشقق للاستخدام المخبري
- آلة ضغط الأقراص باللكمة الواحدة وآلة ثقب الأقراص الدوارة للإنتاج الضخم لـ TDP
- آلة ضغط الأقراص الكهربائية ذات اللكمة الواحدة، مختبر، مسحوق، لكمة الأقراص، آلة ضغط الأقراص TDP
يسأل الناس أيضًا
- ما هي عملية المواد HIP؟ تحقيق كثافة وموثوقية شبه مثالية
- ما هو مبدأ الضغط المتوازن الساخن؟ تحقيق كثافة 100% وأداء فائق
- هل الضغط المتوازن الساخن (HIP) هو معالجة حرارية؟ دليل لعمليته الحرارية الميكانيكية الفريدة
- ما هو معالجة HIP للمعادن؟ القضاء على العيوب الداخلية لأداء فائق للأجزاء
- ما هي بعض الخصائص الجذابة للمنتجات المعالجة بالكبس المتساوي الحرارة الساخن؟ تحقيق كثافة مثالية وأداء فائق



















