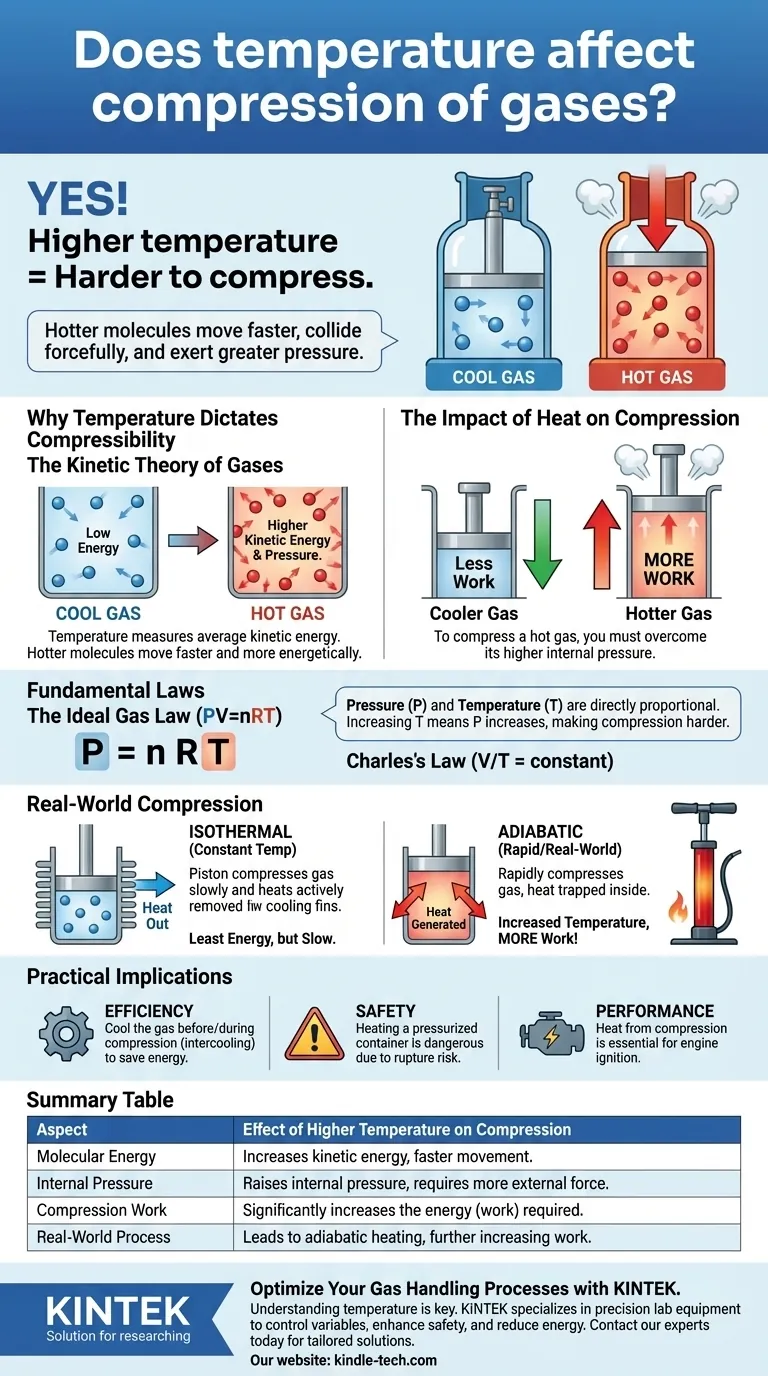
نعم، لدرجة الحرارة تأثير مباشر وحاسم على ضغط الغازات. يكون الغاز عند درجة حرارة أعلى أصعب بكثير في الضغط من نفس الغاز عند درجة حرارة أقل. وذلك لأن درجة الحرارة هي مقياس للطاقة الحركية لجزيئات الغاز؛ فالجزيئات الأكثر سخونة تتحرك بشكل أسرع، وتتصادم بقوة أكبر مع جدران حاويتها، وبالتالي تمارس ضغطًا أكبر يجب التغلب عليه.
المبدأ الأساسي هو أن ضغط الغاز يتطلب بذل شغل للتغلب على الضغط الذي تمارسه جزيئاته. وبما أن الغاز الأكثر سخونة يمارس ضغطًا أكبر عند حجم معين، فإنه يتطلب شغلًا أكبر لضغطه.

لماذا تحدد درجة الحرارة قابلية الضغط
لفهم العلاقة بين درجة الحرارة والضغط، يجب أن ننظر إلى سلوك جزيئات الغاز. وهذا ما تفسره النظرية الحركية للغازات.
النظرية الحركية للغازات
درجة الحرارة هي قياس عياني لمتوسط الطاقة الحركية للجزيئات في مادة ما. درجات الحرارة الأعلى تعني أن جزيئات الغاز الفردية تتحرك بشكل أسرع وأكثر نشاطًا.
الغاز البارد يحتوي على جزيئات ذات طاقة حركية متوسطة أقل، مما يعني أنها تتحرك بشكل أبطأ. الغاز الساخن يحتوي على جزيئات ذات طاقة حركية متوسطة أعلى، مما يجعلها تتحرك بشكل أسرع بكثير.
الضغط نتيجة للتصادمات الجزيئية
الضغط الذي يمارسه الغاز هو نتيجة تصادم عدد لا يحصى من الجزيئات مع جدران حاويتها. كل تصادم يمنح كمية صغيرة من القوة.
عندما تكون الجزيئات أكثر سخونة وتتحرك بشكل أسرع، فإنها تصطدم بجدران الحاوية بشكل متكرر وبقوة أكبر، مما يؤدي إلى ضغط أعلى.
تأثير الحرارة على الضغط
ضغط الغاز يعني دفع جزيئاته إلى حجم أصغر. للقيام بذلك، يجب عليك تطبيق ضغط خارجي أكبر من الضغط الداخلي للغاز.
نظرًا لأن الغاز الساخن يمارس بشكل طبيعي ضغطًا داخليًا أعلى، يجب عليك تطبيق قوة خارجية أكبر بكثير لضغطه إلى نفس حجم الغاز البارد.
القوانين الأساسية المؤثرة
هذه العلاقة ليست نظرية فحسب؛ بل يتم وصفها بدقة بواسطة قوانين الغاز الأساسية التي تشكل أساس الديناميكا الحرارية.
قانون الغاز المثالي (PV=nRT)
قانون الغاز المثالي هو المعادلة الموحدة: الضغط (P) × الحجم (V) = عدد مولات الغاز (n) × ثابت الغاز (R) × درجة الحرارة (T).
توضح هذه المعادلة أن الضغط ودرجة الحرارة متناسبان طرديًا. إذا حافظت على الحجم ثابتًا وزدت درجة الحرارة (T)، يجب أن يزداد الضغط (P) أيضًا. وهذا يؤكد سبب صعوبة ضغط الغاز الأكثر سخونة – فهو يبدأ بضغط أعلى أو يتراكم إلى ضغط أعلى.
قانون شارل (V/T = ثابت)
ينص قانون شارل على أنه لكمية ثابتة من الغاز عند ضغط ثابت، يتناسب الحجم طرديًا مع درجة حرارته المطلقة.
بينما يصف هذا التمدد عند التسخين، فإن عكسه صحيح بنفس القدر للضغط. للحفاظ على ضغط ثابت مع تقليل الحجم، سيتعين عليك تقليل درجة الحرارة بشكل متناسب.
الواقع العملي والمقايضات الرئيسية
في تطبيقات العالم الحقيقي، تؤدي عملية الضغط نفسها إلى تعقيد حاسم: الحرارة.
الحالة المثالية: الضغط متساوي الحرارة
يفترض الضغط متساوي الحرارة أن درجة حرارة الغاز تظل ثابتة تمامًا طوال العملية.
لتحقيق ذلك، ستحتاج إلى إزالة الحرارة الناتجة عن عملية الضغط بشكل فعال ومستمر. تتطلب هذه العملية أقل قدر من الطاقة (الشغل) ولكنها غالبًا ما تكون بطيئة وغير عملية.
الحالة الواقعية: الضغط الكظْمي
في جميع سيناريوهات الضغط السريع تقريبًا، مثل أسطوانة المحرك أو مضخة الدراجة، تكون العملية أقرب إلى الكظْمي. وهذا يعني عدم السماح للحرارة بالهروب من النظام.
جميع الطاقة التي تضعها في ضغط الغاز تزيد من طاقته الداخلية، مما يتسبب في ارتفاع سريع وملحوظ في درجة الحرارة. هذا هو السبب في أن مضخة الإطارات تسخن أثناء الاستخدام.
النتيجة: زيادة الشغل المطلوب
يعمل هذا التسخين الكظْمي ضدك. عندما تضغط الغاز، ترتفع درجة حرارته، مما يزيد بدوره من ضغطه الداخلي أكثر.
أنت الآن تقاوم قوة معارضة متزايدة باستمرار. هذا هو السبب في أن الضغط في العالم الحقيقي يتطلب دائمًا شغلًا أكبر من المثالي النظري ذي درجة الحرارة الثابتة. تُستخدم الضواغط متعددة المراحل مع المبردات البينية في الصناعة خصيصًا لمكافحة هذا التأثير.
اتخاذ القرار الصحيح لهدفك
فهم هذه العلاقة أمر بالغ الأهمية للكفاءة والسلامة والأداء في أي نظام يتضمن غازات مضغوطة.
- إذا كان تركيزك الأساسي هو الكفاءة الصناعية: فإن تبريد الغاز قبل وأثناء الضغط (عملية تُعرف بالتبريد البيني) سيقلل بشكل كبير من الطاقة المطلوبة لضغطه.
- إذا كان تركيزك الأساسي هو السلامة: أدرك أن تسخين حاوية محكمة الغلق ومضغوطة أمر خطير للغاية لأن الضغط الداخلي سيرتفع بشكل متناسب مع درجة الحرارة، مما يخلق خطر التمزق.
- إذا كان تركيزك الأساسي هو أداء المحرك: الحرارة المتولدة أثناء شوط الضغط في محرك الاحتراق الداخلي ضرورية لإشعال خليط الوقود والهواء، وتحويل تلك الطاقة الحرارية إلى شغل ميكانيكي.
في النهاية، درجة الحرارة ليست متغيرًا سلبيًا بل مشاركًا نشطًا في عمل ضغط الغاز.
جدول الملخص:
| الجانب | تأثير ارتفاع درجة الحرارة على الضغط |
|---|---|
| الطاقة الجزيئية | يزيد من الطاقة الحركية، مما يجعل الجزيئات تتحرك بشكل أسرع. |
| الضغط الداخلي | يرفع الضغط الداخلي للغاز، مما يتطلب قوة خارجية أكبر للضغط. |
| شغل الضغط | يزيد بشكل كبير من الطاقة (الشغل) المطلوبة للضغط. |
| العملية الواقعية | يؤدي إلى تسخين كظْمي، مما يزيد من المقاومة والشغل المطلوبين. |
حسّن عمليات مناولة الغاز لديك مع KINTEK
يُعد فهم العلاقة الحاسمة بين درجة الحرارة وضغط الغاز أمرًا أساسيًا لتحقيق الكفاءة والسلامة والأداء في أي بيئة معملية أو صناعية. سواء كنت تقوم بتصميم نظام جديد أو تحسين نظام موجود، فإن إدارة التأثيرات الحرارية أمر بالغ الأهمية.
تتخصص KINTEK في معدات المختبرات الدقيقة والمواد الاستهلاكية التي تساعدك على التحكم في هذه المتغيرات. من البيئات ذات درجة الحرارة المتحكم بها إلى أنظمة الضغط الفعالة، تم تصميم حلولنا لتعزيز سلامة سير عملك وتقليل استهلاك الطاقة.
دعنا نساعدك في تحقيق نتائج متفوقة. اتصل بخبرائنا اليوم عبر نموذج الاتصال الخاص بنا لمناقشة كيف يمكن لحلولنا المخصصة تلبية احتياجات وتحديات مختبرك المحددة.
دليل مرئي
المنتجات ذات الصلة
- مصنع مخصص لأجزاء PTFE Teflon لتطبيقات صمامات الهواء
- قالب ضغط الكرات للمختبر
- آلة مكبس هيدروليكي يدوي ساخن بألواح ساخنة للضغط الساخن المخبري
- قالب مكبس المضلع للمختبر
- آلة ضغط حراري معملية أوتوماتيكية
يسأل الناس أيضًا
- ما هي الأنواع المختلفة لتجهيزات الضغط؟ اختر الختم المناسب لنظامك
- هل يمكن للجرافيت تحمل الحرارة؟ إطلاق العنان لإمكاناته القصوى عند 3600 درجة مئوية في البيئات الخاملة
- ما هو الفرق بين FTIR و IR؟ القفزة الثورية في التحليل الطيفي الحديث
- ما هي فوائد البقاء على اطلاع بأحدث تقنيات المجمدات شديدة الانخفاض (ULT)؟ توفير التكاليف وتعزيز الاستدامة
- ما هو التفسير المبسّط للانحلال الحراري؟ دليل لتحويل النفايات إلى طاقة
- ما هو الاستقرار الحراري للغرافين؟ دليل لحدود درجة الحرارة واختيار المواد
- كم يستغرق المعالجة الحرارية للصلب؟ من دقائق إلى أيام لمشروعك
- ما هي الاعتبارات الرئيسية لمعدات التحريك للزيوت عالية اللزوجة؟ تحسين الاختزال التحفيزي الخالي من المذيبات



















