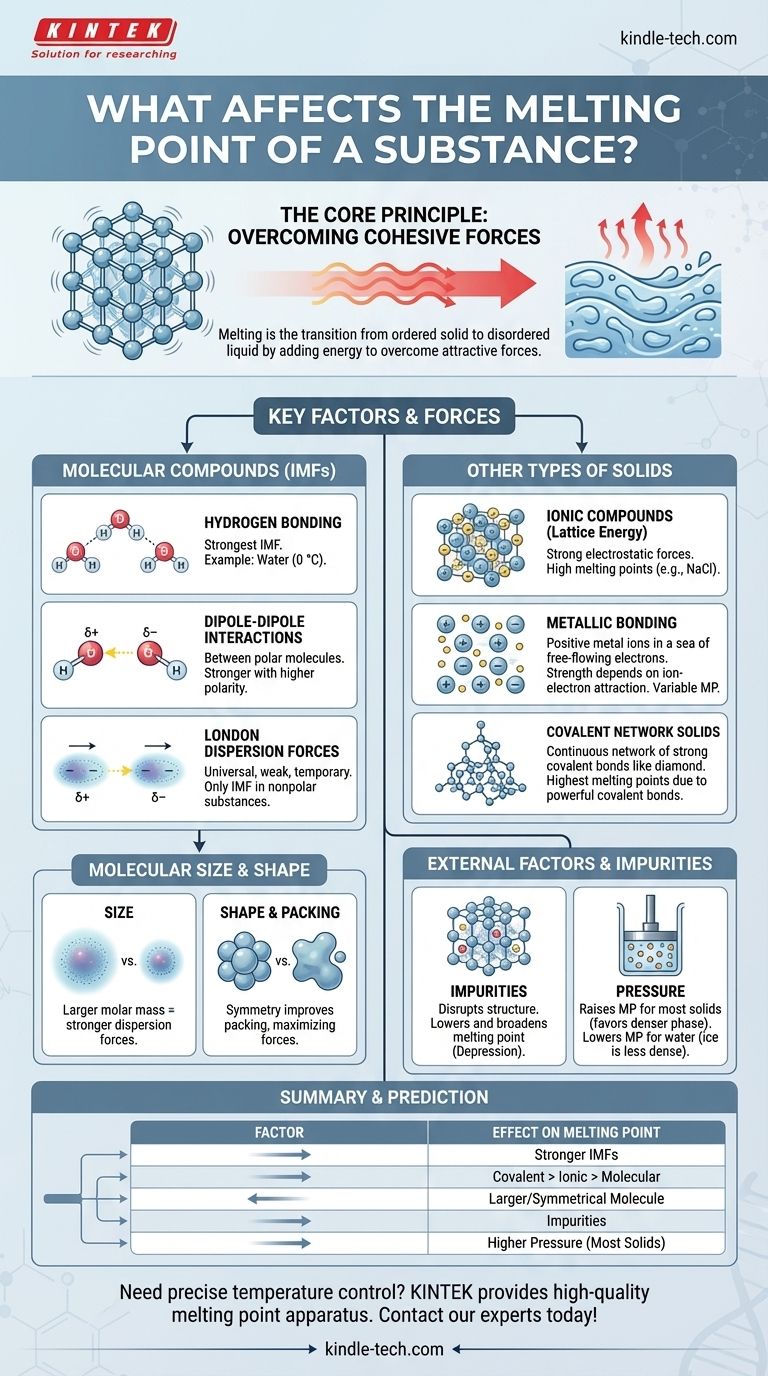
في جوهرها، تتحدد نقطة انصهار المادة بالطاقة اللازمة للتغلب على قوى الجذب التي تربط جسيماتها في بنية ثابتة ثلاثية الأبعاد. العوامل الأساسية هي قوة هذه القوى—سواء كانت روابط كيميائية أو قوى بين جزيئية أضعف—وطريقة تلاصق الجسيمات معًا. تلعب عوامل مثل حجم الجزيء وشكله ووجود الشوائب دورًا حاسمًا أيضًا.
المبدأ المركزي بسيط: تتطلب قوى الجذب الأقوى بين الجسيمات طاقة حرارية أكبر لكسرها، مما يؤدي إلى نقطة انصهار أعلى. القصة الكاملة لنقاط الانصهار هي استكشاف لما يخلق هذه القوى ويعدلها.

المبدأ الأساسي: التغلب على القوى المتماسكة
الانصهار هو تحول فيزيائي من حالة صلبة منظمة إلى حالة سائلة غير منظمة. فهم هذا الانتقال هو مفتاح فهم العوامل التي تتحكم فيه.
ما هو الانصهار؟
في الحالة الصلبة، تكون الذرات أو الأيونات أو الجزيئات محبوسة في ترتيب ثابت يسمى الشبكة البلورية. تهتز في مكانها ولكنها لا تتحرك متجاوزة بعضها البعض.
يحدث الانصهار عند درجة حرارة محددة حيث تكتسب هذه الجسيمات طاقة حركية كافية من الحرارة لتتحرر من مواقعها الثابتة وتبدأ في التدفق.
الطاقة مقابل التماسك
الحرارة التي تضيفها إلى المادة تزيد من الطاقة الحركية لجسيماتها، مما يجعلها تهتز بشكل أكثر كثافة. نقطة الانصهار هي درجة حرارة التوازن حيث تصبح هذه الطاقة الاهتزازية قوية بما يكفي للتغلب على القوى المتماسكة التي تربط الشبكة البلورية معًا.
العوامل الرئيسية للمركبات الجزيئية
بالنسبة للمواد المكونة من جزيئات منفصلة (مثل الماء أو الشمع أو السكر)، فإن القوى بين الجزيئات—وليس الروابط داخلها—هي التي تنكسر أثناء الانصهار. تسمى هذه القوى بين الجزيئية (IMFs).
الروابط الهيدروجينية: أقوى القوى بين الجزيئية
الرابطة الهيدروجينية هي نوع قوي من التفاعل ثنائي القطب-ثنائي القطب يحدث عندما يرتبط الهيدروجين بذرة عالية الكهرسلبية مثل النيتروجين (N) أو الأكسجين (O) أو الفلور (F).
الماء (H₂O) هو مثال كلاسيكي. نقطة انصهاره العالية (0 درجة مئوية) مقارنة بالجزيئات ذات الحجم المماثل ترجع بالكامل إلى الشبكة القوية من الروابط الهيدروجينية التي تربط الجزيئات معًا في الجليد.
تفاعلات ثنائي القطب-ثنائي القطب
توجد هذه القوى بين الجزيئات القطبية، التي تحتوي على نهايات جزئية موجبة وسالبة دائمة. تجذب النهاية الموجبة لجزيء ما النهاية السالبة لجاره.
كلما زادت قطبية الجزيء، زاد جذب ثنائي القطب-ثنائي القطب، وارتفعت نقطة الانصهار.
قوى لندن التشتتية: القوة العالمية
توجد هذه الجاذبات المؤقتة والضعيفة في جميع الجزيئات، سواء كانت قطبية أو غير قطبية. تنشأ من تقلبات لحظية في السحابة الإلكترونية حول الجزيء، مما يخلق أقطابًا ثنائية عابرة.
بالنسبة للمواد غير القطبية مثل الميثان (CH₄) أو الأوكتان (C₈H₁₈)، فإن قوى لندن التشتتية هي القوى الوحيدة الموجودة بين الجزيئات.
دور الحجم والشكل الجزيئي
الحجم (الكتلة المولية): تحتوي الجزيئات الأكبر على سحب إلكترونية أكبر، والتي تتشوه بسهولة أكبر. يؤدي هذا إلى قوى لندن التشتتية أقوى، وبالتالي نقاط انصهار أعلى. هذا هو السبب في أن الهيدروكربونات الكبيرة الشمعية تكون صلبة في درجة حرارة الغرفة بينما الغازات الصغيرة مثل الميثان تكون غازية.
التماثل والتعبئة: يمكن للجزيئات المتماثلة والمضغوطة أن تتراص بشكل أكثر إحكامًا وكفاءة في شبكة بلورية. هذا التراص الوثيق يزيد من فعالية القوى بين الجزيئية، مما يؤدي إلى نقطة انصهار أعلى من الأيزومرات غير المنتظمة الشكل من نفس الحجم.
ما وراء الجزيئات: أنواع أخرى من المواد الصلبة
ليست كل المواد الصلبة مصنوعة من جزيئات منفصلة. في العديد من المواد، يتطلب الانصهار كسر روابط كيميائية قوية تمتد عبر الهيكل بأكمله.
المركبات الأيونية وطاقة الشبكة البلورية
في المركبات الأيونية مثل ملح الطعام (NaCl)، ترتبط الأيونات الموجبة والسالبة في شبكة صلبة بواسطة قوى إلكتروستاتيكية قوية (روابط أيونية). يتطلب صهر هذه المواد التغلب على هذا الجذب الهائل، والذي يقاس بطاقة الشبكة البلورية.
نظرًا لأن الروابط الأيونية أقوى بكثير من القوى بين الجزيئية، فإن المركبات الأيونية لها نقاط انصهار عالية جدًا.
المعادن والروابط المعدنية
ترتبط المعادن معًا بواسطة روابط معدنية، حيث يتدفق "بحر" من الإلكترونات غير المتمركزة بحرية بين شبكة ثابتة من أيونات المعادن الموجبة.
تحدد قوة الجذب بين الأيونات وبحر الإلكترونات هذا نقطة الانصهار. المعادن مثل التنجستن والتيتانيوم تشكل روابط معدنية قوية جدًا ولها نقاط انصهار عالية بشكل استثنائي.
المواد الصلبة الشبكية التساهمية
في هذه المواد، ترتبط الذرات بشبكة مستمرة من الروابط التساهمية القوية. لا توجد جزيئات فردية.
لصهر مادة صلبة شبكية تساهمية مثل الماس (الكربون) أو الكوارتز (ثاني أكسيد السيليكون)، يجب كسر هذه الروابط التساهمية القوية. يتطلب هذا قدرًا هائلاً من الطاقة، مما يمنحها أعلى نقاط انصهار لأي فئة من المواد.
فهم المقايضات والعوامل الخارجية
الخصائص الجوهرية للمادة ليست التأثير الوحيد. الظروف الخارجية والتركيب لها أيضًا تأثير كبير.
تأثير الشوائب: انخفاض نقطة الانصهار
يؤدي وجود الشوائب إلى تعطيل البنية المنتظمة للشبكة البلورية. تتطلب هذه الشبكة الضعيفة وغير المنظمة طاقة أقل للتفكك.
تُعرف هذه الظاهرة باسم انخفاض نقطة الانصهار. هذا هو السبب في أن المادة النقية لها نقطة انصهار حادة ومميزة، بينما تنصهر المادة غير النقية على نطاق واسع ومنخفض من درجات الحرارة. وهو أيضًا المبدأ وراء استخدام الملح لإذابة الجليد على الطرق في الشتاء.
تأثير الضغط
بالنسبة لمعظم المواد، تكون المرحلة الصلبة أكثر كثافة من المرحلة السائلة. يزيد الضغط من تفضيل الحالة الأكثر كثافة، مما يدفع الجسيمات أقرب إلى بعضها ويجعل من الصعب عليها التحرر. لذلك، بالنسبة لمعظم المواد، يرفع الضغط العالي نقطة الانصهار.
الماء استثناء مشهور. نظرًا لأن الجليد أقل كثافة من الماء السائل، فإن زيادة الضغط تفضل الحالة السائلة، وبالتالي تخفض نقطة الانصهار.
كيفية التنبؤ بنقاط الانصهار النسبية
استخدم هذه المبادئ لمقارنة المواد المختلفة والتنبؤ بسلوكها.
- إذا كنت تقارن شبكة تساهمية، ومركب أيوني، ومركب جزيئي: ستكون الشبكة التساهمية (مثل الماس) هي الأعلى، تليها الأيونية (مثل الملح)، مع كون المركب الجزيئي (مثل السكر) أقل بكثير.
- إذا كنت تقارن مركبات جزيئية: أولاً، تحقق من وجود الروابط الهيدروجينية، وهي عامل مهيمن. إذا لم تكن موجودة، قارن القطبية. إذا كانت جميعها غير قطبية أو ذات قطبية مماثلة، فإن الجزيء ذو الكتلة المولية الأكبر سيكون له عمومًا نقطة انصهار أعلى.
- إذا كنت تقارن مركبات أيونية: المركب الذي يحتوي على شحنات أعلى على أيوناته و/أو أنصاف أقطار أيونية أصغر سيكون له طاقة شبكة بلورية أقوى ونقطة انصهار أعلى.
- إذا كنت بحاجة لتقييم النقاء: المادة التي تنصهر بشكل حاد عند نقطة انصهارها المعروفة من المرجح أن تكون نقية، بينما المادة التي تنصهر تدريجيًا على مدى نطاق أقل من نقطتها المتوقعة تكون غير نقية.
من خلال فهم هذه القوى الأساسية، يمكنك التنبؤ بفعالية كيف تحدد البنية المجهرية للمادة سلوك انصهارها.
جدول الملخص:
| العامل | التأثير على نقطة الانصهار | المبدأ الرئيسي |
|---|---|---|
| القوى بين الجزيئية (IMFs) | أعلى مع قوى IMFs أقوى | الروابط الهيدروجينية > ثنائي القطب-ثنائي القطب > تشتت لندن |
| نوع الرابطة الكيميائية | شبكة تساهمية > أيونية > معدنية > جزيئية | قوة الروابط التي يجب كسرها |
| الحجم/الشكل الجزيئي | أعلى مع كتلة مولية أكبر وشكل متماثل | يزيد من قوى لندن ويحسن تعبئة الشبكة البلورية |
| الشوائب | يخفض (انخفاض نقطة الانصهار) | يعطل الشبكة البلورية، مما يتطلب طاقة أقل للانصهار |
| الضغط | يرفع (لمعظم المواد الصلبة)؛ يخفض (للجليد/الماء) | يفضل المرحلة الأكثر كثافة (صلبة لمعظم المواد، سائلة للماء) |
هل تحتاج إلى تحكم دقيق في درجة الحرارة لتحليل المواد الخاصة بك؟ فهم نقاط الانصهار أمر بالغ الأهمية لتوصيف المواد، وتقييم النقاء، وتطوير العمليات. تتخصص KINTEK في توفير معدات مختبرية عالية الجودة، بما في ذلك أجهزة ونوافير نقطة الانصهار، لمساعدة مختبرك على تحقيق نتائج دقيقة وموثوقة. اتصل بخبرائنا اليوم للعثور على الحل الأمثل لتطبيقك المحدد!
دليل مرئي
المنتجات ذات الصلة
- فرن الفرن الصهري للمختبر ذو الرفع السفلي
- فرن بوتقة 1800 درجة مئوية للمختبر
- فرن الفرن الكتم 1400 درجة مئوية للمختبر
- فرن بوتقة 1700 درجة مئوية للمختبر
- فرن أنبوبي مختبري بدرجة حرارة عالية 1400 درجة مئوية مع أنبوب ألومينا
يسأل الناس أيضًا
- ما هي التطبيقات الصناعية للحام بشعاع الإلكترون؟ لحام دقيق للمكونات الحيوية
- ما هي المواد الاستهلاكية الأساسية المطلوبة للعمليات المختبرية؟ دليل الخبراء للمواد المصنوعة من PTFE والسيراميك والأواني الخزفية
- لماذا يعتبر الفحم الحيوي أفضل من الفحم العادي؟ إطلاق العنان للكربون المناسب لهدفك
- ما هي الميزات التي يتضمنها نظام الإنذار في مجمدات ULT؟ احمِ عيناتك بسلامة متعددة الطبقات
- ما هي قيود مفاعل السرير المميع؟ التحديات الرئيسية في التصميم والتشغيل
- ما هو جهاز التبخير الدوراني (rotavap)؟ حقق تبخيرًا سريعًا ولطيفًا للمذيبات في مختبرك
- ما هي العيوب التي تحدث أثناء المعالجة الحرارية للصلب؟ منع التشقق والالتواء والبقع اللينة
- ما هي الوظائف الحاسمة للنيتروجين عالي النقاء أثناء عملية الانحلال الحراري للكتلة الحيوية؟ تعزيز سلامة المنتج



















