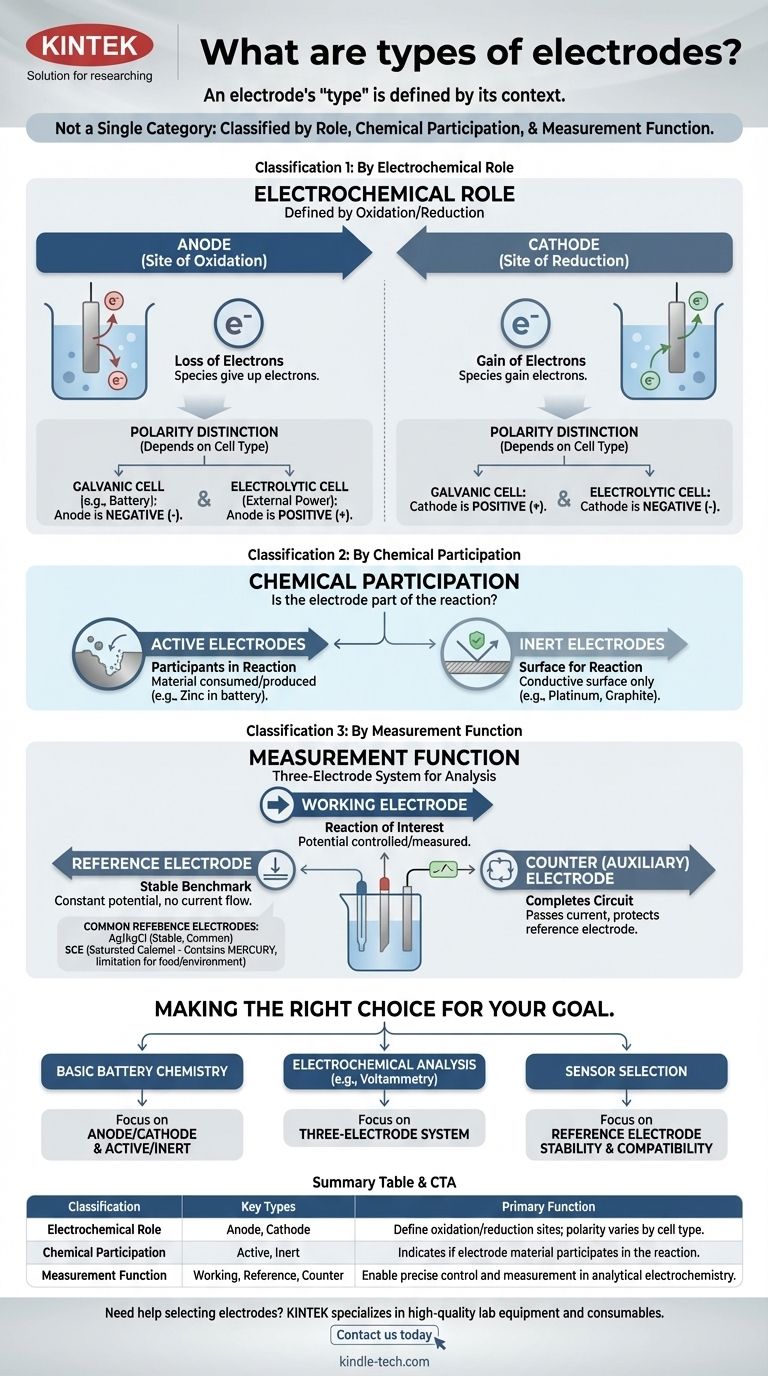
مصطلح "القطب الكهربائي" ليس فئة واحدة. بدلاً من ذلك، يتم تصنيف الأقطاب الكهربائية بعدة طرق مميزة بناءً على دورها في التفاعل، ومشاركتها الكيميائية، ووظيفتها داخل نظام القياس. يعد فهم أنظمة التصنيف المختلفة هذه هو المفتاح لاستيعاب الغرض منها في أي خلية كهروكيميائية.
البصيرة الأكثر أهمية هي أن "نوع" القطب الكهربائي يُعرَّف من خلال سياقه. يمكن أن تكون قطعة المعدن نفسها مصعدًا أو مهبطًا، نشطة أو خاملة، اعتمادًا كليًا على النظام الكهروكيميائي الذي تضعها فيه.
التصنيف 1: حسب الدور الكهروكيميائي
يُعرّف التصنيف الأساسي القطب الكهربائي بدوره في نصفي التفاعل الكهروكيميائي: الأكسدة والاختزال.
المصعد (Anode): موقع الأكسدة
المصعد، بحكم التعريف، هو القطب الكهربائي الذي تحدث عنده الأكسدة - فقدان الإلكترونات. الأنواع الموجودة عند المصعد تتخلى عن إلكتروناتها للقطب الكهربائي.
المهبط (Cathode): موقع الاختزال
المهبط هو القطب الكهربائي الذي يحدث عنده الاختزال - اكتساب الإلكترونات. يمنح المهبط إلكتروناته للأنواع الموجودة في المحلول.
التمييز الحاسم: قطبية المصعد/المهبط
نقطة شائعة للالتباس هي شحنة المصعد والمهبط (+ أو -). تعتمد هذه القطبية على نوع الخلية:
- في الخلية الغلفانية (مثل البطارية)، يولد التفاعل التلقائي الطاقة. المصعد هو الطرف السالب، والمهبط هو الطرف الموجب.
- في الخلية التحليلية، يدفع مصدر طاقة خارجي تفاعلاً غير تلقائي. المصعد هو الطرف الموجب، والمهبط هو الطرف السالب.
التصنيف 2: حسب المشاركة الكيميائية
يصف هذا التصنيف ما إذا كانت مادة القطب الكهربائي نفسها جزءًا من التفاعل الكيميائي.
الأقطاب النشطة: المشاركون في التفاعل
يتكون القطب النشط من مادة يتم استهلاكها أو إنتاجها أثناء تفاعل الخلية. على سبيل المثال، في بطارية الزنك والنحاس، يذوب مصعد الزنك، ويشارك بنشاط في نصف تفاعل الأكسدة.
الأقطاب الخاملة: سطح للتفاعل
القطب الخامل لا يشارك في التفاعل الكيميائي. إنه يعمل فقط كسطح موصل حيث يمكن أن تحدث الأكسدة أو الاختزال. البلاتين والكربون (الجرافيت) هما قطبان خاملان شائعان يُستخدمان لتسهيل التفاعلات التي تتضمن الغازات أو الأيونات المذابة.
التصنيف 3: حسب وظيفة القياس
في الكيمياء الكهربائية التحليلية، غالبًا ما يتم استخدام نظام الأقطاب الثلاثة لإجراء قياسات دقيقة. وهذا يؤدي إلى تصنيف وظيفي.
القطب العامل (Working Electrode)
هذا هو القطب الكهربائي الذي يحدث عنده التفاعل موضع الاهتمام. جهده هو المتغير الأساسي الذي يتم التحكم فيه أو قياسه.
القطب المرجعي: المعيار الثابت
يوفر القطب المرجعي جهدًا ثابتًا ومستقرًا يتم قياس جهد القطب العامل مقابله. لا يتغير جهده الخاص بغض النظر عن التيار المتدفق أو تكوين المحلول السائب.
القطب المساعد (أو المضاد):
الغرض الوحيد لهذا القطب هو إكمال الدائرة الكهربائية. يمرر كل التيار المطلوب من قبل القطب العامل، مما يضمن تدفق تيار ضئيل عبر القطب المرجعي الحساس، وبالتالي حماية استقراره.
فهم المفاضلات: أقطاب مرجعية شائعة
يعد اختيار القطب المرجعي أمرًا بالغ الأهمية للقياسات الدقيقة ويعتمد على البيئة الكيميائية.
Ag/AgCl: الحصان العمل الشائع
قطب الفضة/كلوريد الفضة (Ag/AgCl) هو القطب المرجعي الأكثر شيوعًا. إنه مستقر وغير مكلف وموثوق به بشكل عام، مما يجعله الخيار الافتراضي للعديد من المحاليل المائية.
قطب الكالوميل المشبع (SCE): البديل الكلاسيكي
قطب الكالوميل المشبع (SCE) هو معيار قديم ومستقر للغاية. غالبًا ما يستخدم في الحالات التي يكون فيها المحلول المراد اختباره غير متوافق مع أيونات الفضة أو الكلوريد، والتي يمكن أن تتداخل مع قطب Ag/AgCl.
مشكلة الزئبق: قيد رئيسي
العيب الرئيسي لـ SCE هو أنه يحتوي على الزئبق. وهذا يجعله غير مناسب للتطبيقات التي تنطوي على الأغذية أو المشروبات أو الاختبارات البيئية حيث يمثل تلوث الزئبق مصدر قلق كبير.
اتخاذ الخيار الصحيح لهدفك
يحدد تطبيقك أي تصنيف هو الأكثر أهمية.
- إذا كان تركيزك الأساسي هو فهم كيمياء البطارية الأساسية: أتقن مفاهيم المصعد/المهبط والأقطاب النشطة/الخاملة.
- إذا كان تركيزك الأساسي هو إجراء التحليل الكهروكيميائي (مثل الفولتامترية): فإن نظام الأقطاب الثلاثة (العامل، المرجعي، المساعد) هو الإطار الأساسي.
- إذا كان تركيزك الأساسي هو اختيار مستشعر لبيئة معينة: سيكون شاغلك الرئيسي هو التوافق الكيميائي واستقرار القطب المرجعي الخاص بك، مثل الاختيار بين Ag/AgCl وبديل آخر.
إن فهم هذه التصنيفات المتداخلة يمكّنك من التحكم في سلوك أي نظام كهروكيميائي وتفسيره.

جدول الملخص:
| التصنيف | الأنواع الرئيسية | الوظيفة الأساسية |
|---|---|---|
| الدور الكهروكيميائي | المصعد، المهبط | تحديد مواقع الأكسدة/الاختزال؛ تختلف القطبية حسب نوع الخلية (غلفانية/تحليلية) |
| المشاركة الكيميائية | نشط، خامل | يشير إلى ما إذا كانت مادة القطب الكهربائي تشارك في التفاعل أو تعمل كسطح فقط |
| وظيفة القياس | العامل، المرجعي، المساعد | تمكين التحكم والقياس الدقيق في الكيمياء الكهربائية التحليلية |
هل تحتاج إلى مساعدة في اختيار الأقطاب الكهربائية المناسبة لتطبيقات الكيمياء الكهربائية في مختبرك؟ في KINTEK، نحن متخصصون في توفير معدات المختبرات والمواد الاستهلاكية عالية الجودة والمصممة خصيصًا لتلبية احتياجات أبحاثك. سواء كنت تعمل على تطوير البطاريات، أو تصميم المستشعرات، أو القياسات التحليلية، فإن خبرتنا تضمن حصولك على الأقطاب الكهربائية المثلى للدقة والأداء. اتصل بنا اليوم لمناقشة متطلباتك وتعزيز سير عملك الكهروكيميائي!
دليل مرئي
المنتجات ذات الصلة
- قطب قرص البلاتين الدوار للتطبيقات الكهروكيميائية
- قطب القرص الذهبي
- قطب مرجعي لكبريتات النحاس للاستخدام المخبري
- قطب مساعد بلاتيني للاستخدام المخبري
- قطب صفيحة البلاتين للتطبيقات المختبرية والصناعية
يسأل الناس أيضًا
- كيف يجب تنظيف قطب سلك/قضيب البلاتين قبل الاستخدام؟ دليل لبيانات كيميائية كهربائية موثوقة
- ما الفرق بين RDE و RRDE؟ اكتشف تحليل التفاعلات الكهروكيميائية المتقدمة
- ما هو التطبيق الشائع للقطب الكهربائي السلكي/القضيب البلاتيني؟ الدليل الأساسي للأقطاب الكهربائية الموازنة
- ما هي طريقة القطب الدائري القرصي الدوار؟ اكتشف تحليل التفاعل في الوقت الفعلي
- ما هي مواصفات القطب الوظيفي من البلاتين والتيتانيوم؟ تعظيم الأداء الكهروكيميائي



















