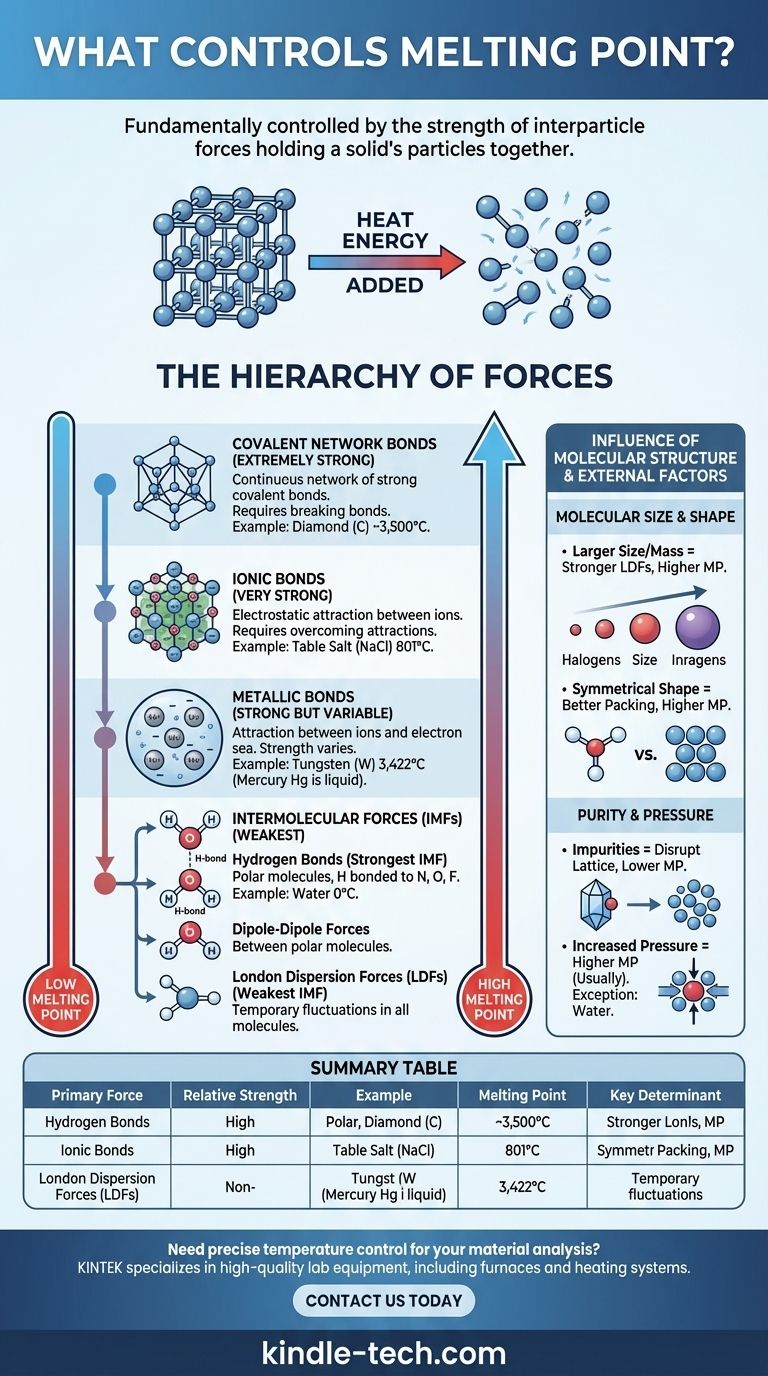
تتحكم قوة القوى التي تربط جزيئات المادة معًا بشكل أساسي في نقطة انصهارها. في الحالة الصلبة، تكون الجزيئات (الذرات أو الأيونات أو الجزيئات) محبوسة في ترتيب ثابت ومنظم يسمى الشبكة البلورية. لإذابة المادة الصلبة، يجب إضافة طاقة حرارية كافية للسماح لهذه الجزيئات بالتغلب على تلك القوى والتحرك بعضها فوق بعض كسائل. لذلك، تتطلب القوى الأقوى مزيدًا من الطاقة للكسر، مما يؤدي إلى نقطة انصهار أعلى.
المبدأ الأساسي بسيط: الانصهار لا يتعلق بكسر الجزيئات نفسها، بل بالتغلب على قوى الجذب بينها. إن نوع وقوة هذه القوى بين الجزيئات - التي تتراوح من الروابط الأيونية القوية إلى الجذب الضعيف بين الجزيئات - هي المحددات الأساسية لنقطة انصهار المادة.

التسلسل الهرمي للقوى
يمكن فهم التباين الهائل في نقاط الانصهار - من -259 درجة مئوية للهيدروجين إلى 3422 درجة مئوية للتنجستن - من خلال تصنيف القوى التي تربط المادة الصلبة معًا. توجد هذه القوى في تسلسل هرمي واضح للقوة.
الروابط الأيونية (قوية جدًا)
في المركبات الأيونية مثل ملح الطعام (كلوريد الصوديوم)، تكون الجزيئات أيونات موجبة وسالبة الشحنة. وهي مرتبطة ببعضها البعض عن طريق قوى جذب كهربائية قوية في شبكة بلورية صلبة.
يتطلب التغلب على هذه الروابط الأيونية القوية كمية هائلة من الطاقة الحرارية. وبالتالي، تظهر المركبات الأيونية باستمرار نقاط انصهار عالية جدًا.
روابط الشبكة التساهمية (قوية للغاية)
في المواد الصلبة ذات الشبكة التساهمية، ترتبط الذرات بشبكة واسعة ومستمرة من الروابط التساهمية القوية. لا توجد جزيئات فردية؛ البلورة بأكملها هي في الأساس جزيء عملاق واحد.
تعد مواد مثل الماس (الكربون) والكوارتز (ثاني أكسيد السيليكون) أمثلة رئيسية. لإذابتها، يجب كسر هذه الروابط التساهمية القوية للغاية، مما يتطلب كميات هائلة من الطاقة، مما يؤدي إلى نقاط انصهار عالية بشكل استثنائي.
الروابط المعدنية (قوية ولكنها متغيرة)
تتكون المعادن من شبكة من الأيونات المعدنية الموجبة التي تقع في "بحر" من الإلكترونات غير المتمركزة التي تتحرك بحرية في جميع أنحاء الهيكل. يشكل الجذب بين الأيونات الموجبة وبحر الإلكترونات هذا الرابط المعدني.
تختلف قوة هذا الرابط، وبالتالي نقطة الانصهار، بشكل كبير. يعتمد ذلك على عوامل مثل شحنة الأيون وعدد الإلكترونات غير المتمركزة. هذا هو السبب في أن الزئبق سائل في درجة حرارة الغرفة، بينما يحتوي التنجستن على واحدة من أعلى نقاط الانصهار لأي عنصر.
القوى بين الجزيئات (الأضعف)
بالنسبة للمركبات الجزيئية (مثل الماء أو السكر أو الشمع)، فإن القوى التي يجب التغلب عليها للانصهار هي القوى بين الجزيئات (IMFs) - قوى الجذب بين الجزيئات المنفصلة. هذه أضعف بكثير من الروابط الأيونية أو التساهمية أو المعدنية التي نوقشت أعلاه.
هناك ثلاثة أنواع رئيسية من القوى بين الجزيئات:
- الروابط الهيدروجينية: أقوى أنواع القوى بين الجزيئات. تحدث في الجزيئات القطبية حيث يرتبط الهيدروجين مباشرة بذرة عالية الكهرسلبية (النيتروجين أو الأكسجين أو الفلور). تعود نقطة انصهار الماء العالية نسبيًا (0 درجة مئوية) إلى هذه الروابط الهيدروجينية القوية.
- قوى ثنائي القطب-ثنائي القطب: تحدث بين الجزيئات القطبية التي تحتوي على أطراف موجبة وسالبة دائمة. هذه القوى أضعف من الروابط الهيدروجينية.
- قوى تشتت لندن (LDFs): أضعف قوى بين الجزيئات، موجودة في جميع الجزيئات. تنشأ من تقلبات مؤقتة وعشوائية في توزيع الإلكترونات. على الرغم من ضعفها بشكل فردي، إلا أن تأثيرها التراكمي يمكن أن يكون كبيرًا في الجزيئات الأكبر حجمًا.
تأثير التركيب الجزيئي
بالإضافة إلى نوع القوة، يلعب الحجم والشكل المحددان للجسيمات دورًا حاسمًا، خاصة بالنسبة للمركبات الجزيئية.
الحجم والكتلة الجزيئية
بالنسبة للمركبات التي تحتوي على نفس القوة الأولية بين الجزيئات (مثل LDFs)، تكون الجزيئات الأكبر حجمًا ذات نقاط انصهار أعلى. وذلك لأن الجزيئات الأكبر حجمًا تحتوي على المزيد من الإلكترونات، مما يخلق سحابة إلكترونية "أكثر قابلية للاستقطاب" تؤدي إلى قوى تشتت لندن أقوى.
هذا الاتجاه واضح في الهالوجينات: تزداد نقطة الانصهار كلما انتقلت من الفلور (F₂) إلى اليود (I₂).
الشكل الجزيئي وكفاءة التعبئة
تؤثر قدرة الجزيء على التعبئة بإحكام وكفاءة في الشبكة البلورية تأثيرًا كبيرًا. غالبًا ما تكون الجزيئات المتماثلة ذات نقاط انصهار أعلى من الأيزومرات الأقل تماثلًا، حتى لو كان لها نفس الصيغة والكتلة.
تسمح الأشكال المتماثلة للجزيئات بالتناسب معًا بشكل أوثق في الحالة الصلبة، مما يزيد من فعالية قواها بين الجزيئات. يتطلب كسر هذا الهيكل المنظم جيدًا مزيدًا من الطاقة.
فهم المقايضات والفروق الدقيقة
يتضمن التنبؤ بنقاط الانصهار موازنة هذه العوامل المترابطة.
النقاء يغير كل شيء
تفترض المبادئ المذكورة أعلاه وجود مادة نقية. تعطل الشوائب الشبكة البلورية المنتظمة، مما يضعف الهيكل العام.
هذا الاضطراب يجعل المادة الصلبة أسهل في الانصهار. ونتيجة لذلك، ستنصهر المادة غير النقية عند درجة حرارة أقل وعلى نطاق أوسع من نظيرتها النقية. تُعرف هذه الظاهرة باسم انخفاض نقطة الانصهار.
الضغط يلعب دورًا
تُذكر نقاط الانصهار عادة عند الضغط الجوي القياسي. بالنسبة لمعظم المواد، يؤدي زيادة الضغط إلى رفع نقطة الانصهار لأنه يدفع الجزيئات فعليًا أقرب إلى بعضها البعض، مما يعزز هيكل الشبكة.
الماء استثناء مشهور وحاسم. نظرًا لأن الجليد الصلب أقل كثافة من الماء السائل، فإن زيادة الضغط تفضل الطور السائل الأكثر كثافة، وبالتالي تخفض نقطة الانصهار.
كيفية تطبيق هذا على تحليلك
عند مقارنة المواد، استخدم نهجًا منهجيًا لتحديد العوامل الرئيسية المؤثرة.
- إذا كان تركيزك الأساسي هو مقارنة فئات مختلفة من المواد الصلبة: أولاً، حدد قوة الربط الأساسية - أيونية، شبكة تساهمية، معدنية، أو بين جزيئية. سيعطيك هذا أهم مؤشر لنقطة الانصهار النسبية.
- إذا كان تركيزك الأساسي هو مقارنة مركبين جزيئيين: حدد أقوى قوة بين جزيئية يمتلكها كل منهما (الروابط الهيدروجينية > ثنائي القطب-ثنائي القطب > LDFs). المركب الذي يحتوي على قوة بين جزيئية أقوى سيكون له عمومًا نقطة انصهار أعلى.
- إذا كان تركيزك الأساسي على جزيئات غير قطبية متشابهة: سيكون للجزيء ذي الكتلة الأكبر والمساحة السطحية الأكبر قوى تشتت لندن أقوى وبالتالي نقطة انصهار أعلى.
- إذا كان تركيزك الأساسي على الأيزومرات (نفس الصيغة، شكل مختلف): غالبًا ما يكون للجزيء الأكثر تماثلًا والذي يمكن أن يتعبأ بكفاءة أكبر في الشبكة البلورية نقطة انصهار أعلى.
من خلال فهم هذا التسلسل الهرمي للقوى وتأثير التركيب، يمكنك شرح سلوك الانصهار لأي مادة تقريبًا بشكل منهجي.
جدول ملخص:
| نوع القوة الأساسية | القوة النسبية | مثال على المادة | نقطة الانصهار | المحدد الرئيسي |
|---|---|---|---|---|
| شبكة تساهمية | قوية للغاية | الماس (C) | ~3,500 درجة مئوية | كسر الروابط التساهمية في شبكة مستمرة |
| روابط أيونية | قوية جدًا | كلوريد الصوديوم (NaCl) | 801 درجة مئوية | التغلب على الجذب الكهروستاتيكي بين الأيونات |
| روابط معدنية | قوية (متغيرة) | التنجستن (W) | 3,422 درجة مئوية | قوة جذب أيون-بحر الإلكترونات |
| القوى بين الجزيئات | الأضعف | الماء (H₂O) | 0 درجة مئوية | الروابط الهيدروجينية، ثنائي القطب-ثنائي القطب، قوى تشتت لندن |
هل تحتاج إلى تحكم دقيق في درجة الحرارة لتحليل المواد الخاصة بك؟ يعد فهم نقاط الانصهار أمرًا بالغ الأهمية للحصول على نتائج مخبرية موثوقة. في KINTEK، نحن متخصصون في معدات المختبرات عالية الجودة، بما في ذلك الأفران وأنظمة التدفئة المصممة للتحليل الحراري الدقيق. سواء كنت تعمل مع معادن ذات نقاط انصهار عالية أو مركبات جزيئية حساسة، تضمن حلولنا أداءً ثابتًا. اتصل بنا اليوم لمناقشة كيف يمكن لمنتجاتنا تعزيز قدرات مختبرك ودعم أبحاثك. تواصل معنا عبر نموذج الاتصال الخاص بنا للبدء!
دليل مرئي
المنتجات ذات الصلة
- فرن الفرن الصهري للمختبر ذو الرفع السفلي
- فرن بوتقة 1800 درجة مئوية للمختبر
- فرن الفرن الكتم 1400 درجة مئوية للمختبر
- فرن بوتقة 1700 درجة مئوية للمختبر
- فرن أنبوبي مختبري بدرجة حرارة عالية 1400 درجة مئوية مع أنبوب ألومينا
يسأل الناس أيضًا
- ما هي أنواع الخلاطات الصيدلانية؟ اختر الخلاط المناسب لتركيبتك
- ما هي معدات الحماية المطلوبة عند التعامل مع البضائع داخل المجمدات فائقة البرودة؟ معدات الوقاية الشخصية الأساسية لسلامة درجات الحرارة شديدة البرودة
- ما هي المشكلة الرئيسية في طاقة الكتلة الحيوية؟ شرح مفارقة الاستدامة
- ما هي الأنواع الأربعة من الكتلة الحيوية التي يمكن تحويلها؟ دليل لمصادر الطاقة المتجددة
- ما هو الدور الأساسي للفرن الصناعي في المعالجة المسبقة لنفايات قشور البرتقال لاستخلاص الهسبريدين؟
- لماذا يعتبر المحفز مهمًا في الانحلال الحراري؟ تعزيز جودة الزيت وكفاءة العملية
- ما هو الغرض من معدات الترشيح بالتفريغ في ترشيح الغاليوم؟ تحقيق كفاءة فصل سريعة بين السائل والصلب
- ما هي العوامل الثلاثة التي تسبب الانصهار؟ فهم درجة الحرارة والضغط والشوائب



















