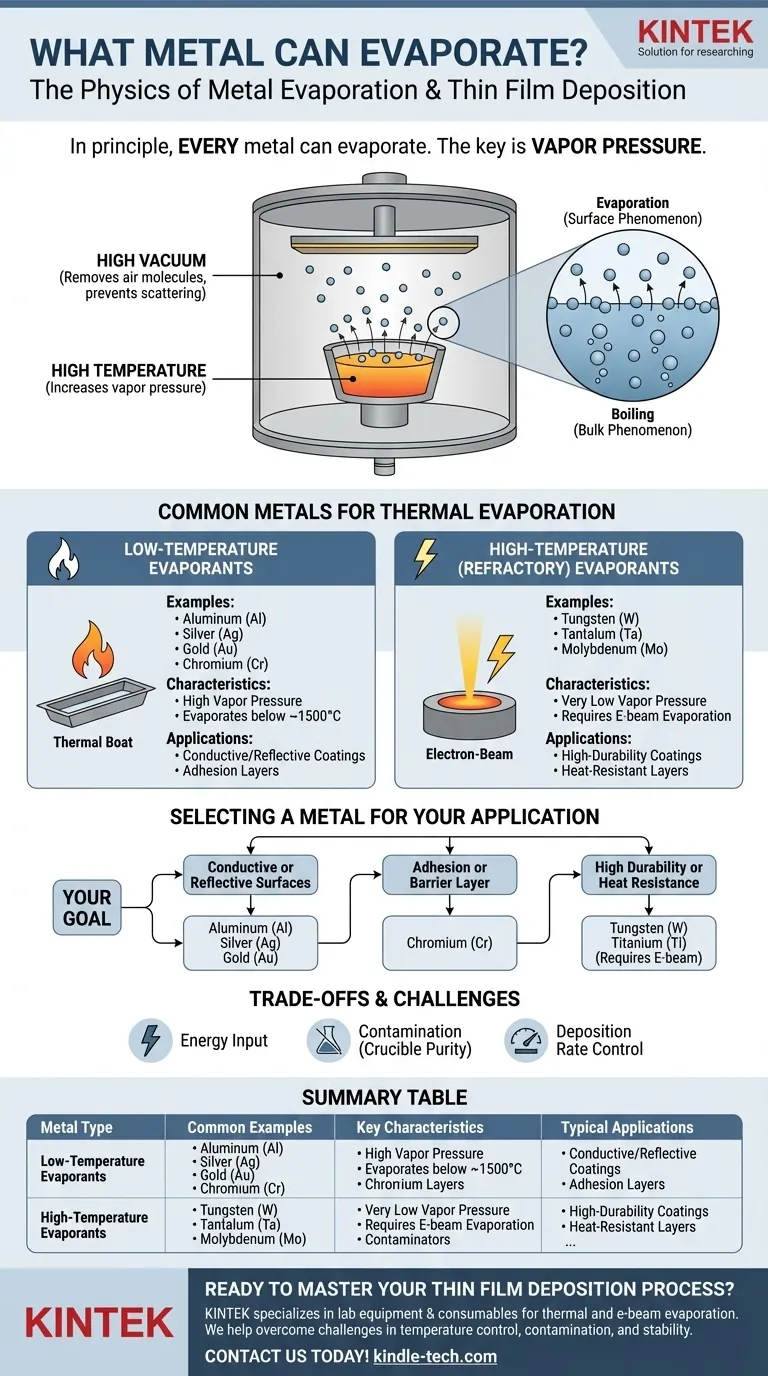
من حيث المبدأ، يمكن لكل معدن أن يتبخر. التبخير هو عملية فيزيائية تحدث عندما ينتقل عنصر أو مركب من الحالة السائلة أو الصلبة إلى الحالة الغازية. بالنسبة للمعادن، تحكم هذه العملية درجة الحرارة والضغط، وتشمل الأمثلة الشائعة في التطبيقات التقنية التبخير الحراري للذهب (Au) والكروم (Cr) والجرمانيوم (Ge) لإنشاء أغشية رقيقة.
القضية الأساسية ليست ما إذا كان المعدن يمكن أن يتبخر، بل مدى سهولة تبخره. ويتم تحديد ذلك من خلال ضغط البخار الجوهري للمعدن - وهو مقياس لميله ليصبح غازًا عند درجة حرارة معينة. المعادن ذات ضغط البخار الأعلى تكون أسهل بكثير في التبخير.

فيزياء تبخير المعادن
لفهم أي المعادن عملي للتبخير، يجب عليك أولاً فهم المبادئ التي تتحكم في العملية. إنها توازن بين خصائص المادة والبيئة التي تنشئها.
ما هو ضغط البخار؟
ضغط البخار هو الضغط الذي يمارسه البخار في حالة توازن مع حالته الصلبة أو السائلة. كل مادة لها ضغط بخار، ويزداد بشكل كبير مع درجة الحرارة.
المعدن ذو ضغط البخار العالي سيتبخر بمعدل أسرع بكثير عند درجة حرارة معينة من المعدن ذي ضغط البخار المنخفض. هذه هي الخاصية الأهم التي تحدد مدى ملاءمته للتبخير.
دور درجة الحرارة والفراغ
لتحقيق معدل تبخير مفيد لمعظم المعادن، تحتاج إلى درجات حرارة عالية جدًا، غالبًا مئات أو آلاف الدرجات المئوية.
تُجرى هذه العملية دائمًا تقريبًا في حجرة تفريغ عالية. يزيل التفريغ جزيئات الهواء، التي قد تتصادم مع ذرات المعدن المتبخر، مما يؤدي إلى تشتيتها ومنعها من الوصول إلى الركيزة المستهدفة.
التبخير مقابل الغليان
التبخير هو ظاهرة سطحية حيث تكتسب الذرات الفردية طاقة كافية للهروب. الغليان هو ظاهرة حجمية حيث يتساوى ضغط البخار مع الضغط الجوي المحيط، مكونًا فقاعات داخل المادة.
في ترسيب الفراغ، يتمثل الهدف في تحقيق معدل تبخير متحكم فيه، وليس غليان مصدر المادة بعنف.
المعادن الشائعة المستخدمة في التبخير الحراري
غالبًا ما يتم تصنيف المعادن حسب درجات الحرارة المطلوبة لتبخيرها بفعالية في الفراغ.
المواد المتبخرة ذات درجة الحرارة المنخفضة
تتميز هذه المعادن بضغوط بخار عالية نسبيًا، مما يسمح بتبخيرها عند درجات حرارة يمكن التحكم فيها (عادةً أقل من 1500 درجة مئوية). وهي تستخدم على نطاق واسع لإنشاء الطلاءات.
تشمل الأمثلة الشائعة الألمنيوم (Al) والفضة (Ag) والذهب (Au) والكروم (Cr). سهولة استخدامها تجعلها أساسية في الإلكترونيات والبصريات.
المواد المتبخرة ذات درجة الحرارة العالية (المقاومة للحرارة)
المعادن المقاومة للحرارة لها ضغوط بخار منخفضة للغاية ونقاط انصهار عالية جدًا، مما يجعل من الصعب تبخيرها بالطرق الحرارية البسيطة.
تتطلب معادن مثل التنغستن (W) والتنتالوم (Ta) والموليبدينوم (Mo) تقنيات متخصصة، مثل تبخير الحزمة الإلكترونية، التي يمكنها تحقيق درجات الحرارة الموضعية الأعلى اللازمة بكثير.
فهم المفاضلات
إن مجرد اختيار معدن ليس كافياً؛ يجب أن تفهم التحديات العملية والقيود المفروضة على عملية التبخير.
تحدي المعادن المقاومة للحرارة
يتطلب تبخير معدن مثل التنغستن مدخلات طاقة هائلة. المعدات أكثر تعقيدًا وتكلفة، حيث يجب أن تكون قادرة على توليد درجات حرارة قصوى والتحمل دون تلويث العملية.
نقاء المصدر والتلوث
يمكن أن يكون لمادة البوتقة أو "القارب" الذي يحمل المعدن مصدرًا للتلوث أيضًا. عند درجات الحرارة العالية، يمكن لمادة القارب نفسها أن تتبخر أو تتفاعل مع المعدن المنصهر، مما يؤدي إلى إدخال شوائب في غشاءك الرقيق النهائي.
معدل الترسيب والتحكم
يمكن أن يتغير معدل تبخر المعدن بشكل كبير مع التقلبات الصغيرة في درجة الحرارة. يتطلب الحفاظ على عملية ترسيب مستقرة وقابلة للتكرار تحكمًا دقيقًا في درجة الحرارة، وهو أسهل للمواد ذات درجة الحرارة المنخفضة مقارنة بالمعادن المقاومة للحرارة.
اختيار معدن لتطبيقك
يجب أن يكون اختيارك للمعدن مدفوعًا بالكامل بهدف الغشاء الرقيق الذي تقوم بإنشائه.
- إذا كان تركيزك الأساسي هو إنشاء أسطح موصلة أو عاكسة: تعتبر معادن مثل الألمنيوم (Al) والفضة (Ag) والذهب (Au) خيارات ممتازة بسبب موصليتها/انعكاسيتها العالية وتبخيرها السهل نسبيًا.
- إذا كان تركيزك الأساسي هو طبقة التصاق أو حاجز: يعتبر الكروم (Cr) خيارًا قياسيًا لأنه يلتصق جيدًا بالعديد من الركائز مثل الزجاج، مما يجعله طبقة وسيطة رائعة للترسيبات اللاحقة.
- إذا كان تركيزك الأساسي يتطلب متانة عالية أو مقاومة للحرارة: ستحتاج إلى استخدام معدن مقاوم للحرارة مثل التنغستن (W) أو التيتانيوم (Ti)، ولكن كن مستعدًا لعملية تبخير بالحزمة الإلكترونية أكثر تعقيدًا وتستهلكًا للطاقة.
في نهاية المطاف، يعد فهم ضغط بخار المعدن هو المفتاح لإتقان تبخيره لأي تطبيق تقني.
جدول ملخص:
| نوع المعدن | أمثلة شائعة | الخصائص الرئيسية | التطبيقات النموذجية |
|---|---|---|---|
| المواد المتبخرة ذات درجة الحرارة المنخفضة | الألمنيوم (Al)، الذهب (Au)، الفضة (Ag)، الكروم (Cr) | ضغط بخار عالٍ، يتبخر تحت ~1500 درجة مئوية | الطلاءات الموصلة، الأسطح العاكسة، طبقات الالتصاق |
| المواد المتبخرة ذات درجة الحرارة العالية (المقاومة للحرارة) | التنغستن (W)، التنتالوم (Ta)، الموليبدينوم (Mo) | ضغط بخار منخفض جدًا، يتطلب تبخير الحزمة الإلكترونية | الطلاءات عالية المتانة، الطبقات المقاومة للحرارة |
هل أنت مستعد لإتقان عملية ترسيب الأغشية الرقيقة لديك؟
يعد اختيار المعدن وتقنية التبخير المناسبين أمرًا بالغ الأهمية لتحقيق نتائج عالية الجودة ومتسقة. تتخصص KINTEK في معدات المختبرات والمواد الاستهلاكية للتبخير الحراري وتبخير الحزمة الإلكترونية، حيث توفر الأدوات الدقيقة والدعم الخبير الذي تحتاجه.
نحن نساعد عملائنا في البحث والتطوير والتصنيع على التغلب على التحديات مثل التحكم في درجة الحرارة والتلوث واستقرار معدل الترسيب. اتصل بنا اليوم لمناقشة تطبيقك المحدد ودع خبرائنا يوجهونك إلى الحل الأمثل لاحتياجات مختبرك.
تواصل معنا عبر نموذج الاتصال الخاص بنا
دليل مرئي
المنتجات ذات الصلة
- معدات ترسيب البخار الكيميائي CVD نظام غرفة انزلاق فرن أنبوبي PECVD مع جهاز تسييل الغاز السائل آلة PECVD
- فرن جو متحكم فيه بدرجة حرارة 1400 درجة مئوية مع غاز النيتروجين والجو الخامل
- فرن أنبوبي ترسيب بخار كيميائي ذو حجرة مقسمة مع نظام محطة تفريغ معدات آلة ترسيب بخار كيميائي
- نظام ترسيب بخار كيميائي معزز بالبلازما بترددات الراديو RF PECVD
- فرن جو متحكم فيه بدرجة حرارة 1200 درجة مئوية فرن جو خامل بالنيتروجين
يسأل الناس أيضًا
- كيف يتم ترسيب الأغشية الرقيقة؟ دليل لطرق PVD مقابل CVD لتطبيقك
- ما هي عملية الترسيب بالتبخير الفراغي؟ إتقان طلاء الأغشية الرقيقة بالترسيب الكيميائي للبخار (CVD) والترسيب الفيزيائي للبخار (PVD)
- ما هي الأنواع المختلفة للأغشية الرقيقة؟ دليل للطلاءات البصرية والكهربائية والوظيفية
- ما هي طرق الترسيب؟ دليل لتقنيات الأغشية الرقيقة PVD و CVD
- ما هي تقنية الترسيب في الطور البخاري؟ دليل لطرق طلاء الأغشية الرقيقة بالترسيب الفيزيائي للبخار (PVD) والترسيب الكيميائي للبخار (CVD)



















