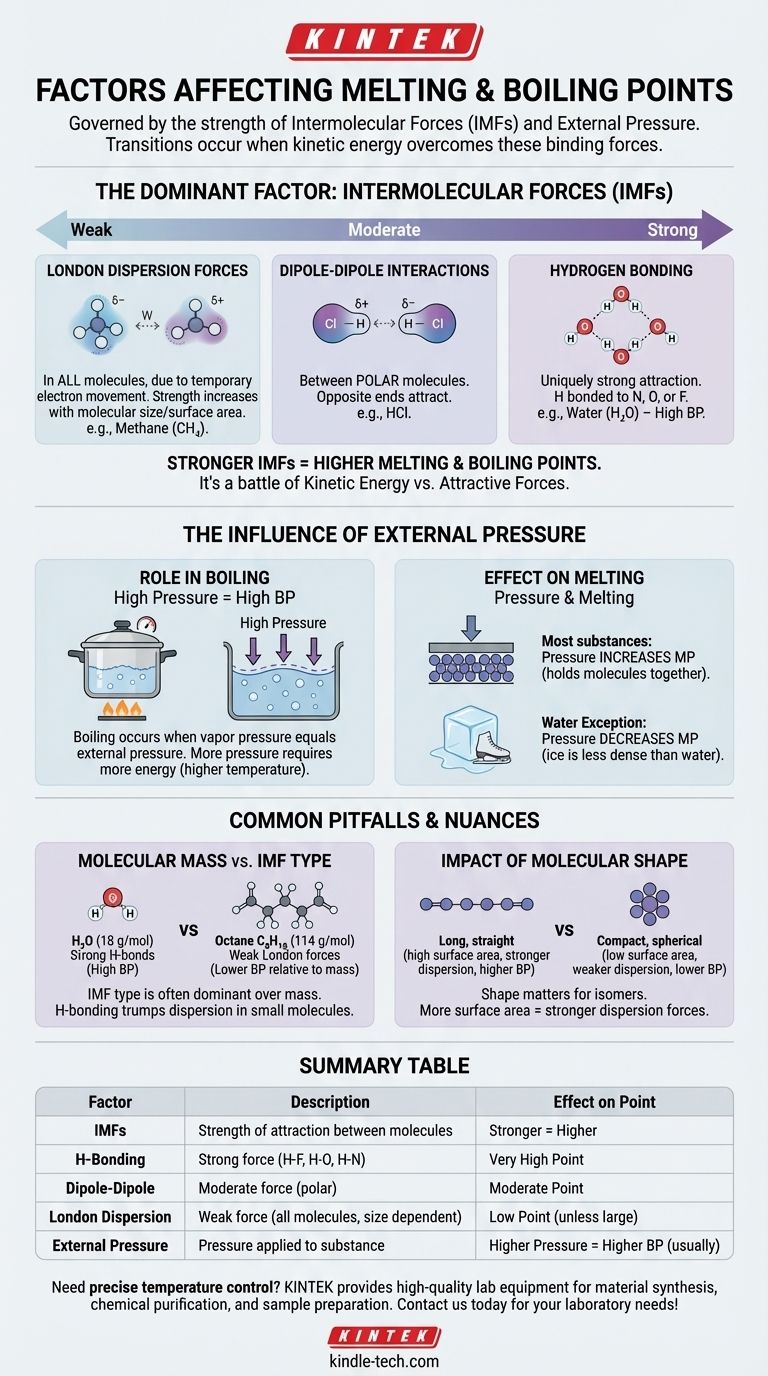
على المستوى الأساسي، تحكم نقطتي الانصهار والغليان للمادة عاملان أساسيان: قوة القوى بين الجزيئات (IMFs) التي تربط جزيئاتها ببعضها البعض والضغط الخارجي المطبق عليها. تحدث هذه التحولات بشكل أساسي عندما تكتسب الجزيئات طاقة كافية للتغلب على القوى التي تربطها والضغط الذي يحويها.
الخلاصة الأساسية هي أن الانصهار والغليان لا يتعلقان فقط بدرجة الحرارة؛ إنهما معركة فيزيائية بين الطاقة الحركية للجزيء والقوى الجاذبة التي تربطه بجيرانه. كلما كانت هذه الجاذبيات أقوى، زادت الطاقة المطلوبة لكسرها.

العامل المهيمن: القوى بين الجزيئات (IMFs)
العامل الأكثر أهمية في تحديد نقطتي الانصهار والغليان للمادة هو قوة الجاذبيات بين جزيئاتها الفردية. هذه ليست الروابط التساهمية القوية داخل الجزيء، بل هي القوى الأضعف التي تجعل الجزيئات تلتصق ببعضها البعض.
ما هي القوى بين الجزيئات؟
فكر في القوى بين الجزيئات (IMFs) على أنها المكافئ الجزيئي للمغناطيس. بعض الجزيئات تشبه المغناطيسات الكهربائية القوية، بينما البعض الآخر يشبه مغناطيسات الثلاجة الضعيفة. يتطلب التغلب على هذا "الالتصاق" طاقة على شكل حرارة.
التسلسل الهرمي للقوى
تختلف القوى بين الجزيئات في قوتها، مما يخلق تسلسلاً هرميًا واضحًا. فهم هذا التسلسل الهرمي هو المفتاح للتنبؤ بالمواد التي سيكون لها نقاط غليان أعلى أو أقل.
الروابط الهيدروجينية (الأقوى) هذا نوع قوي بشكل فريد من الجذب يحدث عندما يرتبط الهيدروجين بذرة عالية الكهرسلبية مثل النيتروجين (N) أو الأكسجين (O) أو الفلور (F). الماء (H₂O) هو المثال الكلاسيكي، وروابطه الهيدروجينية القوية هي السبب في أن لديه نقطة غليان عالية بشكل ملحوظ بالنسبة لحجمه الصغير.
تفاعلات ثنائية القطب-ثنائية القطب (معتدلة) توجد هذه القوى بين الجزيئات القطبية—الجزيئات التي تحتوي على شحنة جزئية موجبة دائمة في أحد طرفيها وشحنة جزئية سالبة في الطرف الآخر. تجذب هذه الأطراف المتعاكسة بعضها البعض، مما يربط المادة معًا بشكل معتدل.
قوى تشتت لندن (الأضعف) توجد هذه القوى في جميع الجزيئات، وتنتج عن الحركة العشوائية المؤقتة للإلكترونات التي تخلق أقطابًا مؤقتة. على الرغم من ضعفها بشكل فردي، إلا أنها تصبح أكثر أهمية مع زيادة حجم ومساحة سطح الجزيء. وهذا هو السبب في أن الجزيئات الأكبر مثل الأوكتان (C₈H₁₈) تكون سوائل في درجة حرارة الغرفة، بينما الجزيئات الأصغر مثل الميثان (CH₄) تكون غازات.
تأثير الضغط الخارجي
يعمل الضغط الخارجي كغطاء مادي على المادة، مما يجعل من الصعب على الجزيئات الهروب إلى الطور التالي (من صلب إلى سائل، أو من سائل إلى غاز).
دور الضغط في الغليان
يحدث الغليان عندما يساوي الضغط البخاري الداخلي للسائل الضغط الجوي الخارجي.
إذا زدت الضغط الخارجي (على سبيل المثال، باستخدام قدر الضغط)، فإنك ترفع نقطة الغليان لأن الجزيئات تحتاج إلى مزيد من الطاقة للدفع ضد تلك القوة الخارجية الأقوى.
على العكس من ذلك، إذا قللت الضغط الخارجي (على سبيل المثال، بالذهاب إلى ارتفاع عالٍ)، فإنك تخفض نقطة الغليان. وهذا هو السبب في أن الماء يغلي عند درجة حرارة أقل في دنفر مما يغلي عليه عند مستوى سطح البحر.
تأثير الضغط على الانصهار
بالنسبة لمعظم المواد، يؤدي زيادة الضغط إلى زيادة طفيفة في نقطة الانصهار. وذلك لأن الضغط يساعد على إبقاء الجزيئات في التركيب الصلب والمحكم التعبئة.
الماء هو استثناء مشهور. نظرًا لأن الجليد الصلب أقل كثافة من الماء السائل، فإن تطبيق الضغط يجعله أسهل في الانصهار. وهذا هو السبب في أن شفرة المتزلج على الجليد يمكن أن تنزلق فوق الجليد.
المزالق الشائعة والفروق الدقيقة
مجرد النظر إلى عامل واحد يمكن أن يكون مضللاً. التفاعل بين القوى والكتلة والشكل يخلق فروقًا دقيقة مهمة.
الكتلة الجزيئية مقابل القوة بين الجزيئات
بينما تزداد نقاط الغليان بشكل عام مع الكتلة المولية، فإن نوع القوة بين الجزيئات هو الأكثر هيمنة بكثير.
جزيء صغير ذو روابط هيدروجينية قوية، مثل الماء (18 جم/مول، يغلي عند 100 درجة مئوية)، سيكون له نقطة غليان أعلى بكثير من جزيء مماثل الحجم بقوى تشتت ضعيفة فقط، مثل الميثان (16 جم/مول، يغلي عند -161.5 درجة مئوية).
تأثير الشكل الجزيئي
بالنسبة للجزيئات ذات الصيغة الكيميائية نفسها (المتشابهات)، يهم الشكل. الجزيئات الطويلة والمستقيمة لديها مساحة سطح أكبر للتلامس، مما يؤدي إلى قوى تشتت لندن أقوى ونقاط غليان أعلى.
الجزيئات المدمجة والكروية لديها مساحة سطح أقل وبالتالي جاذبيات أضعف ونقاط غليان أقل.
القيام بالتنبؤ الصحيح
من خلال الجمع بين هذه المبادئ، يمكنك تقييم سبب سلوك المواد المختلفة بدقة.
- إذا كان تركيزك الأساسي هو مقارنة المواد المختلفة: أولاً، حدد أقوى قوة بين الجزيئات موجودة في كل منها؛ سيكون هذا دائمًا هو المحدد الأساسي لنقاط غليانها النسبية.
- إذا كان تركيزك الأساسي هو تغيير ظروف مادة واحدة: حلل كيف ستؤثر التغيرات في الضغط الخارجي على الطاقة المطلوبة لتحول الطور، خاصة للغليان.
- إذا واجهت نتيجة غير متوقعة: ضع في اعتبارك العوامل الثانوية مثل الشكل الجزيئي أو خصائص الكثافة الفريدة للمادة، كما هو الحال مع الماء.
من خلال فهم هذه المبادئ الأساسية، يمكنك الانتقال من مجرد حفظ نقاط الانصهار والغليان إلى فهم حقيقي للسلوك الفيزيائي للمادة.
جدول الملخص:
| العامل | الوصف | التأثير على نقطة الانصهار/الغليان |
|---|---|---|
| القوى بين الجزيئات (IMFs) | قوة الجذب بين الجزيئات. | قوى أقوى = نقطة أعلى |
| الروابط الهيدروجينية | قوة قوية مع روابط H-F، H-O، H-N. | نقطة عالية جداً |
| ثنائية القطب-ثنائية القطب | قوة معتدلة بين الجزيئات القطبية. | نقطة معتدلة |
| تشتت لندن | قوة ضعيفة في جميع الجزيئات، تزداد مع الحجم. | نقطة منخفضة (إلا إذا كان الجزيء كبيراً) |
| الضغط الخارجي | الضغط المطبق على المادة. | ضغط أعلى = نقطة غليان أعلى (عادةً) |
هل تحتاج إلى تحكم دقيق في درجة الحرارة لعمليات مختبرك؟ فهم تحولات الطور أمر بالغ الأهمية لتطبيقات مثل تخليق المواد، والتنقية الكيميائية، وتحضير العينات. في KINTEK، نحن متخصصون في معدات المختبرات عالية الجودة، بما في ذلك الأفران، والأفران الحرارية، وأنظمة التحكم في درجة الحرارة، المصممة لتوفير الدقة والموثوقية التي يتطلبها بحثك. دع خبرائنا يساعدونك في اختيار المعدات المثالية لتطبيقك المحدد. اتصل بنا اليوم لمناقشة احتياجات مختبرك!
دليل مرئي
المنتجات ذات الصلة
- فرن معالجة حرارية بالفراغ وفرن صهر بالحث المغناطيسي
- فرن صهر القوس لنظام الدوران بالصهر بالحث الفراغي
- فرن صهر بالحث الفراغي على نطاق المختبر
- آلة الضغط الهيدروليكي الأوتوماتيكية المسخنة بألواح مسخنة للمختبر الصحافة الساخنة 25 طن 30 طن 50 طن
- آلة مكبس هيدروليكي مسخن مع ألواح تسخين يدوية مدمجة للاستخدام في المختبر
يسأل الناس أيضًا
- ما هي الميزة التقنية لاستخدام خليط من غازي الأمونيا والهيدروجين؟ تحقيق هندسة دقيقة للأسطح
- ما هي تقنية الفصل الأكثر كفاءة؟ اختر الطريقة الأفضل لخليطك
- ما هي قضايا السمية والسلامة المتعلقة بأنابيب الكربون النانوية؟ فهم المخاطر الفيزيائية للمواد النانوية
- ما هو الغرض من التلبيد بالبلازما الشرارية؟ تحقيق التكثيف الكامل في درجات حرارة منخفضة
- لماذا توضع المغناطيسات خلف الهدف في عملية الرش (Sputtering)؟ لحصر الإلكترونات من أجل طلاءات أسرع وأنقى
- كيف تؤثر أجهزة التحريك أو الخلط المخبرية على كفاءة إنتاج الهيدروجين أثناء التخمير المظلم؟
- كيف تقرر المعدات المطلوبة في مختبرك؟ دليل استراتيجي للاستثمارات الذكية في المختبرات
- ما هي الميزات التكنولوجية الإضافية التي توفرها مجمدات درجة الحرارة المنخفضة جداً (ULT)؟ تعظيم أمان العينات وكفاءتها






















