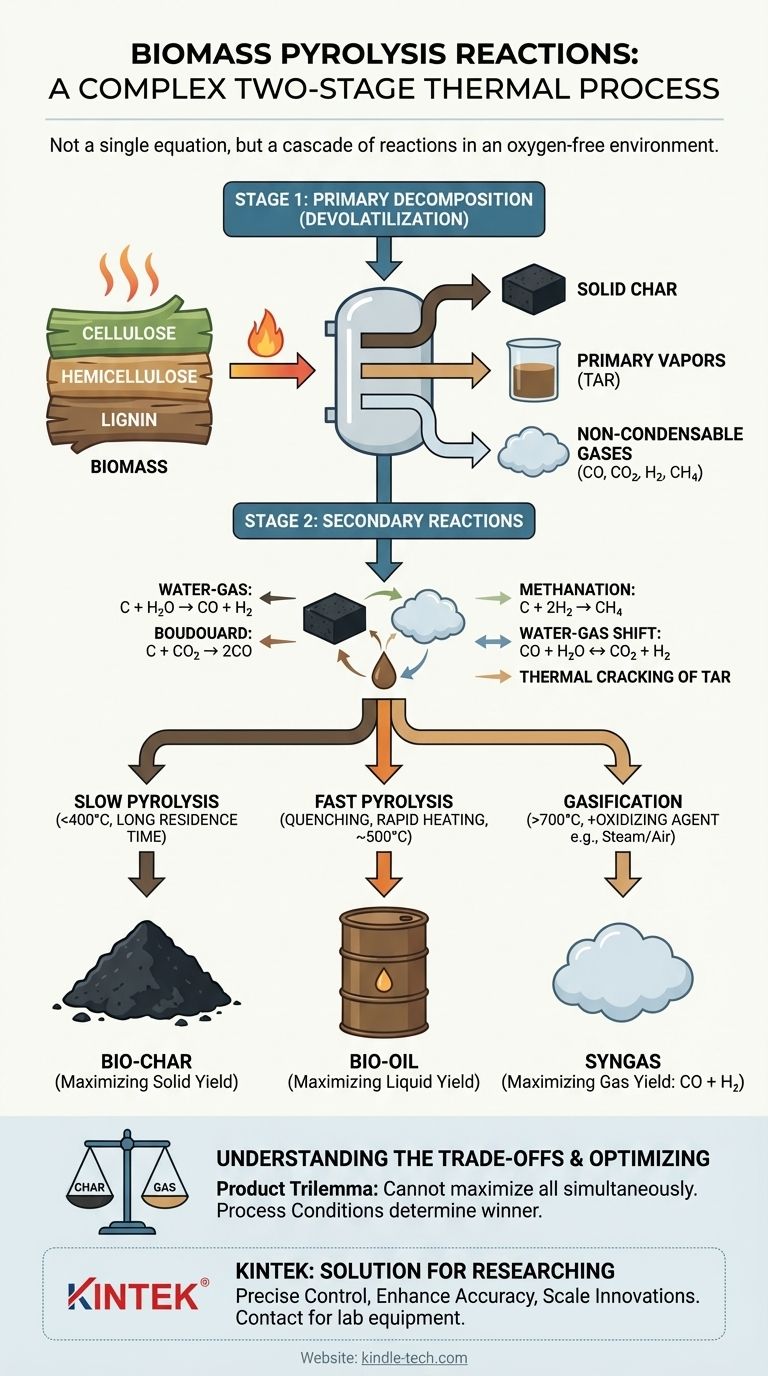
في جوهره، الانحلال الحراري للكتلة الحيوية ليس تفاعلًا كيميائيًا واحدًا، بل هو عملية حرارية معقدة من مرحلتين. أولاً، تقوم الحرارة بتكسير البوليمرات العضوية الكبيرة للكتلة الحيوية في بيئة خالية من الأكسجين (عملية تسمى إزالة المواد المتطايرة)، مما ينتج خليطًا من الفحم الصلب والأبخرة السائلة (القطران) والغازات. ثم تخضع هذه المنتجات الأولية لسلسلة من التفاعلات الثانوية، وتتفاعل مع بعضها البعض لتكوين المنتجات النهائية المستقرة من الفحم الحيوي والزيت الحيوي والغاز الاصطناعي.
يُفهم الانحلال الحراري على أفضل وجه على أنه سلسلة متتالية من التفاعلات، وليس معادلة واحدة. يتبع التكسير الحراري الأولي للكتلة الحيوية تفاعلات ثانوية تتضمن الفحم والأبخرة الناتجة. تتحدد عوائد المنتج النهائية - الفحم أو الزيت أو الغاز - بالكامل من خلال أي من مسارات التفاعل الثانوية هذه يتم تفضيلها بواسطة ظروف العملية مثل درجة الحرارة ومعدل التسخين.

مرحلتا تفاعلات الانحلال الحراري
لفهم الانحلال الحراري، يجب عليك فصل العملية إلى مرحلتين متميزتين ولكنهما مترابطتان. الأولى هي التكسير الأولي للكتلة الحيوية الصلبة، والثانية هي التحول اللاحق للمنتجات الناتجة.
المرحلة 1: التحلل الأولي (إزالة المواد المتطايرة)
هذا هو "التكسير" الحراري الأولي للكتلة الحيوية نفسها. تقوم الطاقة الحرارية بتكسير الروابط الكيميائية داخل المكونات الأساسية للكتلة الحيوية: السليلوز، الهيميسليلوز، والليجنين.
لا يتم تمثيل هذه المرحلة بمعادلة كيميائية بسيطة. إنها شبكة معقدة من تفاعلات التحلل المتزامنة التي تحول الكتلة الحيوية الصلبة إلى ثلاثة منتجات أساسية:
- الفحم الصلب: المخلفات الصلبة الغنية بالكربون المتبقية.
- الأبخرة الأولية: رذاذ قابل للتكثيف من السوائل، غالبًا ما يسمى القطران أو سلائف الزيت الحيوي.
- الغازات غير القابلة للتكثيف: غازات خفيفة مثل CO، CO₂، H₂، و CH₄.
المرحلة 2: التفاعلات الثانوية
بمجرد تشكل المنتجات الأولية، تستمر في التفاعل داخل البيئة الساخنة للمفاعل. تحدد هذه التفاعلات الثانوية في النهاية التركيب النهائي وعائد منتجاتك. أهم هذه التفاعلات تتضمن الفحم الساخن الذي يتفاعل مع الغازات والأبخرة المنتجة في المرحلة 1.
تشمل التفاعلات الثانوية الرئيسية ما يلي:
- تفاعل غاز الماء:
C (فحم) + H₂O (بخار) → CO + H₂ - تفاعل بودوار:
C (فحم) + CO₂ → 2CO - الميثان:
C (فحم) + 2H₂ → CH₄ - تحول غاز الماء:
CO + H₂O ↔ CO₂ + H₂
بالإضافة إلى ذلك، يمكن أن تخضع أبخرة القطران الثقيلة للتكسير الحراري عند درجات حرارة عالية، وتتحلل إلى غازات أخف غير قابلة للتكثيف وترسب المزيد من الكربون على الفحم.
كيف تحدد ظروف العملية النتيجة
يتم تحديد "الفائز" في المنافسة بين هذه التفاعلات من خلال ظروف العملية. من خلال التحكم في درجة الحرارة، ومعدل التسخين، ووقت الإقامة، يمكنك توجيه العملية لزيادة إنتاج الفحم أو السائل أو الغاز.
الانحلال الحراري البطيء (التركيز على الفحم الحيوي)
في الانحلال الحراري البطيء، تتيح درجات الحرارة المنخفضة (<400 درجة مئوية) ومعدلات التسخين البطيئة للتفاعلات الثانوية وقتًا كافيًا للحدوث. تفضل هذه البيئة تفاعلات تكوين الفحم وتسمح لبعض الأبخرة بالتبلمر مرة أخرى إلى مادة صلبة، مما يزيد من إنتاج الفحم الحيوي.
الانحلال الحراري السريع (التركيز على الزيت الحيوي)
في الانحلال الحراري السريع، تقوم درجات الحرارة العالية ومعدلات التسخين السريعة للغاية بتكسير الكتلة الحيوية على الفور تقريبًا. يتم إزالة الأبخرة الناتجة على الفور وتبريدها لوقف التفاعلات الثانوية. هذا "يجمد" العملية في المرحلة الوسيطة، مما يزيد من جمع الأبخرة القابلة للتكثيف كـ زيت حيوي.
التغويز (التركيز على الغاز الاصطناعي)
من الأهمية بمكان التمييز بين الانحلال الحراري والتغويز. بينما يحدث الانحلال الحراري في غياب الأكسجين تمامًا، يتضمن التغويز إدخال عامل تفاعلي مثل الأكسجين أو البخار أو الهواء عمدًا.
يعزز إدخال عامل مؤكسد عند درجات حرارة عالية تفاعلات إنتاج الغاز مثل الاحتراق الجزئي (C + ½O₂ → CO) وتفاعلات غاز الماء الموضحة أعلاه. هذا يحول الهدف بشكل أساسي نحو زيادة إنتاج الغاز الاصطناعي (CO + H₂).
فهم المقايضات
تقدم كيمياء الانحلال الحراري "معضلة المنتج الثلاثية" التي لا مفر منها: لا يمكنك زيادة إنتاج الفحم والزيت والغاز في وقت واحد من عملية واحدة.
الصراع المتأصل في المنتج
يأتي تحسين منتج واحد على حساب الآخرين. سيؤدي وقت الإقامة الطويل الذي يفضل تكوين الفحم إلى تدمير عوائد السائل حيث تتكسر الأبخرة أو تتبلمر مرة أخرى. يمنع التبريد السريع للحفاظ على الزيت الحيوي تفاعلات تكوين الغاز الثانوية من المضي قدمًا بالكامل.
تعقيد الكتلة الحيوية
الكتلة الحيوية ليست مادة كيميائية موحدة. تتحلل مكوناتها - السليلوز، الهيميسليلوز، والليجنين - عند درجات حرارة مختلفة وتنتج منتجات وسيطة مختلفة. يعني هذا التباين المتأصل أن التحكم الدقيق والتنبؤ بمسارات التفاعل يظلان تحديًا تقنيًا كبيرًا.
تحسين التفاعلات لهدفك
يجب أن يسترشد اختيارك لظروف الانحلال الحراري بالمنتج النهائي المطلوب. توفر التفاعلات الأساسية خريطة طريق واضحة لكيفية تحقيق هدفك.
- إذا كان تركيزك الأساسي هو زيادة الفحم الحيوي: استخدم الانحلال الحراري البطيء بدرجات حرارة منخفضة (~400 درجة مئوية) وأوقات إقامة طويلة لتفضيل تكوين المواد الصلبة.
- إذا كان تركيزك الأساسي هو زيادة الزيت الحيوي: استخدم الانحلال الحراري السريع بمعدلات تسخين سريعة (>100 درجة مئوية/ثانية)، ودرجات حرارة معتدلة (~500 درجة مئوية)، وأوقات إقامة قصيرة للبخار تليها تبريد سريع.
- إذا كان تركيزك الأساسي هو زيادة الغاز الاصطناعي: انتقل من الانحلال الحراري إلى التغويز عن طريق التشغيل عند درجات حرارة أعلى (>700 درجة مئوية) وإدخال عامل مثل البخار أو الهواء لدفع تفاعلات إنتاج الغاز.
يعد فهم مسارات التفاعل هذه هو المفتاح لتحويل الكتلة الحيوية الخام إلى منتجات قيمة ومصممة خصيصًا.
جدول الملخص:
| مرحلة التفاعل | العملية الرئيسية | المنتجات الأولية |
|---|---|---|
| المرحلة 1: التحلل الأولي | التكسير الحراري للسليلوز والهيميسليلوز والليجنين في بيئة خالية من الأكسجين. | فحم صلب، أبخرة أولية (قطران)، غازات غير قابلة للتكثيف (CO, CO₂, H₂) |
| المرحلة 2: التفاعلات الثانوية | يتفاعل الفحم والأبخرة بشكل أكبر (مثل غاز الماء، بودوار، التكسير). | الفحم الحيوي النهائي، الزيت الحيوي، والغاز الاصطناعي |
| العامل المتحكم | ظروف العملية (درجة الحرارة، معدل التسخين، وقت الإقامة) | يحدد عوائد المنتج النهائية |
هل أنت مستعد لإتقان عملية الانحلال الحراري لديك؟
فهم التفاعلات المعقدة هو الخطوة الأولى؛ التحكم الدقيق هو مفتاح النجاح. تتخصص KINTEK في المعدات والمواد الاستهلاكية المختبرية المتقدمة لأبحاث وتحليل الكتلة الحيوية.
سواء كنت تقوم بتطوير عملية لزيادة الفحم الحيوي لتعديل التربة، أو الزيت الحيوي للوقود المتجدد، أو الغاز الاصطناعي للطاقة، فإن المعدات المناسبة تضمن التحكم الدقيق في درجة الحرارة وإدارة التفاعل.
دع خبرة KINTEK تدعم مهمة مختبرك:
- تحقيق تحكم دقيق: تحسين درجة الحرارة ومعدلات التسخين لتوجيه التفاعلات الثانوية نحو المنتج المطلوب.
- تعزيز دقة البحث: أفران ومفاعلات موثوقة لنتائج قابلة للتكرار في دراسات الانحلال الحراري.
- توسيع ابتكاراتك: من التجارب على نطاق المختبر إلى تطوير العمليات.
اتصل بنا اليوم لمناقشة كيف يمكن لحلولنا أن تساعدك على إطلاق العنان للإمكانات الكاملة للانحلال الحراري للكتلة الحيوية لتطبيقك المحدد.
#نموذج_الاتصال للحصول على استشارة شخصية!
دليل مرئي
المنتجات ذات الصلة
- فرن دوار كهربائي صغير لتقطير الكتلة الحيوية
- آلة مصنع فرن الانحلال الحراري بالفرن الدوار الكهربائي، فرن التكليس، فرن دوار صغير، فرن دوار
- فرن دوار كهربائي يعمل بشكل مستمر مصنع تحلل صغير فرن دوار تسخين
- فرن أنبوب دوار مستمر محكم الغلق بالشفط فرن أنبوب دوار
- فرن دوار كهربائي صغير لإعادة تنشيط الكربون المنشط
يسأل الناس أيضًا
- كيف يتم إنتاج الزيت الحيوي في مجال الطاقة المتجددة؟ فتح آفاق الوقود السائل من الكتلة الحيوية عبر الانحلال الحراري السريع
- هل الانحلال الحراري موفر للطاقة؟ اكتشف عملية تحويل النفايات إلى طاقة ذاتية الاستدامة
- ما هو الاستخدام الرئيسي للتكليس؟ تنقية وتحويل المواد بمعالجة درجات الحرارة العالية
- ما هو الانحلال الحراري للكتلة الحيوية لإنتاج الهيدروجين؟ دليل للهيدروجين الأخضر السالب للكربون
- ما هي خصائص الانحلال الحراري؟ إطلاق العنان لإمكانات تحويل النفايات إلى طاقة
- ما هي فوائد مصنع الانحلال الحراري للبلاستيك؟ تحويل نفايات البلاستيك إلى موارد قيمة
- ما هو التطبيق الصناعي للتكليس؟ تحويل المواد الخام للتصنيع
- ما هو مثال على تفاعل الانحلال الحراري؟ اكتشف عملية تحويل الخشب إلى فحم.



















