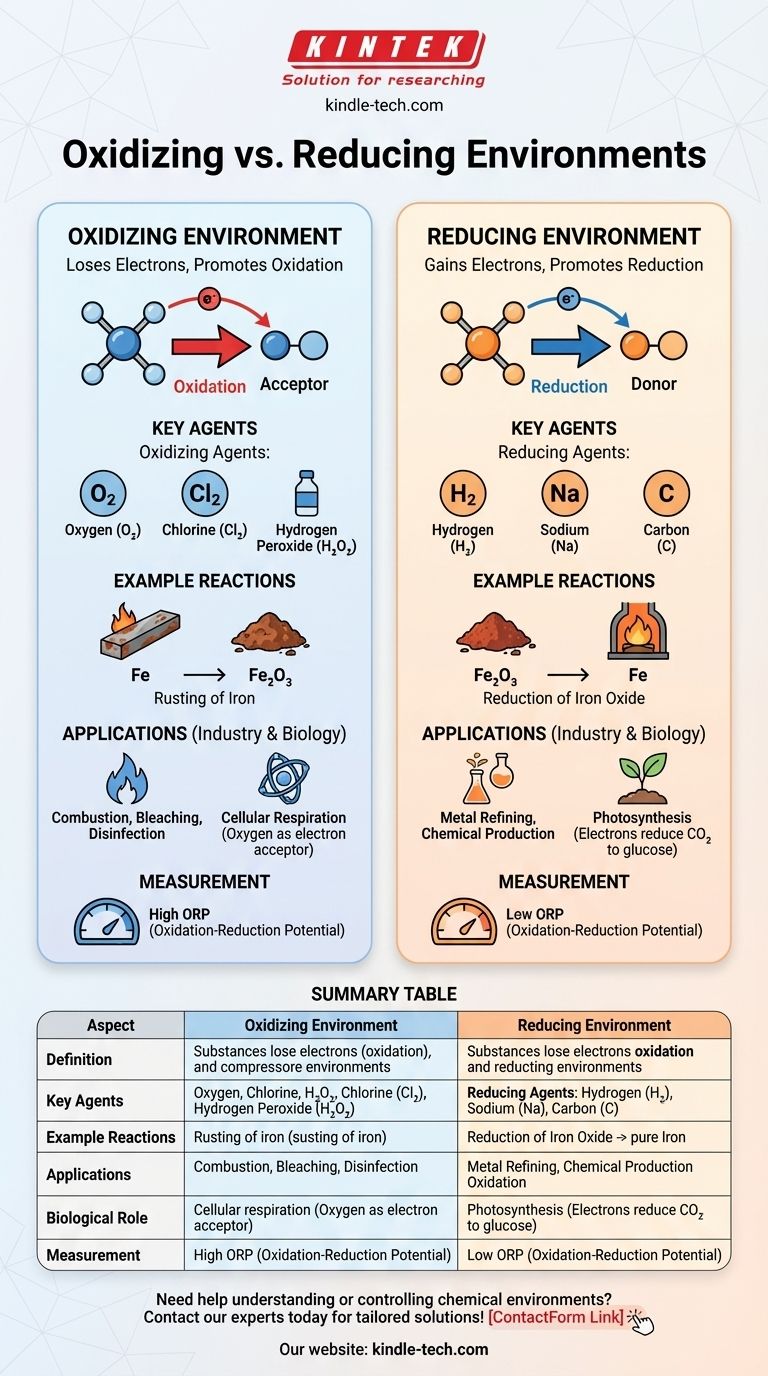
في الكيمياء، البيئة المؤكسدة هي البيئة التي تميل فيها المواد إلى فقدان الإلكترونات، مما يعزز تفاعلات الأكسدة، في حين أن البيئة المختزلة هي البيئة التي تميل فيها المواد إلى اكتساب الإلكترونات، مما يعزز تفاعلات الاختزال. يكمن الاختلاف الرئيسي في مدى توفر مستقبلات الإلكترون (العوامل المؤكسدة) أو مانحات الإلكترون (العوامل المختزلة). تتميز البيئات المؤكسدة بوجود عوامل مؤكسدة مثل الأكسجين أو الهالوجينات، والتي تسهل فقدان الإلكترونات. في المقابل، تحتوي البيئات المختزلة على عوامل مختزلة مثل الهيدروجين أو المعادن، والتي تسهل اكتساب الإلكترونات. تلعب هذه البيئات أدوارًا حاسمة في التفاعلات الكيميائية والعمليات الصناعية والأنظمة البيولوجية.

نقاط رئيسية مشروحة:
-
تعريف البيئات المؤكسدة والمختزلة:
- البيئة المؤكسدة: بيئة كيميائية تكون فيها المواد أكثر عرضة لفقدان الإلكترونات، مما يؤدي إلى الأكسدة. هذه البيئة غنية بالعوامل المؤكسدة، مثل الأكسجين أو الكلور أو غيرها من مستقبلات الإلكترون.
- البيئة المختزلة: بيئة كيميائية تكون فيها المواد أكثر عرضة لاكتساب الإلكترونات، مما يؤدي إلى الاختزال. هذه البيئة غنية بالعوامل المختزلة، مثل الهيدروجين أو المعادن أو غيرها من مانحات الإلكترون.
-
دور العوامل المؤكسدة والمختزلة:
- العوامل المؤكسدة: هي المواد التي تستقبل الإلكترونات من مواد أخرى، وبالتالي تؤكسدها. تشمل الأمثلة الشائعة الأكسجين (O₂) والكلور (Cl₂) وبيروكسيد الهيدروجين (H₂O₂).
- العوامل المختزلة: هي المواد التي تمنح الإلكترونات لمواد أخرى، وبالتالي تختزلها. تشمل الأمثلة الشائعة الهيدروجين (H₂) والصوديوم (Na) والكربون (C).
-
التفاعلات الكيميائية في البيئات المختلفة:
- البيئة المؤكسدة: في مثل هذه البيئة، تهيمن تفاعلات الأكسدة. على سبيل المثال، يحدث صدأ الحديد في بيئة مؤكسدة حيث يفقد الحديد (Fe) الإلكترونات للأكسجين، مكونًا أكسيد الحديد (Fe₂O₃).
- البيئة المختزلة: في مثل هذه البيئة، تهيمن تفاعلات الاختزال. على سبيل المثال، يتم اختزال أكاسيد المعادن إلى معادن نقية في بيئة مختزلة، كما هو الحال عند استخدام الكربون لاختزال أكسيد الحديد إلى حديد في الفرن العالي.
-
التطبيقات في الصناعة والبيولوجيا:
- التطبيقات الصناعية: تُستخدم البيئات المؤكسدة في عمليات مثل الاحتراق والتبييض والتطهير. وتعتبر البيئات المختزلة حاسمة في عمليات مثل تكرير المعادن وإنتاج بعض المواد الكيميائية.
- الأنظمة البيولوجية: في الأنظمة البيولوجية، توجد البيئات المؤكسدة في عمليات مثل التنفس الخلوي، حيث يعمل الأكسجين كمستقبل نهائي للإلكترون. وتوجد البيئات المختزلة في عمليات مثل التمثيل الضوئي، حيث يتم التبرع بالإلكترونات لاختزال ثاني أكسيد الكربون إلى جلوكوز.
-
القياس والتحكم:
- جهد الأكسدة والاختزال (ORP): يُعد جهد الأكسدة والاختزال مقياسًا لميل البيئة الكيميائية إما لاكتساب الإلكترونات أو فقدانها. يشير الجهد العالي لـ ORP إلى بيئة مؤكسدة، بينما يشير الجهد المنخفض إلى بيئة مختزلة.
- التحكم في العمليات الصناعية: في الصناعات، يعد التحكم في الطبيعة المؤكسدة أو المختزلة للبيئة أمرًا بالغ الأهمية لتحسين التفاعلات الكيميائية وضمان جودة المنتج ومنع التفاعلات الجانبية غير المرغوب فيها.
-
أمثلة على البيئات المؤكسدة والمختزلة:
- البيئة المؤكسدة: الغلاف الجوي للأرض هو بيئة مؤكسدة بسبب وجود الأكسجين. وهذا هو سبب تآكل المعادن مثل الحديد عند تعرضها للهواء.
- البيئة المختزلة: الجزء الداخلي للفرن العالي هو بيئة مختزلة حيث يعمل أول أكسيد الكربون (CO) كعامل مختزل لتحويل خام الحديد (Fe₂O₃) إلى حديد معدني (Fe).
من خلال فهم الاختلافات بين البيئات المؤكسدة والمختزلة، يمكن للكيميائيين والمهندسين التحكم في التفاعلات الكيميائية وتحسينها بشكل أفضل في مختلف التطبيقات، من العمليات الصناعية إلى الأنظمة البيولوجية.
جدول ملخص:
| الجانب | البيئة المؤكسدة | البيئة المختزلة |
|---|---|---|
| التعريف | تفقد المواد الإلكترونات (أكسدة) بسبب مستقبلات الإلكترون مثل الأكسجين أو الهالوجينات. | تكتسب المواد الإلكترونات (اختزال) بسبب مانحات الإلكترون مثل الهيدروجين أو المعادن. |
| العوامل الرئيسية | العوامل المؤكسدة: الأكسجين (O₂)، الكلور (Cl₂)، بيروكسيد الهيدروجين (H₂O₂). | العوامل المختزلة: الهيدروجين (H₂)، الصوديوم (Na)، الكربون (C). |
| أمثلة التفاعلات | صدأ الحديد (Fe → Fe₂O₃). | اختزال أكسيد الحديد إلى حديد (Fe₂O₃ → Fe). |
| التطبيقات | الاحتراق، التبييض، التطهير. | تكرير المعادن، إنتاج المواد الكيميائية. |
| الدور البيولوجي | التنفس الخلوي (الأكسجين كمستقبل للإلكترون). | التمثيل الضوئي (الإلكترونات تختزل ثاني أكسيد الكربون إلى جلوكوز). |
| القياس | جهد أكسدة واختزال مرتفع (ORP). | جهد أكسدة واختزال منخفض (ORP). |
هل تحتاج إلى مساعدة في فهم أو التحكم في البيئات الكيميائية؟ اتصل بخبرائنا اليوم
دليل مرئي
المنتجات ذات الصلة
- فرن غاز خامل بالنيتروجين المتحكم فيه
- نظام معدات آلة HFCVD لطلاء النانو الماسي لقوالب السحب
- نظام معدات ترسيب البخار الكيميائي متعدد الاستخدامات ذو الأنبوب الحراري المصنوع حسب الطلب للعملاء
- فرن صهر بالحث الفراغي على نطاق المختبر
- فرن الجرافيت بالفراغ لمواد القطب السالب فرن الجرافيت
يسأل الناس أيضًا
- ما هي الغازات المستخدمة في التلدين؟ اختر الغلاف الجوي المناسب لمعدنك
- لماذا تُستخدم أفران الغلاف الجوي ذات درجات الحرارة العالية للأكسدة المسبقة؟ تعزيز اختبار أداء تفحم السبائك
- لماذا تعتبر الغازات الخاملة حاسمة في اللحام بالنحاس؟ حماية المفاصل وتعزيز الجودة باستخدام النيتروجين والهيليوم والأرجون
- ما هي التطبيقات الشائعة لجو الهيدروجين الجاف؟ تعزيز الدقة في علم المعادن واللحام المتقدم
- ما هو جو فرن المعالجة الحرارية؟ إتقان كيمياء السطح للمواد الفائقة
- ما هو التركيب النموذجي لخلائط الغازات الواقية المستخدمة في المعالجة الحرارية الصناعية؟ التحكم في الغلاف الجوي الرئيسي
- لماذا من الضروري استخدام معدات يتم التحكم في جوها لإلكتروليتات الكبريتيد الصلبة؟ ضمان الموصلية العالية
- كيف تخلق جوًا مختزلًا في الفرن؟ إتقان الطرق للحصول على نتائج خالية من الأكسدة












