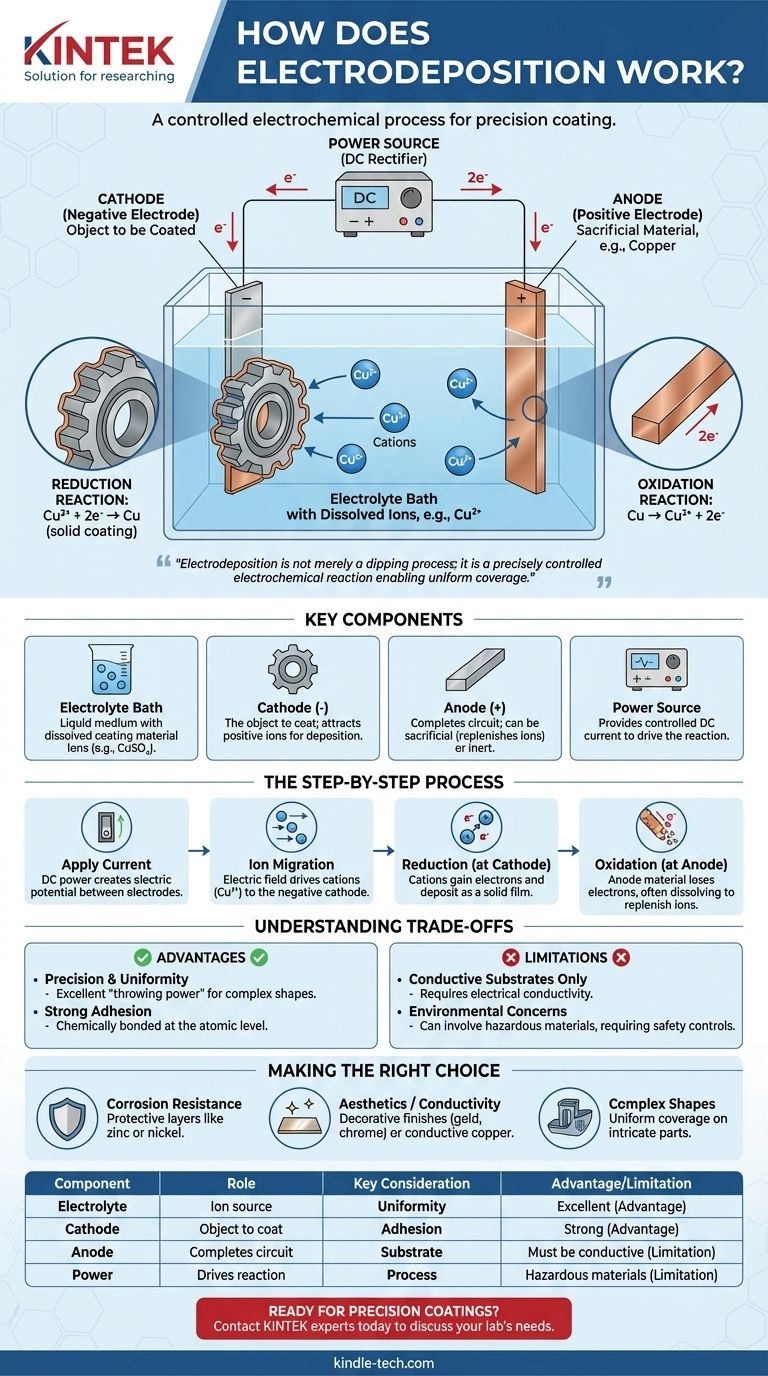
في جوهره، الترسيب الكهربائي هو عملية تستخدم تيارًا كهربائيًا لطلاء جسم موصل بطبقة رقيقة من المادة. يتم تحقيق ذلك عن طريق غمر الجسم (الكاثود) وإلكترود ثانٍ (الأنود) في محلول كيميائي، أو حمام إلكتروليت، يحتوي على أيونات مذابة من مادة الطلاء. عند تطبيق تيار مباشر، تنجذب هذه الأيونات إلى سطح الجسم، حيث "تترسب" كصلب، مما يخلق طبقة معدنية أو عضوية موحدة وملتصقة.
الرؤية الحاسمة هي أن الترسيب الكهربائي ليس مجرد عملية غمس؛ إنه تفاعل كيميائي كهربائي يتم التحكم فيه بدقة. يحدد المجال الكهربائي مكان وكيفية تشكل الطلاء، مما يتيح التغطية الموحدة حتى لأكثر الأشكال تعقيدًا بطبقة يتناسب سمكها طرديًا مع التيار المطبق والوقت.

المكونات الرئيسية لخلية الترسيب الكهربائي
لفهم العملية، يجب عليك أولاً فهم مكوناتها الأساسية. يتكون كل إعداد للترسيب الكهربائي، من كوب مختبر إلى خزان صناعي، من أربعة أجزاء أساسية تعمل بالتنسيق.
حمام الإلكتروليت
الإلكتروليت هو الوسط السائل الذي يسهل العملية بأكملها. إنه محلول، عادة ما يكون مائيًا، يحتوي على أملاح مذابة من المادة المراد ترسيبها. على سبيل المثال، في طلاء النحاس، يحتوي الحمام على ملح مثل كبريتات النحاس (CuSO₄)، الذي يوفر أيونات النحاس (Cu²⁺).
الكاثود (القطب السالب)
هذا هو الجسم الذي تنوي طلاءه. يتم توصيله بالطرف السالب لمصدر الطاقة. الشحنة السالبة على سطحه هي التي تجذب أيونات المعدن المشحونة إيجابًا من حمام الإلكتروليت.
الأنود (القطب الموجب)
متصل بالطرف الموجب لمصدر الطاقة، يكمل الأنود الدائرة الكهربائية. يمكن أن تكون الأنودات إما "تضحوية"، مصنوعة من نفس مادة الطلاء، وتذوب لتجديد الأيونات في الحمام، أو "خاملة"، مصنوعة من مادة غير تفاعلية مثل البلاتين أو الكربون.
مصدر الطاقة
يوفر مصدر طاقة تيار مباشر (DC)، مثل المقوم، الطاقة الكهربائية اللازمة لدفع التفاعل. يتم التحكم في الجهد والتيار بعناية لإدارة معدل وجودة الترسيب.
العملية الكهروكيميائية خطوة بخطوة
مع وجود المكونات في مكانها، تتكشف العملية كسلسلة متحكم بها من الأحداث الكهروكيميائية.
تطبيق التيار
في اللحظة التي يتم فيها تشغيل طاقة التيار المستمر، يتم إنشاء جهد كهربائي بين الأنود والكاثود. وهذا يخلق مجالًا كهربائيًا في جميع أنحاء حمام الإلكتروليت.
هجرة الأيونات
مدفوعة بهذا المجال الكهربائي، تبدأ الجسيمات المشحونة (الأيونات) في المحلول بالتحرك. تنجذب الأيونات المشحونة إيجابًا، والمعروفة باسم الكاتيونات (مثل Cu²⁺)، إلى الكاثود المشحون سلبًا (قطعة العمل).
تفاعل الاختزال عند الكاثود
هذا هو جوهر عملية الطلاء. عندما تصل الكاتيونات إلى سطح الكاثود، فإنها تكتسب إلكترونات. تسمى هذه العملية الكيميائية الاختزال. يؤدي اكتساب الإلكترونات إلى تحييد شحنتها، مما يتسبب في ترسبها على السطح كطبقة معدنية صلبة.
بالنسبة للنحاس، التفاعل هو: Cu²⁺ (في المحلول) + 2e⁻ → Cu (طلاء صلب)
تفاعل الأكسدة عند الأنود
في الوقت نفسه، يحدث تفاعل مماثل يسمى الأكسدة عند الأنود، حيث تفقد المادة الإلكترونات. إذا تم استخدام أنود تضحوي، فإنه يذوب ببطء في الحمام، ويجدد أيونات المعدن التي ترسبت على الكاثود ويضمن عملية مستقرة.
تفاعل أنود النحاس التضحوي هو: Cu (أنود صلب) → Cu²⁺ (في المحلول) + 2e⁻
فهم المفاضلات
على الرغم من قوته، فإن الترسيب الكهربائي ليس حلاً عالميًا. فهم مزاياه وقيوده أمر بالغ الأهمية لتطبيقه الصحيح.
ميزة: الدقة والتوحيد
القوة الأساسية للترسيب الكهربائي هي قدرته على إنشاء طبقات موحدة للغاية، حتى على الأجسام ذات الأشكال الهندسية المعقدة والثقوب والأسطح الداخلية. يصعب تحقيق "قوة الرمي" هذه باستخدام طرق الرؤية المباشرة مثل الرش بالطلاء.
ميزة: التصاق قوي
نظرًا لأن الطلاء يتشكل من خلال رابطة كهروكيميائية على المستوى الذري، فإن الالتصاق بين الركيزة والطبقة المترسبة قوي ومتين بشكل استثنائي.
قيد: ركائز موصلة فقط
تعتمد العملية بشكل أساسي على قدرة قطعة العمل على توصيل الكهرباء. لا يمكن طلاء المواد غير الموصلة مثل البلاستيك أو السيراميك مباشرة دون معالجتها أولاً بطبقة موصلة.
قيد: المخاوف البيئية والسلامة
تحتوي العديد من حمامات الإلكتروليت الصناعية على مواد خطرة، مثل الأحماض القوية أو المعادن الثقيلة أو السيانيدات. وهذا يتطلب ضوابط صارمة للعملية، ومعالجة متخصصة للنفايات، وبروتوكولات سلامة قوية لحماية العمال والبيئة.
اتخاذ الخيار الصحيح لهدفك
يعتمد قرار استخدام الترسيب الكهربائي على هدفك الفني المحدد.
- إذا كان تركيزك الأساسي هو مقاومة التآكل: الترسيب الكهربائي هو خيار ممتاز لتطبيق طبقات واقية مثل الزنك (الجلفنة) أو النيكل، والتي تخلق حاجزًا كثيفًا غير مسامي ضد العوامل الجوية.
- إذا كان تركيزك الأساسي هو الجماليات أو التوصيل: العملية مثالية للتشطيبات الزخرفية مثل الكروم والذهب والفضة، أو لتطبيق طبقات عالية التوصيل من النحاس في تصنيع الإلكترونيات.
- إذا كان تركيزك الأساسي هو طلاء الأشكال المعقدة والمتقنة: قدرة الترسيب الكهربائي على تغطية جميع الأسطح المبللة بشكل موحد تجعله متفوقًا على أي طريقة أخرى تقريبًا للأجزاء ذات الميزات الداخلية أو الخارجية المعقدة.
من خلال إتقان التفاعل بين الكيمياء والكهرباء، يوفر الترسيب الكهربائي تحكمًا لا مثيل له في هندسة السطح لتلبية حاجة محددة.
جدول ملخص:
| المكون | الدور في الترسيب الكهربائي |
|---|---|
| حمام الإلكتروليت | محلول يحتوي على أيونات مذابة من مادة الطلاء. |
| الكاثود | الجسم المراد طلاؤه؛ يجذب الأيونات الموجبة. |
| الأنود | يكمل الدائرة؛ يمكن أن يكون تضحويًا أو خاملًا. |
| مصدر الطاقة | يوفر التيار المباشر (DC) لدفع التفاعل. |
| الاعتبار الرئيسي | ميزة / قيد |
|---|---|
| توحيد الطلاء | ممتاز للأشكال المعقدة (ميزة) |
| الالتصاق | رابطة قوية على المستوى الذري (ميزة) |
| الركيزة | يتطلب سطحًا موصلًا (قيد) |
| العملية | تتضمن مواد خطرة (قيد) |
هل أنت مستعد لتحقيق طلاءات دقيقة في مختبرك؟
تعتبر عملية الترسيب الكهربائي المتحكم بها ضرورية للتطبيقات التي تتطلب طبقات معدنية موحدة، من الحماية من التآكل إلى التوصيل الإلكتروني. تتخصص KINTEK في توفير معدات المختبرات والمواد الاستهلاكية الموثوقة التي تحتاجها لإتقان عمليات الترسيب الكهربائي بأمان وكفاءة.
اتصل بخبرائنا اليوم لمناقشة كيف يمكن لحلولنا تعزيز قدرات مختبرك ومساعدتك في تحقيق أهداف الطلاء المحددة الخاصة بك.
دليل مرئي
المنتجات ذات الصلة
- نظام معدات آلة HFCVD لطلاء النانو الماسي لقوالب السحب
- 915MHz MPCVD Diamond Machine Microwave Plasma Chemical Vapor Deposition System Reactor
- مناخل ومكائن اختبار معملية
- أدوات قطع الماس CVD الفارغة للتشغيل الدقيق
- قطب دوار بقرص وحلقة (RRDE) / متوافق مع PINE، و ALS اليابانية، و Metrohm السويسرية من الكربون الزجاجي والبلاتين
يسأل الناس أيضًا
- ما هو دور نظام HF-CVD في تحضير أقطاب BDD؟ حلول قابلة للتطوير لإنتاج الألماس المخدر بالبورون
- كيف يعمل مفاعل الترسيب الكيميائي للبخار بالفتيل الساخن (HFCVD)؟ دليل الخبراء لتصنيع أغشية الألماس
- كيف يتم طلاء شيء بالماس؟ دليل لطرق نمو الترسيب الكيميائي للبخار (CVD) مقابل طرق الطلاء
- ما هو ترسيب البلازما الكيميائي بالميكروويف (MPCVD)؟ دليل لتركيب الماس عالي النقاء والمواد
- ما هي مزايا استخدام HFCVD لأقطاب BDD؟ توسيع نطاق إنتاج الماس الصناعي بكفاءة



















