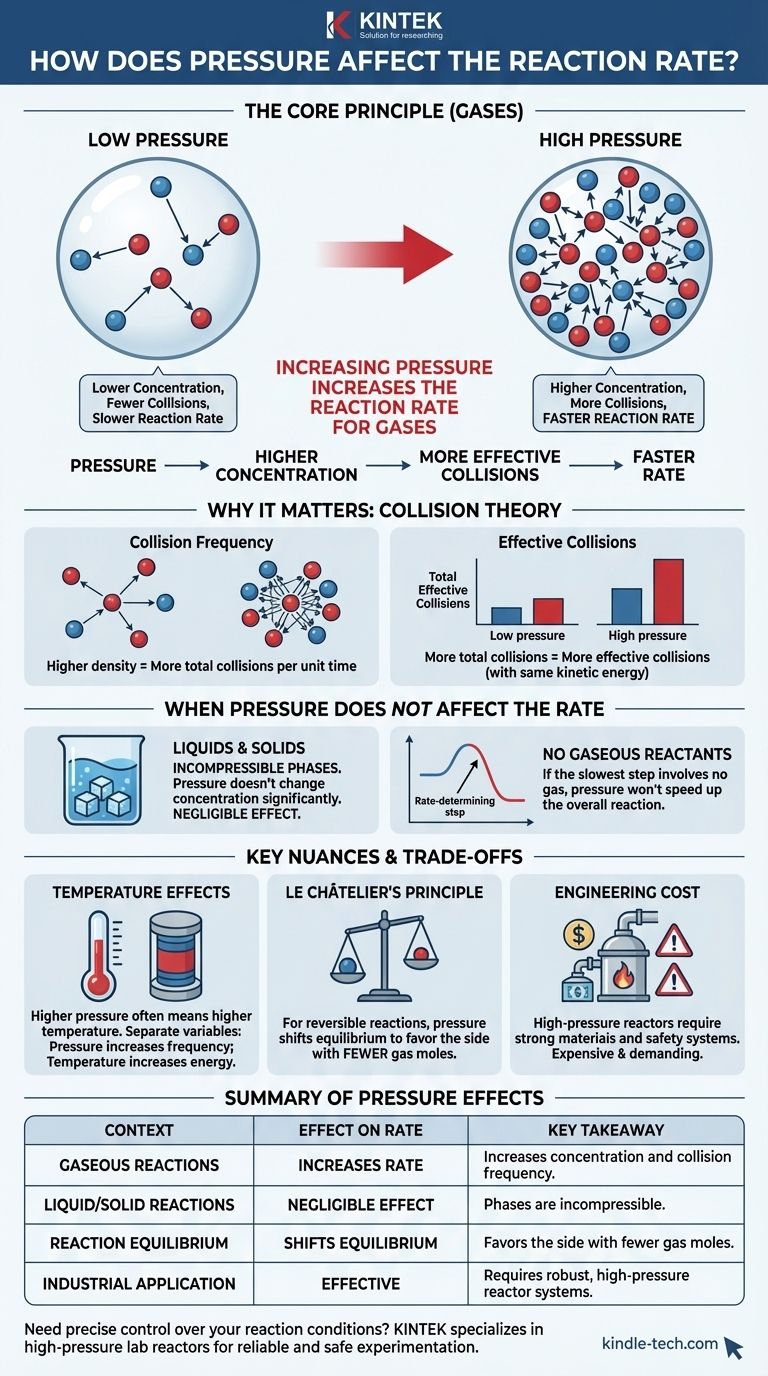
باختصار، زيادة ضغط التفاعل الذي يشمل الغازات يزيد من سرعة التفاعل. يحدث هذا لأن الضغط هو مقياس مباشر لتركيز الغازات. عن طريق ضغط جزيئات الغاز في حجم أصغر، فإنك تزيد من احتمالية تصادمها وتفاعلها مع بعضها البعض.
المبدأ الأساسي هو أنه بالنسبة للتفاعلات الغازية، يعمل الضغط كرافعة مباشرة على التركيز. يجبر الضغط الأعلى جزيئات الغاز على الاقتراب من بعضها البعض، مما يزيد من تكرار التصادمات الفعالة وبالتالي يسرع التفاعل. هذا التأثير ضئيل للتفاعلات في الطور السائل أو الصلب.

الآلية الأساسية: لماذا يهم الضغط
لفهم تأثير الضغط حقًا، نحتاج إلى العودة إلى المبادئ الأساسية لكيفية حدوث التفاعلات الكيميائية. كل شيء يدور حول مفهوم تصادم الجسيمات.
الضغط كمقياس للتركيز
بالنسبة للغازات، الضغط ليس قوة مجردة؛ إنه نتيجة لتصادم جزيئات الغاز بجدران الوعاء الخاص بها.
يُظهر قانون الغاز المثالي علاقة مباشرة بين الضغط (P) وعدد المولات (n) في حجم معين (V) عند درجة حرارة ثابتة (T). المزيد من الجزيئات في نفس الحيز يعني ضغطًا أكبر. لذلك، فإن زيادة الضغط تعادل وظيفيًا زيادة التركيز.
دور نظرية التصادم
تحدث التفاعلات الكيميائية عندما تتصادم جسيمات المتفاعلات مع استيفاء شرطين رئيسيين:
- يجب أن تمتلك طاقة حركية كافية للتغلب على حاجز طاقة التنشيط.
- يجب أن تتصادم بالاتجاه المادي الصحيح.
يسمى التصادم الذي يستوفي كلا الشرطين تصادمًا فعالًا. يتم تحديد معدل التفاعل من خلال تكرار هذه التصادمات الفعالة.
ضغط أكبر = تصادمات أكثر
عندما تزيد ضغط نظام غازي، فإنك تجبر نفس العدد من الجزيئات على الدخول في حجم أصغر.
هذه الكثافة الأعلى تعني أن متوسط المسافة بين الجزيئات يقل. وبالتالي، فإن العدد الإجمالي للتصادمات بين جزيئات المتفاعلات في وحدة الزمن يزداد بشكل كبير.
التأثير على التصادمات "الفعالة"
في حين أن زيادة الضغط تزيد من العدد الإجمالي للتصادمات، إلا أنها لا تغير الطاقة الحركية للجزيئات الفردية (بافتراض أن درجة الحرارة ثابتة).
لذلك، تظل نسبة التصادمات الفعالة كما هي. ومع ذلك، نظرًا لأن العدد الإجمالي للتصادمات قد زاد، فإن العدد المطلق للتصادمات الفعالة في الثانية يزداد أيضًا. هذا هو ما يدفع معدل التفاعل إلى الأعلى.
متى لا يؤثر الضغط على المعدل
الرابط بين الضغط وسرعة التفاعل قوي، ولكنه ليس عالميًا. من الضروري معرفة متى لا ينطبق.
التفاعلات في الأطوار السائلة والصلبة
تعتبر السوائل والمواد الصلبة أطوارًا غير قابلة للانضغاط. لا يؤدي تطبيق الضغط الخارجي إلى تغيير حجمها أو التباعد بين جسيماتها المكونة بشكل كبير.
نظرًا لأن تغيرات الضغط لا تغير تركيز المتفاعلات في السوائل والمواد الصلبة، فإن للضغط تأثيرًا ضئيلًا على معدلات التفاعلات التي تحدث فقط في هذه الأطوار.
التفاعلات التي لا تحتوي على متفاعلات غازية
إذا كانت آلية التفاعل تتضمن خطوات متعددة، يتم تحديد المعدل الإجمالي بواسطة أبطأ خطوة، والمعروفة باسم الخطوة المحددة للمعدل.
إذا كانت هذه الخطوة المحددة للمعدل لا تتضمن أي متفاعلات غازية، فإن التغيرات في الضغط الخارجي لن تؤثر على معدل التفاعل الإجمالي.
فهم المفاضلات والفروق الدقيقة
يعد التحكم في الضغط استراتيجية صناعية شائعة، ولكنه يأتي مع اعتبارات مهمة تتجاوز مجرد تغييرات المعدل.
التمييز عن تأثيرات درجة الحرارة
في الممارسة العملية، يؤدي ضغط الغاز إلى زيادة درجة حرارته. كل من ارتفاع الضغط وارتفاع درجة الحرارة يزيدان من سرعات التفاعل، ولكن لأسباب مختلفة.
من الضروري عزل المتغيرات. يزيد الضغط من تكرار التصادمات، بينما تزيد درجة الحرارة من طاقة وقوة تلك التصادمات، مما يجعل نسبة أعلى منها فعالة.
مبدأ لو شاتيليه والتوازن
بالنسبة للتفاعلات العكسية التي تصل إلى حالة التوازن، يلعب الضغط دورًا مزدوجًا. وفقًا لمبدأ لو شاتيليه، فإن زيادة الضغط ستحول موضع التوازن لتفضيل الجانب من التفاعل الذي يحتوي على عدد أقل من مولات الغاز.
هذا مفهوم منفصل عن الحركية (المعدل). يزيد الضغط من معدل كل من التفاعل الأمامي والعكسي، ولكنه قد يحول التوازن النهائي للمنتجات والمتفاعلات.
التكلفة الهندسية للضغط العالي
يعد بناء وصيانة المفاعلات عالية الضغط أمرًا صعبًا تقنيًا ومكلفًا. يجب أن تكون المواد قوية بما يكفي لتحمل الإجهاد، وهناك حاجة إلى أنظمة أمان واسعة لمنع الأعطال الكارثية. يمثل هذا الموازنة الاقتصادية والسلامة عاملاً رئيسيًا في تصميم العمليات الصناعية.
تطبيق هذا على هدفك
يعتمد نهجك في استخدام الضغط بالكامل على النظام الكيميائي الذي تعمل به وما تحاول تحقيقه.
- إذا كان تركيزك الأساسي هو زيادة سرعة التفاعل لعملية غازية: تعتبر زيادة الضغط طريقة مباشرة وفعالة، شريطة أن تتمكن من إدارة تغيرات درجة الحرارة وتكاليف الهندسة المرتبطة بها.
- إذا كنت تدرس التوازن الكيميائي: تذكر أن الضغط يؤثر على كل من معدلات التفاعل وموضع التوازن النهائي، ويفضل الجانب الذي يحتوي على عدد أقل من جزيئات الغاز.
- إذا كان تفاعلك يشمل السوائل أو المواد الصلبة فقط: إن تغيير الضغط الخارجي ليس استراتيجية قابلة للتطبيق للتحكم في سرعة التفاعل؛ ركز على درجة الحرارة أو التركيز أو المحفزات بدلاً من ذلك.
من خلال فهم الارتباط المباشر للضغط بالتركيز، تكتسب رافعة قوية للتحكم في حركية التفاعلات الغازية.
جدول ملخص:
| تأثير الضغط على سرعة التفاعل | الخلاصة الرئيسية |
|---|---|
| التفاعلات الغازية | يزيد المعدل عن طريق زيادة التركيز وتكرار التصادمات. |
| تفاعلات السائل/الصلب | تأثير ضئيل؛ الأطوار غير قابلة للانضغاط. |
| توازن التفاعل | يحول التوازن لتفضيل الجانب الذي يحتوي على عدد أقل من مولات الغاز. |
| التطبيق الصناعي | فعال ولكنه يتطلب أنظمة مفاعلات قوية وعالية الضغط. |
هل تحتاج إلى تحكم دقيق في ظروف التفاعل لديك؟ تتخصص KINTEK في المفاعلات والمعدات المعملية عالية الضغط المصممة للتجريب الموثوق والآمن. سواء كنت تقوم بتحسين سرعة تفاعل غازي أو دراسة التوازن الكيميائي، فإن حلولنا توفر الأداء والأمان الذي تحتاجه. اتصل بخبرائنا اليوم للعثور على النظام المثالي لتحديات مختبرك الفريدة.
دليل مرئي
المنتجات ذات الصلة
- مفاعلات الضغط العالي القابلة للتخصيص للتطبيقات العلمية والصناعية المتقدمة
- مفاعل مفاعل ضغط عالي من الفولاذ المقاوم للصدأ للمختبر
- مفاعل مفاعل عالي الضغط صغير من الفولاذ المقاوم للصدأ للاستخدام المخبري
- فرن أنبوبي عالي الضغط للمختبرات
- مفاعل الأوتوكلاف عالي الضغط للمختبرات للتخليق المائي الحراري
يسأل الناس أيضًا
- كيف يثبت مفاعل الضغط العالي قيمته في الشيخوخة المتسارعة؟ توقع متانة المحفز بسرعة
- ما هي وظيفة مفاعل التخليق المائي ذو درجة الحرارة الثابتة؟ إتقان تنشيط رماد الفحم المتطاير
- ما هي الأدوار التي تلعبها الأفران الأوتوكلافية في تخليق الزيوليت من نوع MFI؟ إتقان نمو البلورات الحرارية المائية
- ما هو دور المفاعلات عالية الضغط في دراسة أكسدة السبائك؟ أدوات أساسية للبحث فوق الحرج
- لماذا تعتبر أوعية التفاعل المختبرية المغلقة ضرورية في التخليق المائي الحراري للزيوليت؟ ضمان النقاء والإنتاجية



















